草本植物根际邻苯二甲酸二(2-乙基己基)酯降解菌的分离与降解特性
刘淑娟,张翠萍,李淑英,李学孺,李元,周元清*
(1.云南农业大学动物科学技术学院,昆明 650201;2.玉溪师范学院化学生物与环境学院,云南 玉溪 653100;3.玉溪师范学院教师教育学院,云南 玉溪 653100)
邻苯二甲酸酯类化合物(PAEs)种类较多,主要作为增塑剂应用于塑料制品的制造和加工。其可通过食物链进入人体,导致人类生殖、神经和免疫系统功能失调。PAEs是典型的环境内分泌干扰物,其中邻苯二甲酸二(2-乙基己基)酯(DEHP)是检出最多且最难降解的PAEs污染物,土壤中的DEHP会影响微生物群落结构和酶活性,对蚯蚓造成氧化应激和DNA损伤,抑制植物根和茎的伸长(特别是在较高浓度下)。此外,DEHP也严重威胁人类健康。近年来,PAEs修复技术研究备受关注,陆续报道了物理吸附、化学混凝/絮凝、高级氧化和细菌生物降解等。其中,细菌驱动的PAEs降解极具优势:污染物降解更完全、处理成本更低、安全性更高、环境扰动更小。因此,有关PAEs降解菌的分离、降解特性、分子机制和实验室规模的生物修复应用等研究广泛。
草本植物构建的人工湿地是集植物-微生物-基质为一体的生态工程措施,在净化有机污染物方面效果显著。已有研究表明,自然环境中PAEs的代谢主要依靠各种土著细菌的共同作用。目前已经从海洋塑料碎屑污泥、农业土壤、塑料污染的土壤、垃圾填埋场污泥、活性污泥等环境中分离获得了大量DEHP降解菌,但从湿地草本植物根际土壤中分离DEHP降解菌的研究尚鲜见。在前期调查基础上,本研究以DEHP作为目标污染物,从PAEs污染的湿地(PAEs含量约为18.87~37.36 mg·kg)草本植物根际土壤中筛选DEHP高效降解菌株,并通过生理生化特征、16SrDNA序列分析对菌株进行鉴定,分析不同环境因素对菌株生长及降解特性的影响,以期为人工湿地草本植物配置和调控PAEs降解效能提供一定的理论依据。
1 材料与方法
1.1 供试材料
供试样品:在玉溪市抚仙湖、星云湖流域,选取PAEs污染的人工湿地,采集草本植物根际土壤。拨开表层土壤,去除植物残枝、碎砾石等,用不锈钢土钻采集植物根际土壤(5~10 cm表层)100 g,土样避光储存于预先洗净烘干的棕色玻璃瓶(250 mL)中,并于4℃冷藏运至实验室,置于-80℃冰箱保存备用。土壤样品按照HJ/T 166—2004的相关要求采集和保存。
参照文献[22]配制富集培养基(BM)、无机盐离子培养基(MSM)、LB培养基。上述培养基均用去离子水配制,用0.1 mol·LHCl和0.1 mol·LNaOH调节pH至7.0,固体培养基加琼脂20.0 g·L。所有培养基按需(取100 mL装至250 mL锥形瓶)分装后,于121℃灭菌30 min,冷却备用。
选择培养基的制备:取DEHP试剂(分析纯)10 mL(=1 g·mL)置于棕色容量瓶,用正己烷(分析纯)定容至100 mL,移取0.1 mL DEHP正己烷溶液至100 mL灭菌的无机盐培养基中,置于通风橱内,待正己烷完全挥发,即获得100 mg·L的DEHP溶液选择培养基。
菌悬液的制备:挑取新鲜单菌落接种到LB液体培养基中,在恒温培养箱中30℃、120 r·min恒温培养至OD≥0.8(以不接菌的LB液体培养基作空白对照),取菌液2 mL至已灭菌的离心管(规格2 mL),室温条件下于12 000 r·min离心分离5 min。弃上清液后,加入灭菌的磷酸盐缓冲液(PBS,0.01 mol·L,pH 7.2),重悬后再次离心,重复3次后,用缓冲液定容至2 mL。
1.2 主要供试仪器与试剂
仪器:气相色谱质谱联用仪赛默飞世尔TEACE 1300-ISQLT;UV-5100紫外可见分光光度计、ZD-85双功能气浴恒温振荡器;H2100R离心机(湖南长沙湘仪);ZHWY-2112恒温振荡培养箱、RE-52AA真空旋转蒸发器。
DEHP试剂:=1 g·mL,每瓶500 mL,分析纯,购自国药集团化学试剂有限公司;DEHP标准品:=1 000 mg·L,规格为每支1 mL;内标储备液[氘代邻苯二甲酸二(2-乙基)己酯]:=1 000 mg·L,溶剂为乙酸乙酯,购于o2si公司(USA)。苯甲酸苄酯:色谱级,储备液,=5 000μg·mL,购于上海安谱实验科技股份有限公司,移取200μL储备液于10 mL棕色容量瓶,用乙酸乙酯定容制备得到中间液(=100μg·mL);移取2 mL中间液于10 mL棕色容量瓶,用乙酸乙酯定容制备得使用液(=20μg·mL)。正己烷(农残级)、乙酸乙酯(色谱纯)购于上海安谱实验科技股份有限公司,无水硫酸钠(分析纯),550℃烘烤5 h,购于国药集团;质谱调谐溶液:十氟三苯基膦(DFTPP),=5 mg·L。玻璃材质弗罗里硅藻土小柱:填料500 mg,柱规格3 mL。高纯氮气:纯度≥99.999%。高纯氦气:纯度≥99.999%。实验用水为Milli-Q超纯水。磷酸盐缓冲液(PBS,0.01 mol·L,pH7.2,规格500 mL)购自谱析-标准物质中心。
1.3 试验方法
1.3.1 DEHP降解菌的富集、驯化、分离与筛选
参照文献[22]进行DEHP降解菌的富集、驯化、分离与筛选。
DEHP降解菌的富集与驯化:称取10 g土样,加到100 mL(含DEHP 100 mg·L)BM培养基中,置于摇床振荡培养7d(30℃、120 r·min),第7 d时取2 mL富集培养上清液接种于100 mL新鲜BM培养基(含DEHP 100 mg·L)中,采用梯度压力驯化法,每7 d进行一次转接,转接时底物DEHP添加量逐次提高,即100、200、300、400、500、600 mg·L。取终期BM培养基中富集培养液2 mL,离心收集菌体(12 000 r·min、5 min),用PBS缓冲液(pH 7.2)重复冲洗3次,将菌体重悬于PBS缓冲液(约2 mL)并接种至含100 mg·LDEHP的MSM培养基中,避光条件下进行恒温振荡培养(30℃、120 r·min)7 d。采用梯度压力驯化法,每7 d进行一次转接,按2%(体积比)接菌量逐次转接至含有DEHP浓度分别为200、400、600、800、1 000 mg·L的100 mL MSM液体培养基中,避光恒温振荡培养(30℃、120 r·min)。
降解菌的分离与筛选:取MSM培养基中每个驯化周期的培养液0.1 mL,涂布至MSM培养基固体平板上,于恒温(30℃)培养箱中避光倒置培养72 h,观察平板中菌落生长状况,筛选长势好的单菌落,反复划线至平板直至纯化。挑取纯化的单菌落接种至100 mL灭菌的LB液体培养基,以不接菌的LB液体培养基作对照,待菌体浓度达到OD=0.8后取2 mL菌悬液(重悬于PBS缓冲液),接种至100 mL含100 mg·LDEHP的MSM液体培养基中,以相同条件但不接菌作为对照,于恒温振荡培养箱中培养7d(30℃、120 r·min)后测定底物残留量,筛选出降解菌。上述实验均设3次重复。
降解菌降解能力验证:将筛选的降解菌接种至新鲜的LB液体培养基,扩繁菌体后,取2 mL菌液用PBS缓冲液重悬菌体3次后,接入100 mL含100 mg·LDEHP的MSM液体培养基中,以不接菌的MSM液体培养基作为对照,所有处理组与对照均设3次重复,每12 h测定一次底物浓度及菌株生长情况(OD)。将具有降解能力的菌株进行保存,选取降解效率最高、降解能力稳定且生长状况良好的菌株进行后续研究。
1.3.2 菌株的鉴定
利用微生物生化鉴定试剂对菌株进行生理生化特性的测定,委托上海派森诺基因科技有限公司测定菌株的16SrDNA序列,综合菌株的形态特征、生理生化特征及16SrDNA序列分析结果,对菌株进行鉴定。
1.3.3 环境条件对菌株降解DEHP的影响
1.3.3.1 pH
将菌悬液接种到初始浓度为100 mg·L的DEHP无机盐培养基中,用0.1 mol·LHCl和0.1 mol·LNaOH调节培养基的pH分别为5、6、7、8、9。在接菌量2%(体积比)、温度35℃、转速120 r·min的条件下恒温振荡培养7 d,测定DEHP含量和OD值。每个处理设置3个重复,下同。
1.3.3.2 温度
将菌悬液接种到初始浓度为100 mg·L的DEHP无机盐培养基中,培养温度分别为15、20、25、30、35℃。在接种量2%(体积比)、pH 7.0、转速120 r·min的条件下恒温振荡培养7 d,测定DEHP含量和OD值。
1.3.3.3 接菌量
将菌悬液接种到初始浓度为100 mg·L的DEHP无机盐培养基中,接菌量分别设为1%、2%、3%、4%、5%(体积比)。在pH 7.0、温度30℃、转速120 r·min的条件下恒温振荡培养7 d,测定DEHP含量和OD值。
1.3.3.4 DEHP初始浓度
将菌悬液接种到初始浓度分别为50、100、200、500、1 000、2 000 mg·L的DEHP无机盐培养基中,在pH 7.0、接菌量2%(体积比),温度30℃、转速120 r·min的条件下恒温振荡培养7 d,测定DEHP含量和OD值。
1.3.3.5 最佳条件下菌株对DEHP的降解性能
依据上述实验确定的最佳降解条件,将菌悬液接种到初始浓度为100 mg·L的DEHP无机盐培养基中,振荡培养7 d,分别在第0、2、3、4、5、7 d测定DEHP含量。
1.3.4 样品制备
样品提取参照杨婷和梁浩花等的方法。用移液管移取DEHP无机盐培养基10 mL至100 mL棕色容量瓶,加入1 mL 100 mg·L苯甲酸苄酯(参照HJ 1184—2021,作为替代物),用二次蒸馏水稀释定容并摇匀后转移至磨口带玻璃塞的250 mL锥形瓶中,加入30 mL乙酸乙酯萃取,放入恒温振荡器中振荡30 min,转移至分液漏斗中振摇5 min,静置,待样品出现明显分层后,进行分液,弃下层水相,收集萃取液,再用30 mL乙酸乙酯冲洗3次,将冲洗液全部转移到平底烧瓶中。取出弗罗里硅土净化柱(粒径250μm),先用10 mL乙酸乙酯预洗柱子,淋洗液废弃,将平底烧瓶中收集的液体缓慢滴入净化柱(60滴·min),再用50 mL乙酸乙酯洗脱小柱,收集全部洗脱液至鸡心瓶中,经旋转蒸发浓缩至约5 mL,过有机系0.22μm滤膜,收集过滤液并蒸发浓缩至约0.5 mL,用乙酸乙酯定容至1 mL,待GC-MS测定。
1.3.5 气相色谱-质谱条件
气相色谱条件:进样口温度320℃,脉冲不分流进样;载气为高纯氦气;柱流速1 mL·min(横流模式),进样量为1.0μL;色谱柱为SH-Rxi-5Sil MS(30 m×0.25μm×0.25 mm)。程序升温条件:70℃保持2 min,以20℃·min升到190℃保持1 min,再以8℃·min升到280℃保持3.5 min,以20℃·min升到300℃保持10 min。
质谱条件:电子轰击源(EI);离子源温度300℃;传输线温度300℃;扫描模式为选择离子扫描。内标法定量:萃取浓缩后,与标曲统一加入相等含量的内标溶液上机测试,添加内标使用液[氘代邻苯二甲酸二(2-乙基)己酯,=20.0 mg·L],使其质量浓度均为200μg·L。每批次样品(<20)分析一个样品加标,加标回收率在60%~130%,方法检出限为0.1μg·L。
标准曲线建立:将DEHP、替代物及内标标准溶液分别用乙酸乙酯稀释配制成浓度为5 mg·L的标准使用溶液,于安培瓶中低于-18℃的环境下避光保存。用乙酸乙酯作溶剂,配制成8个不同浓度(10、20、50、100、200、500、1 000、2 000μg·L)的标准系列溶液。测试前各浓度点均加入浓度为5 mg·L的内标使用溶液于标准系列溶液中,混匀,使标准系列溶液中内标浓度均为200μg·L。分别将标准系列溶液按低浓度到高浓度依次置于GC-MS仪器样品托盘内,将GC-MS仪器调至最佳状态,1.0μL进样测定。
以目标化合物浓度和内标化合物浓度比值为横坐标,以目标化合物定量离子响应值和内标化合物定量离子响应值的比值与内标化合物质量浓度的乘积为纵坐标,绘制校准曲线。
定量分析:依托气相色谱质谱联用仪赛默飞世尔TEACE 1300-ISQ LT定量分析软件进行自动定量。替代物回收率为85%~110%。当样品中目标化合物的定量离子有干扰时,允许使用辅助离子定量。样品中目标化合物的浓度按公式(1)计算:

式中:为样品中DEHP的质量浓度,μg·L;为根据内标法校准曲线计算得到的试样中DEHP的浓度,μg·L;为测试样品进样体积,本实验为1 mL;为样品体积,100 mL;为样品稀释倍数,二次蒸馏水稀释10倍。
1.3.6 降解率的计算
DEHP降解率计算公式为:
降解率=(-C)/×100%
式中:为DEHP初始检测平均值浓度,μg·L;C为在第d时DEHP的检测浓度,μg·L。
1.3.7 OD的测定
降解菌扩繁OD的测定:将获得的纯菌落接种至灭菌的LB液体培养基,以不接菌的LB液体培养基为对照,采用UV-5100紫外可见分光光度计,测量培养液在600 nm时的光密度值OD。
降解菌降解能力及验证实验OD的测定参照文献[11]进行。采用UV-5100紫外可见分光光度计,测量培养液在600 nm时的光密度值OD,将菌悬液接入灭菌的MSM液体培养基,并以不接菌(含相同体积的缓冲液)的MSM液体培养基为对照。
1.4 数据分析统计
利用SPSS 25.0对数据进行单因素方差分析(ANOVA)Durcan检验,以确定不同处理组之间的差异,<0.05表示处理间差异显著。利用软件Origin 9.0制图。
2 结果与讨论
2.1 降解菌的分离与筛选
经过富集、驯化、分离和纯培养,获得2株具有较好降解效果的DEHP降解菌,编号分别为C443和B6。菌株C443分离自窑泥沟湿地植物茨菰(L.)的根际土壤,B6分离自路居河湿地植物旱伞草(L.)的根际土壤。通过测定菌株的降解能力,结果显示C443菌株7 d的降解率均值为90.15%,第7 d对菌体进行再次平板涂布时发现菌株未生长;B6可以在7 d降解97%以上的DEHP,并且菌体长势较好。因此,在后续试验中选取B6为研究对象,进行进一步的研究。典型湿地草本植物根际土壤样品分离得到的DEHP降解菌及其降解率详见表2。

表1 标准曲线的配制Table 1 Preparation of standard curve

表2 筛选出的DEHP降解菌的降解率Table 2 Isolation of DEHPdegrading strain and degradation rates
目前,从不同环境介质中分离筛选到PAEs污染物的降解菌的报道较多,如南湖沉积物和水体中分离出假单胞菌strain CCNU-SK1、strain CCNU-SK2和strain CCNU-SK3可降解邻苯二甲酸二乙酯(DEP),活性污泥中分离出的无色杆菌属spRX可降解DEHP,农业土壤中分离出的假节杆菌E5可降解邻苯二甲酸二丁酯(DBP)、DEHP、DEP等PAEs,白酒发酵剂中分离出的枯草芽孢杆菌BJQ0005可降解邻苯二甲酸二异丁酯(DIBP)、DBP、DEHP等,但从湿地草本植物根际土分离PAEs降解菌的研究甚少。从草本植物根际土壤筛选出DEHP的高效降解菌,可为人工湿地植物配置应用于PAEs污染生态修复提供一定的理论依据。同时,环境中经常是多种PAEs污染物共存,因此今后可从草本植物根际土壤筛选更多的PAEs高效降解菌,为人工湿地在净化有机污染物的应用中提供更多科学依据。
2.2 菌株B6的16SrDNA鉴定与形态学特征
将获得的16SrDNA基因片段(序列长度约为1 500 bp)测定结果在GenBank数据库中进行Blast比较,结果表明B6菌株与简单芽孢杆菌有100%的相似性。芽孢杆菌隶属于厚壁菌门(Fircutme)芽孢杆菌纲(Bacilli)芽孢杆菌目(Bacillales),是一类好氧或兼性厌氧的杆状、产芽孢的重要微生物资源,是中国区域的芽孢杆菌优势种。研究已证实,来源于芽孢杆菌的酯酶可降解PAEs类污染物,莫哈韦芽孢杆菌B1811可降解DEHP。因此简单芽孢杆菌具有降解DEHP的潜力,进一步研究其降解性能,可为DEHP污染修复提供一定的理论依据。
菌株B6在平板上的菌落形态(图1)为圆形、白色不透明、菌落光滑平整、边缘整齐中间微微隆起、较湿润。通过涂片、干燥、固定、染色、水洗、干燥,最后将制备好的样片置于显微镜下观察,细菌的形态为长杆状、两端齐平、无鞭毛。生理生化试验显示菌株B6为革兰氏阳性菌(图2)、有芽孢、硝酸盐还原阳性、葡萄糖发酵变黄产酸无气泡产生。
图1 B6菌株平板形态Figure 1 Plate morphology of strain B6

图2 显微镜下B6革兰氏染色和芽孢染色图Figure 2 Gramstaining and spore staining of B6 under microscope
2.3 环境条件对菌株降解DEHP的影响
2.3.1 pH对菌株B6降解DEHP的影响
WU等筛选的sp.JDC-41对DnBP降解的研究表明,pH小于5或高于9时降解率骤降至2%,所以本研究考察了pH值在5~9之间时菌株降解DEHP的情况(图3a)。
pH对DEHP稳定性的影响:在不同初始pH培养基中,未接菌条件下DEHP相对较稳定,所有检测组DEHP降解率不足0.1%。
pH对降解菌生长的影响:图3可看出,在pH为5~9时,菌株B6生长量先随pH值升高而升高,并且在pH为7时达到最大值,随后逐渐降低。说明菌株在中性或弱碱性环境下生长较好,pH过高或过低都不利于菌株的生长。
pH对降解菌降解效能的影响:图3结果还表明,pH在6~8时,DEHP降解率无显著差异,而当pH<6或pH>8时,降解率都显著降低。
降解菌生长与其降解效能的关系:从图3可看出,在pH为7时,菌株B6的生长量和降解率均达到最大值,pH 7~8时,降解率和菌株生长较好,说明中偏碱性环境可以促进菌株B6对DEHP的水解反应,从而使生物量升高,且中性条件利于菌株对DEHP的降解。这与大部分研究报道的PAEs降解菌株的情况一致,如WANG等分离的DEHP降解菌株sp.RX在pH为7、温度为30℃时降解率最高,梁浩花等分离的DEHP降解菌株MB1(sp.)、潘琪等筛选的DEHP降解菌株RXX-2()和RXX-3()均在中性偏碱性条件下对DEHP的降解效果显著。
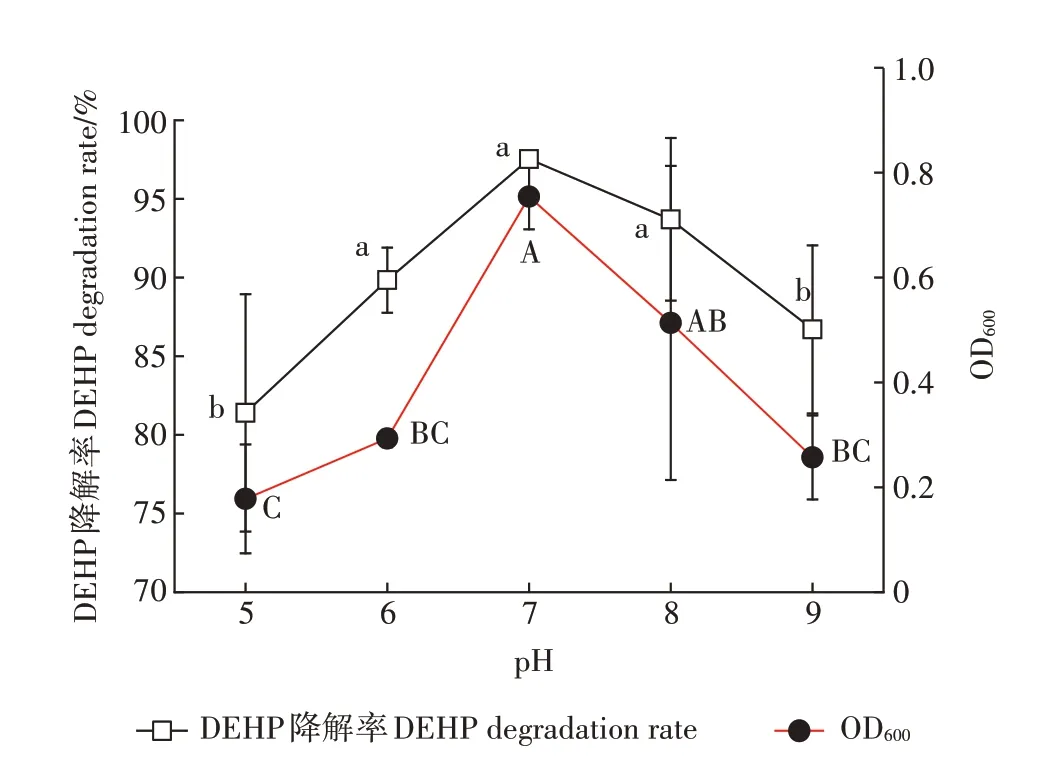
图3 pH对菌株B6降解DEHP的影响Figure 3 Effects of pH on DEHPdegradation by strain B6
2.3.2 温度对菌株B6降解DEHP的影响
温度会影响酶的活性,从而影响菌株的生长和对有机物的降解能力。本实验研究了15~35℃下,菌株对DEHP的降解情况(图4),结果表明随温度的升高,菌株B6的菌体密度和DEHP降解率均呈现先上升后下降的趋势,最适生长温度为30℃,此温度下B6菌株对DEHP的降解率达到最大,之后逐渐下降。该趋势与其他学者的研究结论一致。
温度对DEHP稳定性的影响:所有实验对照组在15~35℃温度范围内,DEHP起始浓度和终浓度无明显变化,较稳定,降解率均小于0.5%。
温度对降解菌生长的影响:由图4可看出,在温度为15~35℃时,菌株B6的菌体密度呈先上升后下降的趋势,最适生长温度为30℃。
温度对降解菌降解效能的影响:由图4可知,菌株B6对DEHP的降解率先随温度的升高而上升,且在30℃时达到最大值97.34%,随后逐渐降低。
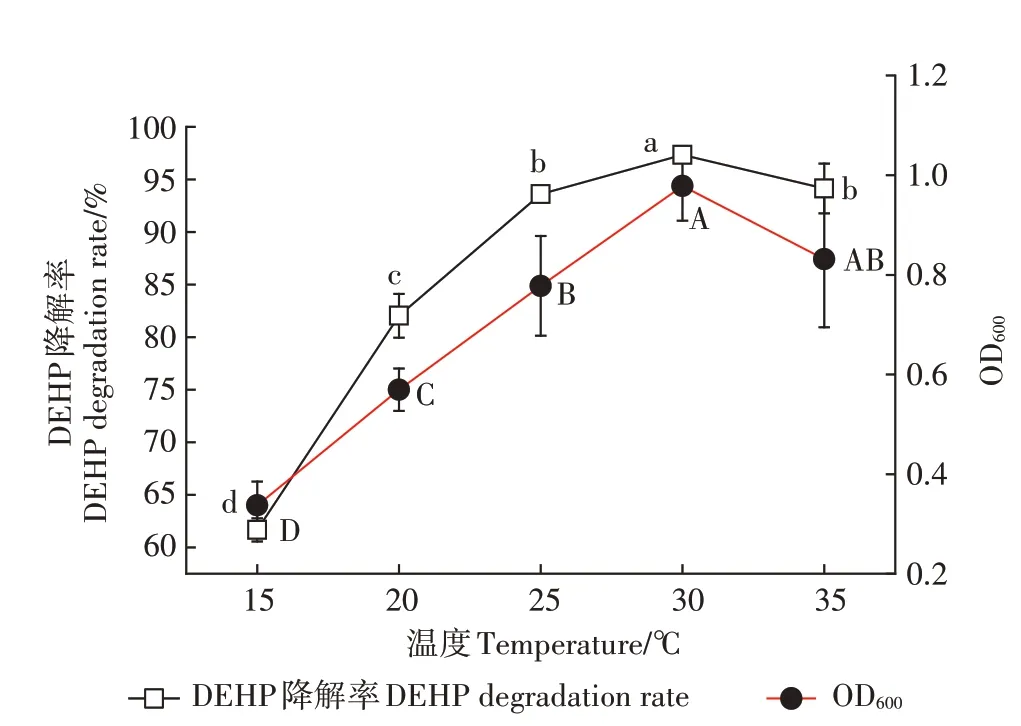
图4 温度对菌株B6降解DEHP的影响Figure 4 Effects of temperature on DEHPdegradation by strain B6
降解菌生长与其降解效能的关系:在15~35℃下,菌株的菌体密度与降解效能呈现出一定的正相关性,且在30℃时B6菌株的生长量和对DEHP的降解率均达到最大值。
2.3.3 DEHP初始浓度对菌株B6降解DEHP的影响
DEHP初始浓度对B6降解DEHP的影响:实验结果显示(图5),DEHP初始浓度为50~2 000 mg·L时,随初始浓度增大,菌株B6对DEHP的降解率呈逐渐下降趋势,DEHP初始浓度<500 mg·L时,降解率>68%,DEHP初始浓度为1 000 mg·L时,降解率降至58.10%,随后趋于平稳。

图5 初始浓度对菌株B6降解DEHP的影响Figure 5 Effects of initial concentration on DEHPdegradation by strain B6
DEHP初始浓度对B6生长的影响:图5结果还表明,DEHP初始浓度为50~2 000 mg·L时,菌株B6生长量先随DEHP初始浓度升高而升高,并且在DEHP初始浓度为1 000 mg·L时达到最大值,之后逐渐降低。说明DEHP初始浓度为低浓度时可以促进菌株生长,而较高浓度则对菌株生长有抑制作用。
降解菌生长与其降解效能的关系:图5结果表明,低浓度DEHP促进B6生长,对DEHP的降解率高;高浓度DEHP可能抑制B6的生长,降解率也相对较低。B6对高浓度DEHP降解率低,这可能是因为在较高浓度DEHP下,底物过剩,菌株B6难以在短期内大量降解DEHP。许多学者也研究了降解菌在不同DEHP初始浓度下的降解效能:WANG等研究了100~2 000 mg·LDEHP对sp.Lff降解效能的影响,杨婧等研究了300~1000 mg·LDEHP对分枝杆菌sp.ASW6D降解效能的影响。本实验B6菌株降解DEHP的浓度范围较前人的更宽,且效率更高。
2.3.4 接菌量对菌株B6降解DEHP的影响
从图6可看出,接菌量对菌株B6降解DEHP的影响呈先上升后下降的趋势,在接菌量为4%时,DEHP的降解率达到最大,之后下降,但差异不显著。
接菌量对B6降解DEHP的影响:图6显示,在接菌量为1%~5%时,DEHP的降解率随接菌量的增加显著提高,在接菌量为4%时,降解率达到最大值97.91%,随后逐渐降低。

图6 接菌量对菌株B6降解DEHP的影响Figure 6 Effects of inoculation amount on DEHPdegradation by strain B6
接菌量对降解菌生长的影响:由图6可看出,在接菌量为1%~5%时,随着接菌量的增加,菌株B6的生物量也在增加,当接菌量为4%时,菌体密度OD达到最大值,而接菌量为5%时,OD无显著变化。
降解菌生长与其降解效能的关系:当接菌量在1%~4%范围内,菌株密度与污染物降解呈一定正相关关系。随着接菌量的不断提高,当接菌量超过4%后,接种量对B6生物量无显著影响,但高浓度菌液使菌体间相互竞争空间和碳源能源,导致菌株降解活性降低,DEHP的降解率也随着降低。
2.3.5 最适环境条件下菌株B6对DEHP的降解
对单因素实验得到的最适环境条件(pH 7.0、温度30℃、接菌量4%、DEHP初始浓度100 mg·L)进行试验研究,结果详见图7。降解空白对照实验表明,当培养液中不添加降解菌时DEHP在自然状态下几乎不被降解,而培养液中添加降解菌时,菌株B6在生长过程中没有明显的停滞期:1~4 d为对数生长期,OD值快速上升到最大值;4~7 d时菌株处于稳定期,OD值缓慢下降但差异不显著。菌株B6对DEHP的降解随时间推移呈逐渐上升趋势,第7 d时无机盐培养液中DEHP的残留浓度为2.09 mg·L,降解率达到97.91%,相比同类研究该菌具有较强的DEHP降解力。CHEN等从农田土壤分离的DEHP降解菌E5的降解率为65.3%,WANG等从活性污泥中分离的DEHP降解菌RX的降解率为93.1%,FENG等从污染水体中分离的DEHP(初始浓度500 mg·L)降解菌spstrain DNB-S3的降解率为59.2%,ZHANG等从红土中分离的DEHP降解菌RL-JC02的降解率为91.8%。近年来分离的DEHP降解菌相关信息详见表3。
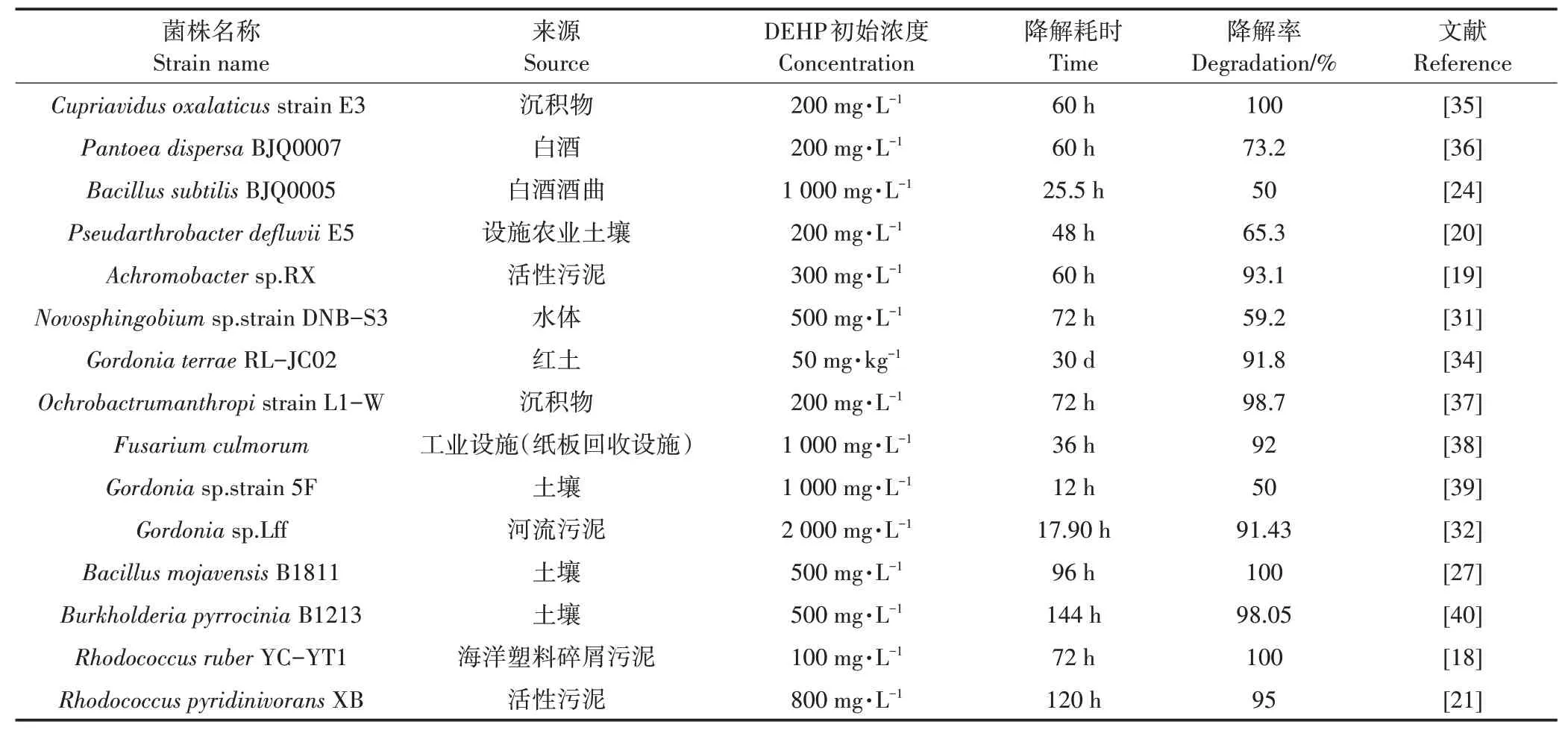
表3 近年来分离的典型DEHP降解菌及其相关信息Table 3 Overview of typical DEHPdegradation strains isolates in recent years
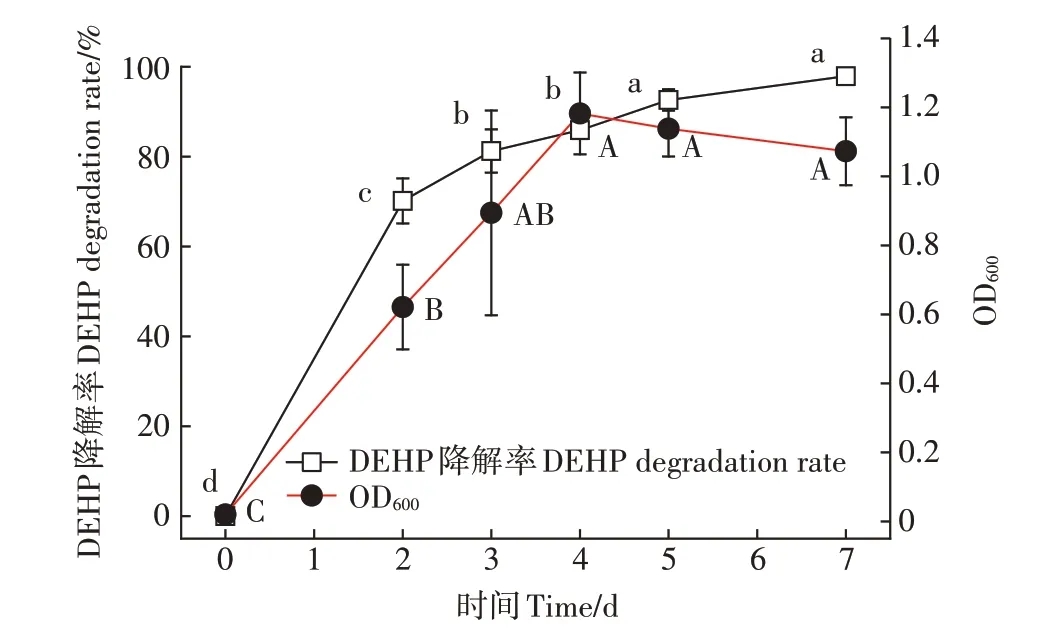
图7 最佳条件下菌株B6对DEHP的降解Figure 7 DEHPdegradation rates of strain B6 under the optimal conditions
3 结论
(1)从湿地典型草本植物根际土壤中筛选得到一株DEHP降解菌B6,菌株B6分离于路居河湿地旱伞草(L.)的根际土壤,经过生理生化特征分析、形态学鉴定和16SrDNA序列鉴定,该菌株与简单芽孢杆菌有100%的相似性。
(2)菌株B6最适降解条件:pH 7.0、温度30℃、接菌量4%、DEHP初始浓度100 mg·L。在最适条件下,菌株B6的生长曲线随时间变化呈先上升后下降的趋势,对DEHP的降解随时间推移呈逐渐上升趋势,第7 d时无机盐培养液中DEHP的残留浓度为2.09 mg·L,降解率为97.91%,该菌株对DEHP污染修复效果显著,在DEHP污染修复中具有一定的应用前景。

