内镜下全层切除术治疗直肠神经内分泌肿瘤的临床疗效
乔晓,吴翔宇,叶彬,朱伦,宗君,徐冬艳,刘树青
[徐州医科大学附属淮安医院1.消化内科(江苏省神经内分泌肿瘤诊治中心苏北分中心);2.病理科,江苏淮安 221002]
随着人们对肿瘤预防意识的提高及结肠镜检查的普及,越来越多的神经内分泌肿瘤(neuroendocrine tumor,NET)被发现。1.0 cm以上的直肠NET,盆腔CT 和直肠MRI 检查多有阳性表现,但较小的病灶需结肠镜检查结合病理活检才能明确[1]。直径大于2 cm的NET,肿瘤的增殖活性和转移风险约为60%~80%,需行Mason 术(经腹骶直肠切除术)或腹会阴联合直肠癌根治术[2]。分化较好的小于2.0 cm 直肠NET,既往大多采用经肛、经腹局部切除术[3],但对于肛周病变,外科手术常因不能保肛导致患者生活不便。近年来,内镜下黏膜切除术(endoscopic mucosal resection,EMR)在黏膜肿瘤的微创治疗中广泛应用,但NET 并非局限于黏膜下层,可累及肌层,甚至浆膜层。尽管超声内镜可判断肿瘤深度,但仍有误差[3-4]。内镜下全层切除术(endoscopic full-thickness resection,EFR)不受病灶层次及浸润深度的影响,可主动切开浆膜层进行全层切除,是一种能完整切除病灶的内镜手术方式。目前,对于胃内累及层次深于固有肌层的病变,可用EFR 治疗,应用EFR 治疗直肠NET却鲜有报道。本研究分析了本院40 例直肠NET 患者的临床资料,评估EFR 在直肠NET 内镜切除中的安全性和有效性,以期为临床推广提供参考依据。
1 资料与方法
1.1 一般资料
选取2016年4月-2018年4月行内镜下切除的直肠NET 患者40 例,根据手术方法不同,将患者分为观察组(EFR组,n=22)和对照组[内镜黏膜下剥离术(endoscopic submucosal dissection, ESD) 组,n=18]。EFR 组接受EFR 治疗,对照组接受ESD 治疗。EFR 组中,男12 例,女10 例,年龄24~69 岁,平均(50.3±14.6)岁;ESD组中,男8例,女10例,年龄29~71岁,平均(52.4±12.5)岁。两组患者性别、年龄、肿瘤位置和超声层次等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。所有患者均签署知情同意书,本研究经医院伦理委员会审核批准。
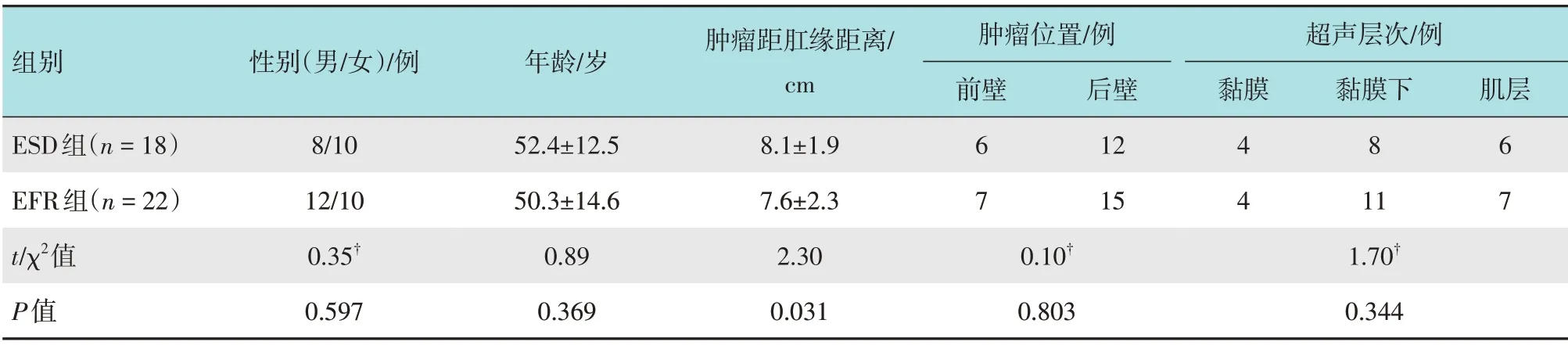
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.2 主要器械
高频电刀装置(ERBE VIO 300D),GIF-Q260 胃镜(Olympus 公司),EU-M2000 超声胃镜(Olympus公司),HX-600-135钛夹、CO2气泵、一次性喷洒注射针(杭州安杰思医学科技股份有限公司),改良圈套器(杭州安杰思医学科技股份有限公司定制)(图1),热凝钳(Olympus FD-410),IT 刀(Olympus KD-612L)。
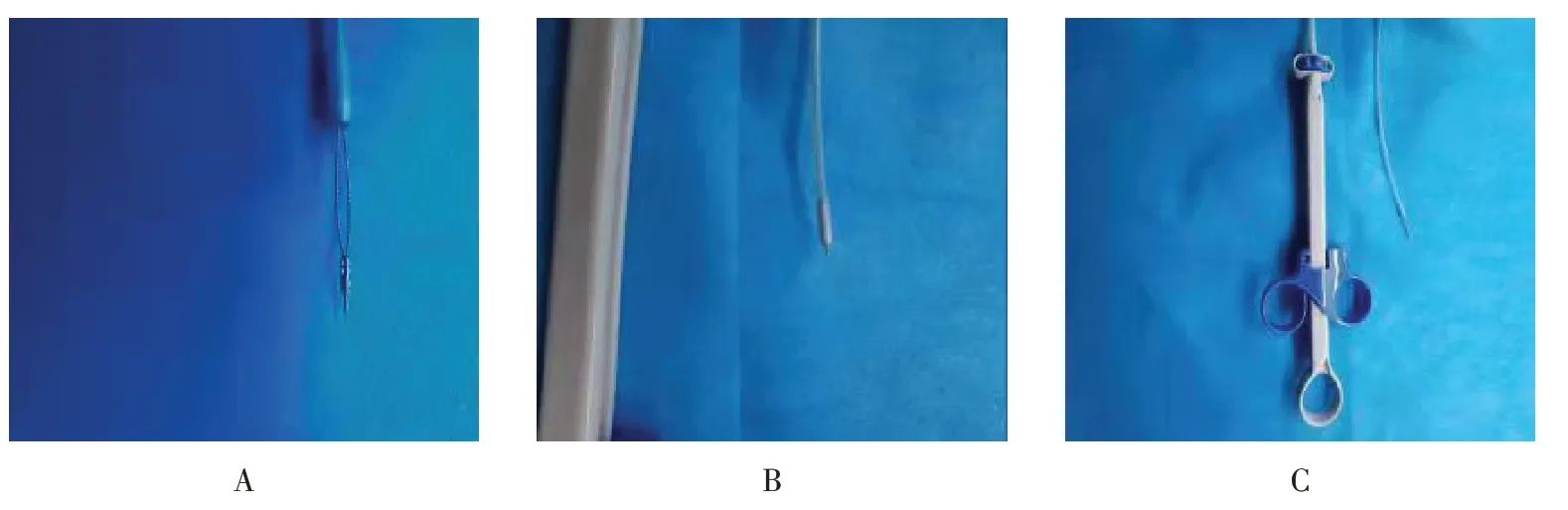
图1 改良圈套器Fig.1 Improved snare
1.3 术前准备
所有患者术前均进行全面评估,除肿瘤血行转移和淋巴结转移外,术前均经电子结肠镜评估肿瘤的部位及相对于肛缘的距离,并用超声胃镜评估病变的大小、起源层次、病变边界和内部回声。所有患者术前预防性使用抗生素治疗。
1.4 操作步骤
1.4.1 EFR全身静脉麻醉,术中持续监测生命体征。①治疗胃镜透明帽辅助下确定病灶,改良的圈套器在病灶外0.5 cm 处标记;②在病灶周边拟切开处黏膜下注射;③改良的圈套器设置2 挡,沿病灶周边C 型预切开;④切开同时再次判断病灶深度,若与固有肌层关系密切时,应用改良圈套器或IT 刀(IT 刀前端缘绝缘,不易损伤肠腔外脏器)沿病灶周围主动人工穿孔,全层完整切除病灶;⑤处理黏膜面及浆膜面出血点和可见的血管;⑥应用钛夹沿创面两侧向中央封闭创面,或者采用尼龙圈荷包缝合技术完整封闭创面;⑦固定病理标本并送检。见图2。
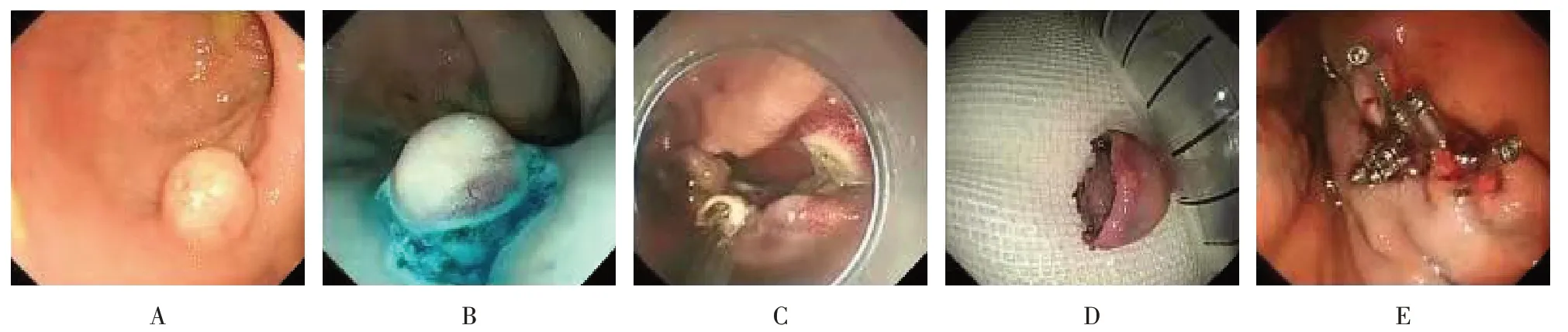
图2 EFR切除过程Fig.2 EFR resection process
1.4.2 ESD全身静脉麻醉并监测生命体征。①透明帽辅助下确定病灶,改良的圈套器在病灶外0.5 cm 处标记;②病灶外围黏膜下注射,改良的圈套器在标记点外0.5 cm 环周预切开病灶边缘;③病灶黏膜下间断注射,逐层分离并切除病灶;④处理创面,预防出血;⑤应用钛夹完整封闭创面;⑥固定病理标本并送检。见图3。
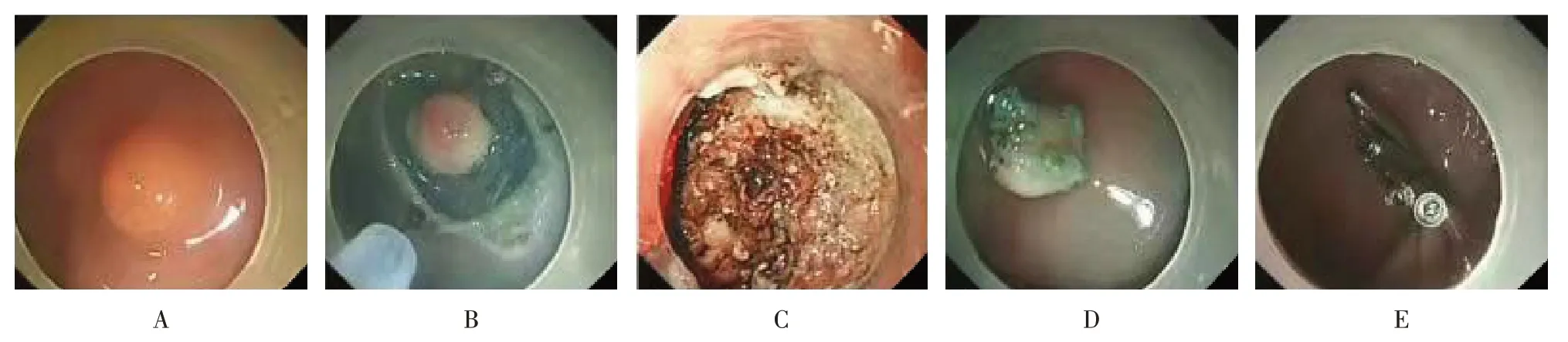
图3 ESD切除过程Fig.3 ESD resection process
1.5 术后处理
所有病例术后预防性使用抗生素治疗,术后24 h内行盆腔CT 观察创口周围情况;术后禁食72 h,并观察出血、发热和腹痛等症状。术后30 d和半年复查肠镜,以后每年复查1 次电子结肠镜及胸腹部增强CT。
1.6 统计学方法
选用SPSS 20.0 软件分析数据。计量资料以均数±标准差(±s)表示,组间比较行t检验,计数资料以例或百分率(%)表示,行χ2检验或Fisher 确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较
EFR 组均一次性行完整切除,手术时间22~45 min,平均为(32.8±12.4)min,短于ESD 组的(54.3±13.5) min,差异有统计学意义(t=0.92,P=0.021)。ESD 组术后住院时间为(5.4±2.8)d,EFR组为(6.1±1.7)d,两组比较,差异无统计学意义(P>0.05)。EFR 组术后标本大小为1.8~3.2 cm,平均(2.4±0.7)cm,ESD 组术后标本大小为2.1~3.4 cm,平均(2.8±0.5)cm,两组比较,差异无统计学意义(P>0.05)。见表2。
表2 两组患者手术相关指标比较 (±s)Table 2 Comparison of operation related indexes between the two groups (±s)
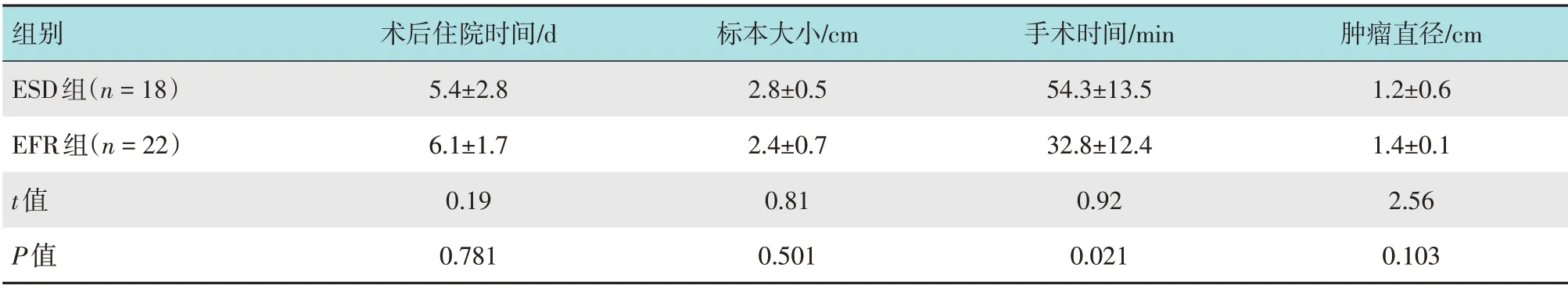
表2 两组患者手术相关指标比较 (±s)Table 2 Comparison of operation related indexes between the two groups (±s)
组别ESD组(n=18)EFR组(n=22)t值P值术后住院时间/d 5.4±2.8 6.1±1.7 0.19 0.781标本大小/cm 2.8±0.5 2.4±0.7 0.81 0.501手术时间/min 54.3±13.5 32.8±12.4 0.92 0.021肿瘤直径/cm 1.2±0.6 1.4±0.1 2.56 0.103
2.2 两组患者术后病理比较
EFR组局限在黏膜层6例(27.3%),侵犯黏膜下10例(45.4%),累及肌层6例(27.3%),与ESD组比较,差异无统计学意义(P>0.05)。病理分级显示:EFR组中G1级20例(90.9%),G2级2例(9.1%),与ESD组比较,差异无统计学意义(P>0.05)。两组术后病理判定水平切缘均阴性。EFR组中基底切缘均为阴性,ESD 组2 例基底切缘阳性,还有2 例因手术时灼伤,基底切缘难以判定,两组基底切缘阳性比较,差异有统计学意义(P<0.05)。1 例基底切缘阳性的G2级患者经沟通后,自行选择外科手术扩大切除,2例基底切缘难以判定及另1例基底切缘阳性患者均为G1级,患者知晓病情后选择随访观察。EFR组术后病理显示手术切缘阴性。ESD 组中2 例病灶累及肌层,术后病理提示基底切缘为阳性,另2例因术中血管丰富反复电凝烧灼止血,导致病灶基底切缘无法评估。见表3和图4。
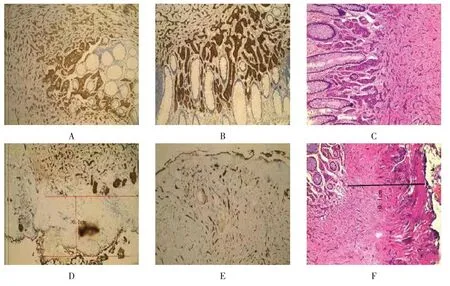
图4 术后病理Fig.4 Postoperative pathology
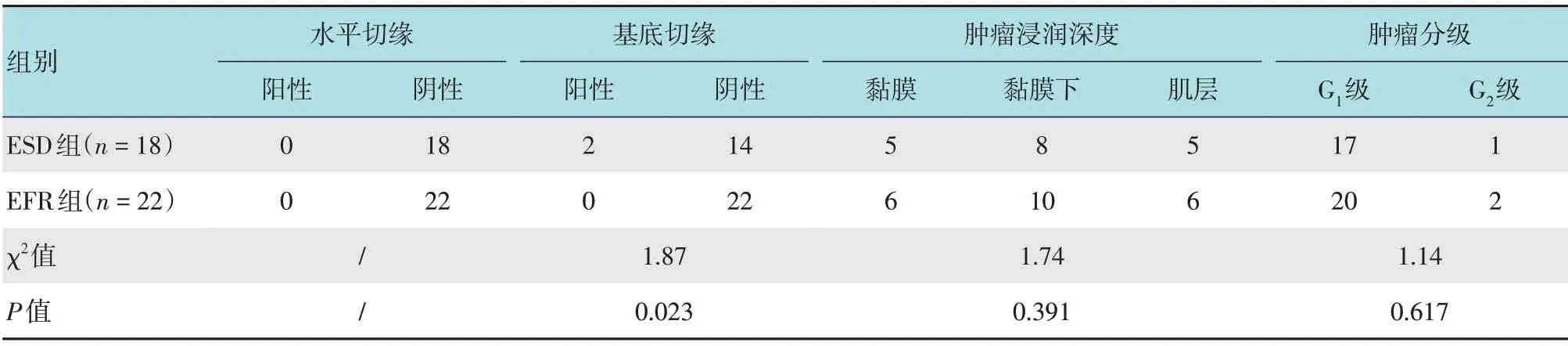
表3 两组患者术后病理比较 例Table 3 Comparison of postoperative pathology between the two groups n
2.3 两组患者并发症处理及术后随访情况
ESD 组中,2 例患者术后第2 天出现中下腹部持续性隐痛,伴发热,最高达38.7 ℃,腹部CT 检查提示:手术区域周围有少量渗液,考虑有迟发性小穿孔可能,不排除为术中深挖病灶及电凝后迟发性透壁损伤导致,均通过内镜下创面补充封闭处理,并禁食、消炎,3 d 内改善;ESD 组有1 例术后第2 天见<20 mL 的暗红色黏液血便,可能与术后创面水肿少量渗血有关,加用止血治疗后2 d 内好转。EFR组2例术后3 d内出现黏液血便,每天30 mL,对症治疗后明显好转。两组患者并发症比较,差异无统计学意义(χ2=4.52,P=0.291)。见表4。ESD 组中,切除NET 病灶18 处,2 处基底切缘阳性,完整切除率88.9%;EFR 组中,切除NET 病灶23 处(其中1 例有两处病灶),切除后病变完整,完整切除率为100.0%,术中均通过钛夹及荷包完整缝合,缝合成功率为100.0%。两组患者均未发生严重并发症。术后1个月随访时,内镜检查创面均愈合良好。术后24个月随访时,EFR组患者未出现排便不适、肠道狭窄和复发。
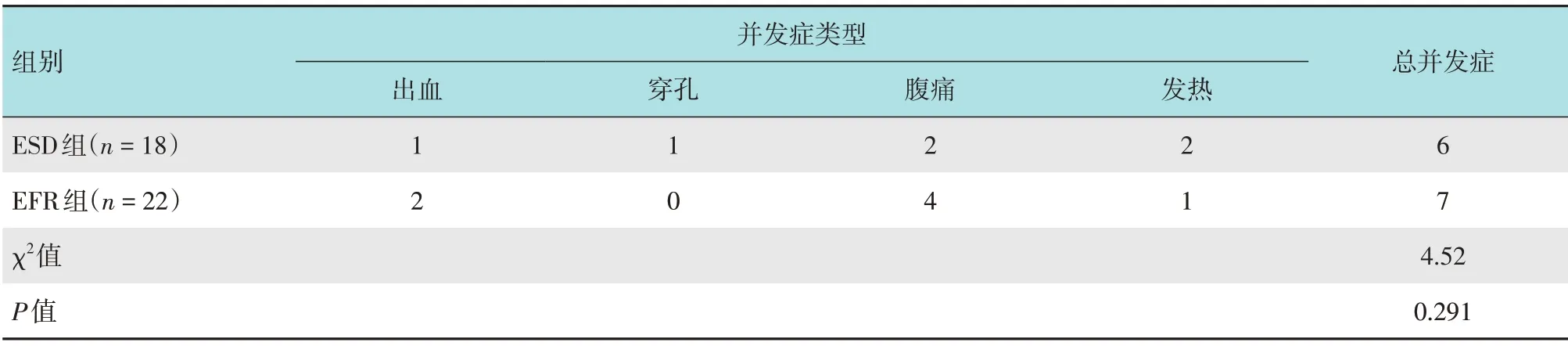
表4 两组患者并发症比较 例Table 4 Comparison of complications between the two groups n
3 讨论
NET是一种分化良好的上皮性肿瘤,患者常以腹痛、潮热和腹泻等不典型症状就诊,以胃肠道特别是直肠多发[5]。现有的治疗方法包括:外科根治性手术、内镜下切除、免疫及靶向治疗等。有文献[6]报道,2.0 cm以下的直肠NET转移风险低于15%。直肠NET细胞异型性和增殖活性低,病变多局限,5年总生存率较高[7]。因此,肿瘤完整切除非常必要。有文献[8]报道,76%的直径小于2.0 cm 的直肠NET 可侵犯黏膜层及更深层,常规ESD 切除累及较深层的病变时,常因害怕穿孔导致切除不全或肿瘤残留。本研究中,29例(72.5%)病变累及黏膜下层及肌层,这支持了直肠NET较多累及黏膜下层及更深层次的结论。常规ESD 因为切除层次的局限,不能保证完整切除,有可能遗留病灶导致复发。
本研究尝试性将EFR技术应用于直肠NET,观察了包括病变起源于固有肌层的22 例患者,所有标本手术切缘为阴性,未发现严重并发症或复发,治愈率达100.0%,说明EFR技术有效率高。ESD组中2例病灶累及肌层,术后标本基底切缘为阳性,另2例因术中血管丰富反复电烧灼止血导致病灶基底切缘无法评估。这4例患者中,除1例术后病理提示为G2级的患者选择行外科手术外,其余3例G1级患者均选择随诊观察,未行补救性EFR。排除远处转移的情况下,直肠NET 行EFR 较传统外科根治术创伤小,与传统的内镜手术切除方式(EMR 和ESD)相比,手术风险及花费相当,EFR既保证了完全切除,又提高了术后病理切缘的可评估性。
本科2016年4月-2018年4月完成内镜下切除直肠NET 40例,其中EFR术22例。术前充分与患者沟通,提供备选及补救方案,对部分病例使用了改良圈套器(杭州安杰思医学科技股份有限公司定制),将原单股圈套器头端的仿Dual 刀适当延长,手柄加多种卡位方便固定,可精确保证1挡刀长0.5 mm,用于黏膜标记,2 挡刀长1.5 mm,用于切除病变,3 挡刀全推出用于圈套;刀头为钨钢材质,导热好,止血迅速,切割效率高。术中为避免切除的病灶掉入盆腔,笔者还采用了钛夹辅助的棉绳牵引技术,完整切除病灶后直接牵引取出,并用金属钛夹直接或联合尼龙绳行荷包缝合全层切开创面。EFR 组均顺利完整切除病灶,较ESD 组手术耗时短。EFR 组中,2例术中遇到血管,出血量大,予以冲洗找到出血部位后,用热活检钳轻柔电凝,固化血管止血。EFR中需重视浆膜面的血管,必要时需进入肠外盆腔内倒镜进行止血。
在治疗直肠NET 方面,EFR 有较大优势:①微创:与传统的经腹骶直肠切除术(Mason术)及根治性手术相比,EFR恢复快,无手术切口,不影响术后直肠功能;②手术时间短:EFR术中不用精细分离管壁层次,手术时间明显短于传统ESD 组;③安全精准:全层切除有利于完整切除肿瘤,确保了切缘的阴性率,较外科手术定位更加精准,减少创伤;④经济高效:改良的圈套器价格只有常规Dual 刀的1/4,利于医保控费;无需重购设备,熟练掌握ESD的医生均可开展,于外院切缘阳性的手术失败者,同样可再用EFR术进行扩大全层切除来补救,避免了患者再次经腹大手术;⑤不受肿瘤部位的限制:对于直肠肿瘤的外科处理,需要综合分析直肠、骨盆条件及肛门功能等,EFR术在直肠内直接切除,可操作空间大,且不受肿瘤部位的限制,适应证广。
当直肠NET 累及黏膜下层或更深层次时,常规ESD 不能完整切除病灶[9-10]。虽然有医院尝试肿瘤挖除术,但因病灶相对较小,深挖处病灶局部碳化,严重影响术后病理评估[11-12],一旦不能完整切除,患者追加手术的风险大。2016年至今,本中心共通过EFR 术切除累及黏膜下层及固有肌层的直肠NET 68例,均取得了良好效果。遇到可疑的直肠NET,对尚无活检病理或不具备超声等检查设备的医院,推荐EFR术,可在完整切除病变的同时明确诊断。
综上所述,EFR 可完整切除NET 病灶,安全高效。对于最大径小于2.0 cm、与固有肌层关系紧密、病理分级为G1级和G2级的直肠NET,EFR 术是首选的治疗手段。

