芪参益气滴丸含药血清对缺氧/复氧H9C2 心肌细胞KATP 通道开放及PI3K/AKT 信号通路影响的效应研究
何贵新,冯雨菲,秦伟彬,林 琳,胡梦弦,郑国坤,玉黎燕,甲子永,韦 娟,文 琦
(1.广西中医药大学第一附属医院,广西 南宁 530022;2.广西中医药大学,广西 南宁 530299)
急性心肌梗死(acute myocardial infarction,AMI)是全球范围内发病、住院和死亡的最常见原因之一。目前,冠状动脉重建术如经皮冠状动脉介入、冠状动脉旁路手术、经皮穿刺部位的选择和辅助抗栓治疗是提高AMI 临床生存率最有效的策略。然而,再灌注治疗是一把双刃剑,恢复缺血心肌血流的过程可能导致心肌再灌注损伤(myocardial ischemia-reperfusion injury,MIRI),随着氧化应激、心肌细胞凋亡、自噬和炎性细胞因子的释放等多种病理过程相互影响,可进一步加重心肌损害。相关动物模型研究表明,AMI 后的心肌损伤是缺血和再灌注损伤共同引发的,其中再灌注损伤引发的梗死面积占心肌梗死最终大小的50%[1]。故探究心肌缺血再灌注损伤的潜在分子机制,寻找减少最终梗死面积的治疗策略是心血管领域急需解决的问题。近年来,多项研究证实线粒体ATP 敏感性钾通道(mitochondrial ATP-sensitive potassium channel,mitoKATP)的激活在心肌保护中发挥作用,一方面,该通道本身可防止减少钙摄取的驱动力,防止线粒体过渡膜孔(mitochondrial permeability transition pore,MPTP)的形成和活性氧(reactive oxygen species,ROS)的产生以抵抗心肌缺血[2],另一方面,可影响内源性活性物质及下游信号通路以发挥保护作用[3]。因此,激活mitoKATP 通道是药物改善心肌损伤保护心肌细胞的重要途径。有研究表明,复方制剂芪参益气滴丸具有抗血小板聚集、促进血管新生、抑制炎症反应、稳定斑块和抑制氧化应激等作用,从而发挥其活血化瘀通络的功能,缓解MIRI 后的心肌损伤。笔者团队前期通过动物实验证实参益气滴丸可以激活PI3K/AKT 信号,调控p-AKT 蛋白的表达,对MIRI 的具有改善心脏功能,保护心肌细胞的作用[4,5]。本实验在前期研究的基础上,采用血清药理学方法制备芪参益气滴丸含药血清,体外检测芪参益气滴丸含药血清的心肌细胞的保护作用及可能机制。
1 材料与方法
1.1 细胞株
大鼠H9C2 心肌细胞系购买于浙江美森细胞科技有限公司。
1.2 实验动物
SPF 级雄性SD 大鼠20 只,8~10 周龄,体重220~250 g,实验动物均购自广西中医药大学动物实验中心,动物许可证号:SCXK(湘)2019-0014。饲养条件:温度:(22±2)℃;湿度:40%~60%;光照周期:12 /12 h,普通饲料喂养,自由进食进水;实验流程严格遵循美国卫生机构发布的《实验动物保护和应用指南》,实验操作严格遵守广西中医药大学动物实验管理委员会的相关规定。
1.3 实验药物
芪参益气滴丸(丹参、三七、降香、黄芪,0.5 g/袋;天力士医药公司,国药准字:Z20030319,批号,180615)。
1.4 主要试剂
DMEM 基础培养基、10%胎牛血清(Hyclone),青链双抗(上海生工),H2O2(分析纯,天津市江天化学试剂厂),PI3K/AKT 信号通路阻断剂wort(MCE,HY-10197),mitoKATP 特异性阻断剂5-HD(abcam,ab141672),BCA 蛋白定量试剂盒(Biosharp,BL521A),抗AKT 抗体、抗p-AKT 抗体(美国cell signaling technology 公司),兔抗GAPDH、山羊兔二抗IgG(美国Proteintech 公司),蛋白预染Marker(美国Thermo Scientific 公司),30%丙烯酰胺(29∶1)(Amresco)1.5 mol/L Tris-HCl,pH=8.8 电泳缓冲液、1.0 mol/L Tris-HCl,pH=6.8 电泳缓冲液(无锡菩禾),10% SDS、10%过硫酸铵、丽春红S(国药),TEMED(Sigma),4×蛋白上样缓冲液(无锡菩禾)蛋白预染Marker(Thermo),PVDF 膜(Millipore),5%的BSA(Amresco),PBS 磷酸盐缓冲液(无锡菩禾),Tween-20(Amresco),ECL 发光液(七海生物),HRP 标记二抗(中杉金桥)。
1.5 主要仪器
细胞培养箱(Thermo Scientific 8000),光学显微镜(XDS-1A),倒置拍照显微镜(OLYMPUS,IX71),离心机(德国Eppendorf 公司),酶标仪(Thermo,MK3),冷冻离心机(Effendorf),电泳仪(BIORAD,mini protean 3 cell),电转仪(PS-9,大连竞迈科技有限公司),移液器(Thermo),水浴锅(Leica,HI1210),一体式化学发光成像仪(ChemiScope 5300 Pro),膜片钳放大器AXON200B、Pclam6.0 数据采集软件(AXON 公司)。
1.6 方法
1.6.1 含药血清制备 20 只SPF 级雄性SD 大鼠,正常喂养3 d 后按随机数表法分为2 组,即空白血清组及含药血清组。芪参益气滴丸给药剂量参照《中药药理研究方法学》体表面积折算[6],大鼠和人(人体质量按照70 kg 计算)的等效剂量比值为6.3,成人芪参益气滴丸用法是1 g,tid,根据公式计算出其每日的芪参益气滴丸用量为27 mg/(100 g·d)。按照体重,含药血清组予27 mg/100 g 芪参益气滴丸溶于2 mL/100 g 生理盐水,空白血清组予2 mL/100 g生理盐水,每日早晚各灌胃1 次,连续7 d。末次给药2 h 后,采用腹腔注射麻醉,腹主动脉采血,室温静置30 min,予3 000 r/min,离心15 min 后取上清液。56 ℃、30 min 水浴灭活,0.22 μm 微孔滤膜滤过除菌,分装,-20 ℃保存备用。
1.6.2 细胞的培养和处理 取出液氮罐中冻存的H9C2 的心肌细胞,置入37 ℃水浴箱迅速摇晃使其溶解,将溶解冻存液中的细胞悬液吸至离心管中,1 200 r/min 离心5 min,弃上清液,用DMEM 培养基清洗1~2 次。将心肌细胞加入完全培养基,置于37 ℃、5% CO2培养箱内培养,1~2 d 换1 次培养基。取对数生长期用于后续实验。
1.6.3 含药血清浓度的确定 待细胞长满后调整细胞浓度为1×105cells/mL,接种于96 孔板,每孔100 μL,培养24 h;将H9C2 心肌细胞随机分为空白血清组、2.5% 含药血清组、5.0% 含药血清组、10.0%含药血清组及15.0%含药血清组,制备的含药血清分别按2.5%、5.0%、10.0%、15.0%的比例与DMEM 高糖培养基混合,分组处理H9C2 细胞,显微镜观察细胞形态变化,确认最佳含药血清浓度。
1.6.4 心肌细胞缺氧/复氧模型制备及分组给药 按参考文献[7]模型制备方法,待细胞长满后调整细胞浓度为1×105cells/mL,接种于96 孔培养板,每孔100 μ L,37 ℃、5% CO2培养箱内培养24 h;将H2O2加入DMEM 高塘培养基中,使其终浓度分别为62.5、125.0、250.0、500.0、1 000.0 μ mol/L,分组处理H9C2 细胞,3、8、16 h 后显微镜观察细胞形态变化,确定H2O2最佳作用浓度和作用时间。
将H9C2 心肌细胞按随机数字表法分为5 组,A:H9C2 细胞组,B:H9C2 细胞+H2O2模型组,C:H9C2 细胞+H2O2模型+芪参益气组,D:H9C2细胞+H2O2模型+芪参益气+PI3K/AKT 信号通路阻断剂(wort)组,E:H9C2 细胞+H2O2模型+芪参益气+mitoKATP 特异性阻断剂(5-HD)组。按照上述分组处理细胞,A 组在空白血清培养液中常规培养32 h,B 组在空白血清培养液中培养24 h 后,在培养液中加入H2O2(250 μmol/L)8 h 后收样进行后续实验;C 组予含药血清处理24 h 后,进行H2O2(250 μmol/L)模型处理,8 h 后收样进行后续实验。其中D 组、E 组在含药血清处理23 h 后,分别向培养基中加入wort、5-HD 使其终浓度为100 nmol/L、100 μmol/L,1 h 后再进行H2O2处理,方法同B 组。
1.7 指标检测
1.7.1 CCK-8 法检测各组细胞活性 将浓度为1×105cells/mL 的心肌细胞接种于96 孔培养板,每孔100 μL,使每孔细胞数目为1×104个,然后将96 孔板放在37 ℃、5% CO2培养箱内培养24 h;将处理后的心肌细胞按照CCK-8 试剂盒的操作说明,斜贴孔壁向孔中加10 μL 的CCK-8 溶液,注意避免产生气泡,将孔板在培养箱内孵育2 h,用酶标仪检测每个孔在450 nm 波长处的OD 值,计算各组的H9C2 细胞存活率。每组设置6 个复孔进行实验。
1.7.2 Western blot 法检测各组H9C2 心肌细胞p-AKT、AKT 的表达水平 收集需要抽提蛋白的细胞用适量预冷的已加PMSF的RIPA裂解液混匀,充分裂解后12 000 r/min离心10 min,收集上清。BCA蛋白定量试剂盒确定蛋白浓度,根据样品浓度确定上样量。制备蛋白样品及聚丙烯酰胺凝胶,装好电泳装置,倒入电泳缓冲液,分别注入蛋白样品和maker,进行SDS-PAGE 电泳。待蛋白分离后,将胶小心的移入转膜缓冲液中,在转膜装置上进行转膜。丽春红染色检测转膜是否成功,将膜用TBST 漂洗3 次,每次5 min,然后用5%的脱脂奶粉37 ℃缓慢震荡2 h。根据说明书,用封闭液稀释AKT,p-AKT 抗体至合适浓度,4 ℃过夜孵育。用TBST 洗涤孵育一抗的膜,3 次,每次5 min。随后根据用量,按照说明书稀释HRP 标记的兔二抗/小鼠二抗,与膜37 ℃孵育1 h。用TBST 洗涤后,一体式化学发光仪检测。
1.7.3 全细胞膜片钳技术测KATP 通道电流
1.7.3.1 溶液配制 记录KATP 通道电流的细胞外液配制(mmol/L):NaCl 137 g、CaCl 1.2 g、KCl 5.0 g、MgSO41.2 g、NaH2PO40.5 g、葡萄糖 10 g、HEPES 10 g(用NaOH 调节pH 至7.35~7.40);记录KATP 通道电流的细胞内液配制(mmol/L):NaCl 10 g、CaCl 1 g、KCl 125 g、MgATP 1 g、HEPES 10 g、EGTA 14 g(用KOH 调节pH 至7.1)。
1.7.3.2 膜片钳全细胞记录 将复钙后的H9C2 心肌细胞悬液滴入灌流槽中,置于倒置显微镜工作台上,待细胞贴壁后使用细胞外液灌流冲洗,在显微镜下选取贴壁牢固,边缘整齐,形态规整、横纹清晰,无自主收缩的细胞进行膜片钳实验;通过注射器给玻璃微电极充灌电极内液,使电极电阻为3~5 Ω。给予适当负压吸引,通过调节显微镜焦距及操作仪使电极与细胞表面不断靠近,最终充分接触,形成高阻封接,电阻值达到GΩ 以上,继续加大负压破膜,给予电容及串联电阻补偿,此时形成全细胞记录模式;将各组干预药物分别加入灌流槽中,待反应10~15 min 后进行电流记录。电流信号经Ag/AgCl 电极引导,由膜片钳AXON 200B 放大器放大,电流的记录采用电压钳制方式,数据的采集及分析处理由Pclamp 6.0 软件完成。
1.8 统计学处理
采用SPSS 25.0 统计软件分析,计量资料以均数±标准差(±s)表示,组间比较若方差齐时采用单因素方差分析(ANOVA),方差不齐采用非参数秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 最佳含药血清浓度确定
实验结果显示,当含药血清加入比例为2.5%、5.0%、10.0%时,细胞状态良好,当含药血清浓度为15.0%时,发现细胞状态变差,所以为了保证药效和兼顾细胞状态,所以后期选择10.0%的含药血清浓度用于实验,见图1。

图1 不同浓度含药血清对细胞形态的影响Fig 1 Effects of different concentrations of drug-containing serum on cell morphology
2.2 心肌细胞缺氧/复氧模型制备中最佳H2O2 浓度及作用时间确定
实验结果显示,当H2O2只作用3 h 时,不管何种浓度对细胞均没有显著性的氧化损伤;作用8 h,当浓度为250 μmol/L时,对H9C2 细胞有显著的氧化损伤作用,当浓度增加或者作用时间延长至16 h时,细胞状态很差,不适合用于后期实验,所以选择250 μ mol/L的H2O2作用8 h 用于后期的实验,见图2。

图2 不同浓度及作用时间的H2O2对H9C2 心肌细胞的氧化损伤作用Fig 2 Oxidative damage of H2O2 at different concentrations and time of action on H9C2 cardiomyocytes
2.3 各组H9C2 心肌细胞活性的变化
CCK-8 结果显示,与A 组相比,B 组心肌细胞活性明显下降,差异具有统计学意义(P<0.001);与B组心肌细胞相比,加入芪参益气滴丸的C 组心肌细胞活性增加,差异具有统计学意义(P<0.001);与C组相比,D 组和E 组心肌细胞活性明显降低,差异具有统计学意义(P<0.01),见表1。
表1 各组心肌细胞活性(n=6,±s)Tab 1 Myocardial cell activity in each group(n=6,±s)
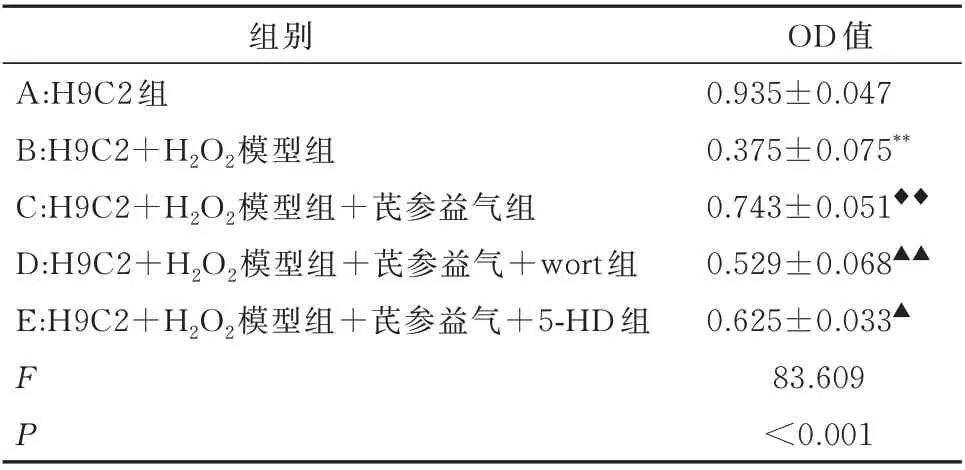
表1 各组心肌细胞活性(n=6,±s)Tab 1 Myocardial cell activity in each group(n=6,±s)
注:与A 组相比,**P<0.001;与B 组相比,◆◆P<0.001;与C 组相比,▲P<0.01,▲▲P<0.001。
OD 值0.935±0.047 0.375±0.075**0.743±0.051◆◆0.529±0.068▲▲0.625±0.033▲83.609<0.001组别A:H9C2 组B:H9C2+H2O2模型组C:H9C2+H2O2模型组+芪参益气组D:H9C2+H2O2模型组+芪参益气+wort 组E:H9C2+H2O2模型组+芪参益气+5-HD 组FP
2.4 各组H9C2 心肌细胞p-AKT、AKT 的表达水平
Western blot 结果表示各组间AKT 蛋白表达差异无统计学意义(P>0.05);与A 组相比,B、C、D、E组p-AKT 蛋白表达显著降低,组间差异具有统计学意义(P<0.001);而与B 组相比,C、D、E 组p-AKT蛋白表达显著升高,组间差异具有统计学意义(P<0.001)。见图3,表2。
表2 各组心肌细胞AKT 及p-AKT 蛋白相对表达量比较(n=3,±s)Tab 2 Comparison of the relative expression levels of AKT and p-Akt protein in cardiomyocytes of each group(n=3,±s)
注:与A 组比较,**P<0.001;与B 组比较,##P<0.001。
组别A:H9C2 组B:H9C2+H2O2模型组C:H9C2+H2O2模型+芪参益气组D:H9C2+H2O2模型+芪参益气+wort 组E:H9C2+H2O2模型+芪参益气+5-HD 组FP p-AKT 1.00±0.37 0.24±0.03**0.62±0.01**##0.40±0.01**##0.58±0.35**##306.165<0.001 AKT 1.00±0.02 1.03±0.05 1.01±0.05 1.02±0.03 0.99±0.05 0.53 0.72
2.5 全细胞膜片钳实验
正常状态下,H9C2 心肌细胞KATP 通道是不开放的,因此,将细胞膜电位钳置于-40 mV,给予从-80~60 mV 的斜坡刺激诱发背景电流。在0 mV 测试电压下,与A 组心肌细胞相比,B 组心肌细胞外向电流显著增加,组间差异具有统计学意义(P<0.001);而与B 组比较,C 组电流有进一步的增加趋势,组间差异具有统计学意义(P<0.001),表明氧化损伤心肌细胞经芪参益气干预后,呈现明显增强的外向电流。与C 组相比,D 组和E 组电流明显降低,组间具有统计学意义(P<0.001)。提示PI3K/AKT 特异性阻断剂和mitoKATP 特异性阻断剂,均能不同程度地阻断这部分电流。见表3。
表3 电压0 mV 时各组心肌细胞mitoKATP 通道电流(n=10,±s)Tab 3 mitoKATP channel current of myocardial cells in each group at 0 mV voltage(n=10,±s)
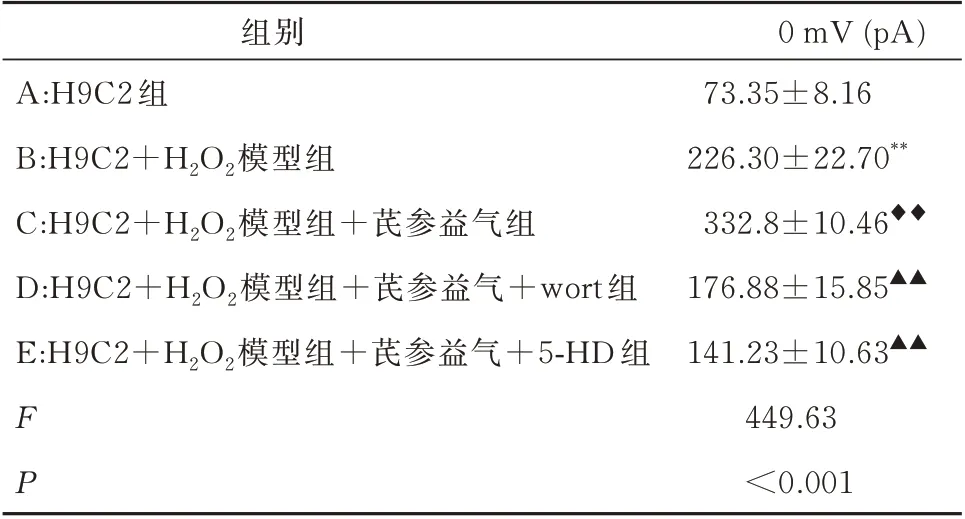
表3 电压0 mV 时各组心肌细胞mitoKATP 通道电流(n=10,±s)Tab 3 mitoKATP channel current of myocardial cells in each group at 0 mV voltage(n=10,±s)
注:与A 组相比,**P<0.001;与B 组相比,◆◆P<0.001;与C 组相比,▲▲P<0.001。
0 mV (pA)73.35±8.16 226.30±22.70**332.8±10.46◆◆176.88±15.85▲▲141.23±10.63▲▲449.63<0.001组别A:H9C2 组B:H9C2+H2O2模型组C:H9C2+H2O2模型组+芪参益气组D:H9C2+H2O2模型组+芪参益气+wort 组E:H9C2+H2O2模型组+芪参益气+5-HD 组FP
以电流对电压作图,可得到心肌细胞KATP的电流-电压关系曲线(Ⅰ~Ⅴ)。在0~20 mV 测试电压范围内,外向电流显著增强,各组电流曲线中后段抬高,与背景电流比较,高出的部分即为开放的KATP 通道电流。见图4。
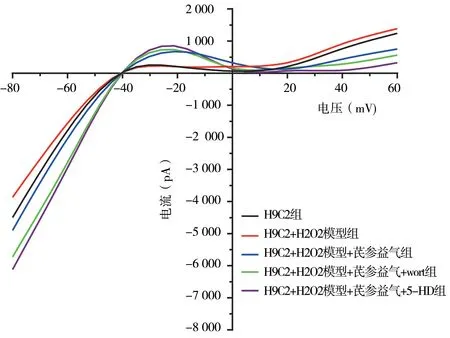
图4 各组心肌细胞KATP 通道电流图Fig 4 KATP channel currents of cardiomyocytes in each group
3 讨论
目前,再灌注已被确定为缺血性心脏病的可行治疗策略。然而,心肌组织供血不足后血流量的恢复通常导致心肌损伤的进一步加重。更严重的是,心肌缺血再灌注(ischemia-reperfusion,I/R)可能产生严重的病理效应,如ROS、氮类物质过度生成,炎症介质释放和招募增加,免疫细胞活化,引起心肌细胞凋亡或坏死,最终导致心肌损伤和功能障碍[8,9]。作为介入术后面临的一种常见且不可避免的病理生理变化,MIRI 可导致心律失常、梗死面积扩大,是一种高发病率、高死亡率的疾病,且在年轻人中发病率呈上升趋势。因此,如何减轻MIRI 造成的损害问题引起了心血管领域学者的关注。尽管既往的研究部分揭示了MIRI 的分子机制,但MIRI 的具体机制仍不够明确,有效防治迫在眉睫。
中国古籍中并无对缺血再灌注损伤的描述,可以认为MIRI 是现代医学发展下的产物。根据再灌注治疗后产生一系列心肌损伤的临床表现,可将其归纳为“胸痹”“真心痛”范畴。目前,有关MIRI 的病因病机及辨证论治尚未形成统一的专家共识。李辉等[10]认为MIRI 的发生以痰瘀痹阻心脉为基础,阳衰阴盛,浊毒内生,心之体络受损为关键。何星灵等[11]认为再灌注治疗可复通血管,以活血化瘀通络为主,当属“祛邪”治标之法,然而“本虚”症状如短气、乏力、眩晕等仍存在。曹蛟等[12]则强调MIRI 以阳气亏虚为本,痰浊瘀血为标,温阳化气,痰瘀同治则阳气可复,脉道通畅。芪参益气滴丸由黄芪、丹参、三七、降香组成,是治疗气虚血瘀型胸痹的中药复方制剂,广泛用于临床治疗缺血性心衰、心绞痛等心血管疾病,以及心肌梗死的二级预防[13,14]。动物实验表明,芪参益气滴丸对CHF 大鼠有明显的心肌保护作用,可能通过抑制TGF-β1/Smads 通路,增强心肌纤维化程度;同时抑制caspase-3 信号通路,改善心肌细胞凋亡,从而起到保护心肌的作用[15]。此外,芪参益气滴丸可部分激活PI3K/Akt 信号通路,从而保护H9C2 细胞免受高糖诱导的系列损伤[16]。临床实验证实芪参益气滴丸能够有效保护AMI 患者PCI 术后血管内皮功能,减轻机体炎性反应,有助于提高心脏功能,且安全性较高[17]。作为多通路、多靶点的中药复方制剂,芪参益气滴丸包含有机酸类、黄酮类、醌类、皂苷类、氨基酸以及其他类化合物共53 种化学成分,各种不同类别的药物活性成分可通过协同作用共同对缺血/再灌注的心肌细胞起到保护作用。
本研究以芪参益气滴丸为代表方,采用血清药理学实验方法,进一步探讨中药复方对MIRI 作用效果及可能机制。实验通过SD 大鼠口服芪参益气滴丸制备不同浓度的含药血清,过观察其对心肌细胞形态变化以确定最佳浓度,结果显示10%为最佳含药血清浓度。此外,以体外培养的H9C2心肌细胞为实验对象,根据心脏在氧化损伤过程中氧化增强反应的原理,选用H2O2诱导细胞损伤,以模拟缺氧/复氧病理模型。本实验观察结果提示250 μmol/L 的H2O2预处理8 h 后,损伤作用作用最显著,可用于后期细胞实验。
MIRI 是多因素参与的复杂病理生理过程,涉及多种机制及信号通路,其中细胞调亡是心肌损伤的关键因素,决定心功能和预后。本研究采用CCK-8法检测心肌细胞存活率,结果提示芪参益气滴丸含药血清可显著提高氧化损伤后H9C2 心肌细胞的存活率,具有一定的心肌细胞保护作用。PI3K 及其下游靶丝氨酸/苏氨酸激酶AKT 属于一个保守的信号转导酶家族,参与多种细胞生物学过程[18]。PI3K/AKT 信号通路被认为是一种内源性负反馈调节机制,在应对有害的外部刺激时促进细胞存活,在MIRI 的病理进展中发挥关键作用[19]。其中,AKT 的活化形式,即p-AKT 可调节大量凋亡相关介质,例如,当p-AKT 被激活时,p-AKT 通过Bcl2家族成员(Bcl2,Bclxl,Bax 和Bad)作用于固有的细胞死亡通路,以及通过caspase 家族成员(cleaved caspase 3,caspase 8 和caspase 9)作用于外部的细胞死亡通路[20]。本研究结果提示,芪参益气滴丸含药血清明显激活氧化损伤心肌细胞中p-AKT 蛋白的表达,而加入PI3K/AKT 抑制剂的心肌细胞中,p-AKT 蛋白表达下降,同时心肌细胞的活性也相对减少,表明芪参益气滴丸可干预PI3K/AKT 信号通路中p-AKT 蛋白的表达,同时增加心肌细胞活性。
ATP 敏感性钾通道(KATP 通道)是一种由细胞内ATP 浓度所调控的内向整流钾离子通道[21]。Tinker 等[22]研究发现KATP 通道大量存在于心房、心室、房室传导系统等心脏组织当中,其不仅能够改善心肌细胞的缺血预适应,也在心肌细胞的信号转导途径中发挥作用,在抵抗MIRI 的过程中扮演着十分重要的角色。Penna 等[23]认为,激活KATP通道能够减少心肌细胞在各种应激状态下的损伤和凋亡。KATP 通道的活力由细胞内的KATP 通道数量和开放程度共同决定,其活动与细胞代谢密切相关,并受到细胞内ATP 浓度的调节:在生理情况下,ATP 在细胞内具有较高浓度,此时KATP 通道受到抑制而关闭;而当心肌细胞受到缺血、再灌注损伤和细胞凋亡等病理刺激时,细胞内的ATP 会被消耗,浓度降低,此时KATP 通道不再受到抑制,导致ATP 通道开放,钾离子外流,细胞膜的静息电位降低,动作电位缩短,钙离子的内流减少,心肌细胞的钙超载减轻[24],从而降低心肌细胞的耗能,增加其应激耐受性,起到保护心肌的作用[25]。本研究发现,当细胞受到氧化损伤后,细胞外向电流显著增加,从而产生应激的心肌保护作用;在氧化损伤的基础上给予芪参益气干预后,心肌细胞电流明显增加,与模型组相比具有统计学意义。当加入mito-KATP 特异性阻断剂5-HD 后,电流被部分阻断,表明该电流的产生与mitoKATP 通道激活密切相关,推测芪参益气滴丸可能具有KATP 通道开放剂样作用。此外,加入阻断剂的心肌细胞活性较芪参益气滴丸干预组显著下降,表明mitoKATP 通道的开放可能对心肌细胞的具有保护作用。
综上所述,本实验证实芪参益气滴丸通过激活H9C2 心肌细胞中p-AKT 蛋白的表达及KATP 通道的开放,从而对心肌细胞起到保护作用。但芪参益气滴丸的具体机制及相关联级反应尚未探讨,需要进行进一步的实验以明确其机制。

