CD14-TLR4-NF-κB信号传导通路在脂多糖诱导ALI/ARDS中的作用及机制研究
金肇权,张文彬,陈欣,朱滨
急性肺损伤(acute lung injury,ALI)是由多种致病因素所导致的肺泡上皮细胞及毛细血管内皮细胞受损,可造成弥漫性肺间质及肺泡水肿,最终引起急性低氧性呼吸功能不全[1-2]。随着病情进一步恶化,ALI 常演变为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[3],临床症状主要表现为顽固性低氧血症,具有较高的致死率[4]。ALI/ARDS 既是多种呼吸道重症的发病基础,又是全身炎症活动剧烈时较易出现的综合征[5]。近年来,ALI/ARDS 的发生发展机制及其影响因素已成为临床研究热点问题。脂多糖(lipopolysaccharide,LPS)是由脂质和多糖所构成的复合物,有研究表明,脂多糖常通过Toll 样受体(toll-like receptors,TLR)家族参与机体炎性活动和免疫反应,与机体多种炎性疾病的发生发展密切相关[6]。另据研究显示,白细胞分化抗原14(leukocyte differentiation antigen 14,CD14)作为脂多糖受体,其主要生物学活性是识别、结合脂多糖复合物,参与、把控脂多糖性细胞反应[7];TLR4 作为TLR 家族的主要成员之一,是参与非特异性免疫应答反应和炎症反应的主要蛋白质因子[8];而核因子激活的B 细胞的κ-轻链增强(enhancement of kappa light chain in nuclear factor activated B cells,NF-κB)通过结合多种炎性细胞因子或肿瘤坏死因子,参与机体各种炎症活动,并与多种炎症疾病的发生发展密切相关[9]。但目前临床鲜有研究探讨过CD14、TLR4、NF-κB 以及脂多糖等细胞因子在ALI/ARDS 发病中的作用,本次研究以此目标为出发点,对大鼠进行ALI/ARDS 造模实验,现报道如下。
1 材料与方法
1.1 材料清洁级健康雄性SD 大鼠90 只,8~10周,体质量(187.52±5.16)g,购买于北京宝元兴业科技有限公司[SYXK(京)2020-0167]。本研究符合一般动物实验伦理学原则。
1.2 动物分组与实验方法将90只SD大鼠随机分为A、B、C 三组,每组各30 只。A 组和B 组大鼠在左侧尾静脉部位注射内毒素9 mg/kg,制造大鼠ALI/ARDS 模型。C 组大鼠静脉注射生理盐水。给予A组大鼠CD14 模拟物、TLR4 模拟物以及NF-κB 模拟物静脉注射。取大鼠肺组织,留取一半肺组织,4%甲醛溶液固定,用于病理染色;剩余组织置于液氮中速冻后置于-80 ℃超低温冰箱保存,用于蛋白质印迹法检测。
1.3 仪器与试剂大鼠sEPCR 检测试剂盒(上海信裕生物工程有限公司);Trizol试剂(武汉科昊佳生物科技有限公司);Lipofectamine 2000 转染试剂[上海赛默飞世尔科技(中国)有限公司];血液分析仪(日本SYSMEX)及配套试剂检测血常规指标;全自动生化分析仪(北京普朗新技术有限公司);大鼠肺功能仪(北京广源达科技发展有限公司);血气电解质分析仪(南京普朗医疗设备有限公司)。
1.4 CD14、TLR4、NF-κB P65 和脂多糖样本收集和检测方法CD14、TLR4、NF-κB P65 和脂多糖蛋白表达:采用蛋白质印迹法。取部分梗阻侧肾组织标本,匀浆器充分研磨后加入裂解液裂解并提取总蛋白,采用BCA 法测定蛋白浓度。根据目标蛋白大小配置适合浓度的凝胶、分离胶和浓缩胶。电泳加压转膜后脱脂奶粉封闭1 h。加入特异性CD14 抗体、TLR4 抗体、NF-κB P65 抗体和脂多糖抗体,稀释比例为1∶1 000,以β-actin(1∶5 000)作为对照。去除一抗,洗涤后加入二抗,室温孵育2 h,漂洗,化学发光法X 线片显影,采用Image J 软件得到条带灰度值,计算蛋白相对表达量。
1.5 HE 染色(1)甲醛固定的肺组织采用石蜡包埋的方法制备成厚度5~7 μm 的石蜡病理切片,检测时先行脱蜡水化,水化后的肺组织切片放入苏木精水溶液中染色3 min。(2)流水冲洗掉多余的苏木精,1%的盐酸乙醇分化5~8 s,0.6%氨水返蓝5~8 s。(3)流水冲洗1 h 后入蒸馏水片刻。(4)70%和90%乙醇中脱水各10 min。(5)乙醇伊红染色液染色2~3 min。(6)染色后的切片经纯乙醇脱水,经二甲苯使切片透明。(7)将已透明的切片滴上加拿大树胶,盖上盖玻片封固。
1.6 观察指标(1)三组大鼠造模后呼吸频率(respiratory rate,RR)、动脉血氧分压(arterial partial pressure of oxygen,PaO2):采用大鼠肺功能仪对大鼠RR 进行检测,于造模后采集大鼠动脉血5 mL,并采用血气电解质分析仪对其PaO2进行分析;(2)三组大鼠的CD14、TLR4、NF-κB P65 和脂多糖蛋白表达水平;(3)三组大鼠的CD14、TLR4、NF-κB P65 和脂多糖蛋白相关性;(4)HE 染色结果;(5)肺组织损伤Murray 评分[10]:主要根据低氧血症评分、呼气末正压及肺顺应性等指标,各项评分均为0~4 分。肺组织损伤评分为四项结果评分相累加。
1.7 统计学方法采用SPSS 22.0 系统软件分析,其中符合正态分布的计量资料以表示,三组间比较采用方差检验,差异有统计学意义者进一步采用事后LSD-t检验分析两两间差异;Pearson 相关系数分析CD14 蛋白、TLR4 蛋白、NF-κB P65 蛋白和脂多糖蛋白的相关性,P<0.05 表示差异有统计学意义。
2 结果
2.1 大鼠造模后RR、PaO2分析造模12 h 后,在三组大鼠的RR方面:A组>B组>C组,组间均差异有统计学意义(均P<0.001);而在PaO2方面:A 组<B 组<C 组,各组间均差异有统计学意义(均P<0.001),见表1。
表1 90只大鼠造模12 h后的RR与PaO2比较/
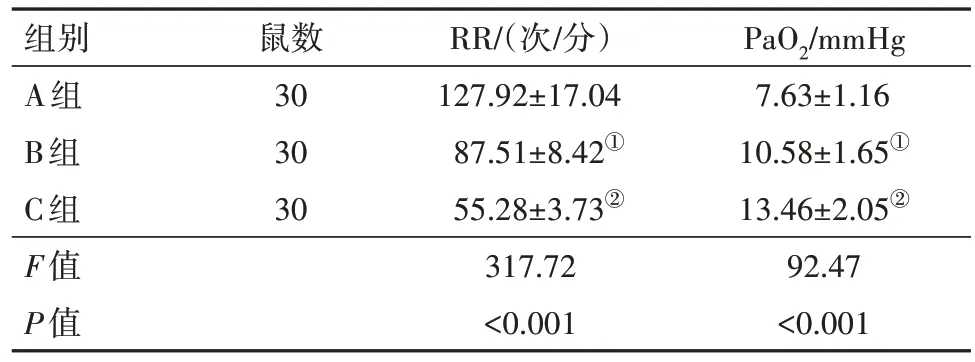
表1 90只大鼠造模12 h后的RR与PaO2比较/
注:RR为呼吸频率,PaO2为血氧分压。①与A组比较,P<0.001。②与B组比较,P<0.001。
2.2 三组大鼠的CD14、TLR4、NF-κB P65 和脂多糖蛋白表达对比CD14 蛋白、TLR4 蛋白、NF-κB P65 蛋白和脂多糖蛋白表达方面:A 组>B 组>C 组,任意两组间的均差异有统计学意义(均P<0.001),见表2。
表2 90只大鼠的CD14、TLR4、NF-κB P65和脂多糖蛋白表达对比/

表2 90只大鼠的CD14、TLR4、NF-κB P65和脂多糖蛋白表达对比/
注:CD14 为白细胞分化抗原14,TLR4 为趋化因子受体4,NFκB P65为核因子-κB P65。①与A组比较,P<0.001。②与B组比较,P<0.001。
2.3 A 组大鼠实验后的CD14、TLR4、NF-κB P65和脂多糖蛋白相关性研究Pearson 相关性分析显示,A 组大鼠的脂多糖蛋白分别与CD14 蛋白、TLR4蛋白以及NF-κB P65 蛋白均呈正相关(P<0.05),见表3、图1。
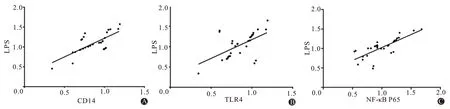
图1 急性肺损伤大鼠各蛋白与脂多糖蛋白(LPS)相关性:A为白细胞分化抗原14(CD14)蛋白;B为趋化因子受体4(TLR4)蛋白;C为核因子-κB(NF-κB P65)蛋白
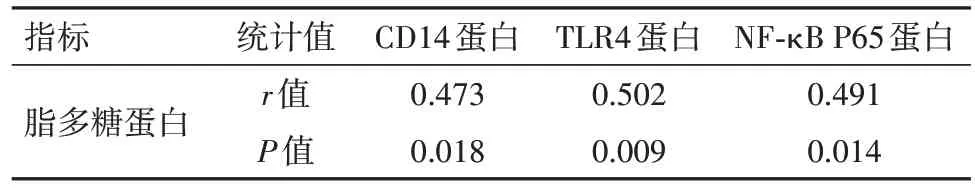
表3 急性肺损伤大鼠实验后的白细胞分化抗原14(CD14)、趋化因子受体4(TLR4)、核因子-κB(NF-κB P65)和脂多糖蛋白相关性研究
2.4 HE 染色图光镜下可见C 组大鼠肺组织切片肺泡结构较为清楚,未发生炎性细胞渗出、浸润。B组大鼠可见较为明显的肺灶性出血,肺泡和肺间质水肿,并且存在较多的炎性细胞浸润。A 组大鼠可见肺灶性出血、肺泡和肺间质水肿以及炎性细胞浸润情况较B组更为严重。
2.5 肺组织损伤评分肺组织损伤评分方面:A 组为(14.73±0.52)分,B 组为(9.54±0.37)分,C 组为(5.38±0.07)分,且A>B>C,三组比较差异有统计学意义(F=479.13,P=0.001),B 组与A 组、C 组比较,均P<0.001。
3 讨论
ALI/ARDS 是临床上较为常见的肺部危重症之一,具有一定的致死率[11]。近年来,随着我国人口老龄化进程的加速,社会工业化的不断发展以及空气污染的日益严峻,ALI/ARDS 发病率呈不断上升趋势[12]。ALI/ARDS 作为一种临床综合征,好发于创伤、休克和感染等病人中,其主要临床症状表现为呼吸窘迫以及顽固性低氧血症[13]。目前,临床治疗方案主要包括药物疗法配合氧疗、机械通气等对ALI/ARDS 病人进行治疗,但部分病人因病情较重或治疗方式不当,治疗效果较差[14]。但目前临床关于影响ALI/ARDS 发生发展因素及其作用机制尚未明确,而相关研究表明炎症反应可能是影响ALI/ARDS 发病的重要因素之一[3]。本研究对大鼠进行ALI/ARDS 模型培养,并给予部分ALI/ARDS 模型大鼠CD14 模拟物、TLR4 模拟物以及NF-κB 模拟物静脉注射,旨在观察CD14-TLR4-NF-κB 信号传导通路在脂多糖诱导ALI/ARDS中作用及机制。
本研究结果显示,ALI/ARDS 模型组大鼠造模后的RR 明显高于正常组大鼠,而PaO2则明显低于正常组大鼠,尤其是经模拟物转染组大鼠,其变化幅度进一步扩大,这与武昊天等[15]研究结果相一致。RR 是指单位时间内的呼吸次数,其呼吸频率明显加快表明机体出现呼吸窘迫现象,是ALI/ARDS 等肺部疾病的主要症状之一[16]。PaO2即动脉血中氧分子物理溶解时出现的张力,主要反映了机体是否缺氧以及缺氧的程度。PaO2明显降低在一定程度上反映了机体存在缺氧状况,同样是ALI/ARDS等肺部疾病的常见临床症状[17]。因此,研究结果表明了大鼠ALI/ARDS 造模成功,而经CD14 模拟物、TLR4 模拟物以及NF-κB 模拟物转染后,大鼠病变程度进一步加重,反映了这3 项因子对大鼠机体炎性活动和ALI/ARDS病情恶化的促进作用。CD14作为脂多糖的受体,由糖蛋白构成,能够识别、结合脂多糖,还可作为革兰阴性或阳性细菌等其他产物的受体,在炎症反应、内毒素休克等病理反应中均具有重要作用。TLR4作为TLR4家族的主要成员之一,对获得性免疫应答反应具有调控作用,其活化后将激活机体抗微生物防御系统,产生IL-6 和TNF以及趋化型细胞因子,并最终参与机体炎症反应。NF-κB P65 作为NF-κB 家族重要一员,参与细胞对外界刺激的响应,如细胞因子、辐射、重金属、病毒等,在炎症反应、免疫应答等过程中均起到关键作用。Ness T 等[18]在研究中发现,CD14-TLR4-NF-κB信号传导通路与机体炎症反应和免疫应答等密切相关,本研究结果表明增强CD14-TLR4-NF-κB 信号传导通路能够加剧ALI/ARDS 模型大鼠的病情恶化程度。
本研究对造模后三组大鼠的CD14、TLR4、NFκB P65 和脂多糖蛋白表达做出比较,结果显示,大鼠ALI/ARDS 造模后,其CD14、TLR4、NF-κB P65 和脂多糖的蛋白表达均明显上升,尤其是给予模拟物注射组模型大鼠,其变化幅度更大,这与Wu 等[19]学者的研究结果相一致。本研究还对模拟物注射组模型大鼠的脂多糖蛋白与CD14 蛋白、TLR4 蛋白、NF-κB P65 蛋白的相关性作出探讨,结果显示均呈正相关。脂多糖主要由多糖和脂质构成,脂多糖主要通过诱导存在于目标细胞的细胞膜中的TLR4 来表现其作用[20]。TLR4 与内毒素结合蛋白共同作用捕获脂多糖,并将其然后将其输送给CD14 和NFκB P65 分子,最终作用于机体炎症活动与免疫反应[21]。研究结果说明,增强CD14-TLR4-NF-κB 信号传导通路能够通过诱导脂多糖类因子的表达上升,并最终加快机体ALI/ARDS 病情发展与恶化。本研究还对三组大鼠造模后的肺组织切片进行染色,结果显示经模拟物转染后,其肺灶性出血、肺泡和肺间质水肿以及炎性细胞浸润情况较普通ALI/ARDS模型组大鼠更为严重,而其肺组织损伤程度也更为严重。上述研究结果说明经模拟物转染后,大鼠的ALI/ARDS相关炎性活动更加显著。
综上所述,CD14-TLR4-NF-κB 信号传导通路能够增强脂多糖表达并促进机体的炎性活动,参与ALI/ARDS 的发生、发展。本研究尚存在一些不足之处,本研究仅对CD14-TLR4-NF-κB 信号传导通路在大鼠ALI/ARDS 中作用及机制进行了探讨,未来的研究中可以取手术治疗的ALI/ARDS 病人的病变肺组织切片进行转染,观察其转染后病变情况,以便更好地为临床提供依据。

