丝裂原活化蛋白激酶抑制剂对氧化应激鸭小肠上皮细胞屏障功能的影响
郑 超,皮劲松,吴艳,魏文焯,梁振华,杜金平,刘静波,张昊*
(1.湖北省农业科学院畜牧兽医研究所,动物胚胎工程及分子育种湖北省重点实验室,湖北省农业科技创新中心,湖北武汉 430064;2.西南科技大学生命科学与工程学院,四川绵阳 621010)
应激不仅造成蛋鸭一定程度的肠组织损伤,而且还增加肠道炎症损伤因子的表达,体现为蛋鸭采食量下降、体重降低,产蛋性能下降,养殖后期死淘率增加等。肠黏膜是机体抵御致病菌原损伤的第一道防线,也是应激的重要靶器官。在应激时,肠黏膜易发生缺血、缺氧,肠道通透性增加,导致屏障功能受损,危害机体健康。肠上皮细胞之间的紧密连接形成紧密的屏障可防止肠腔内病原体和内毒素侵入体内,而适当的上皮屏障成熟对于肠道防御和体内平衡至关重要。丝裂原活化蛋白激酶(MAPK)信号通路是氧化应激反应中基因转录的主要调节剂,在细胞信号转导发挥重要作用,例如细胞生长、分化、凋亡和对环境刺激的应激反应。p38 是丝裂原活化蛋白激酶(MAPK)家族的成员,是促炎性细胞因子通路中的关键酶,与p38 具有结构和功能同源性的MAPK 包括c-Jun 氨基末端激酶(JNK)、胞外信号调节激酶1/2(ERK1/2)和细胞外信号调节激酶5/大丝裂原活化蛋白激酶1(ERK5/BMK1)。SB203580是一种特定的p38MAPK 抑制剂,通过直接或间接竞争性与p38a、P 亚基上具有ATP 酶活性的结合位点结合,使p38MAPK 失去与ATP 结合的能力,从而使其失去激酶活性,实现对p38MAPK 信号通路的抑制作用。鉴于肠道作为应激应答的重要靶器官,MAPK 信号通路在应激蛋鸭肠屏障功能的调节作用需要明确。原代鸭小肠上皮细胞具有与体内肠上皮细胞基本结构、代谢和功能相当的特点,是研究肠道应激反应调控机制的良好模型。研究表明,p38MAPK 信号通路涉及氧化应激的调节,并且与肠上皮屏障功能密切相关。本试验通过HO建立鸭小肠上皮细胞氧化应激模型,采用MAPK 信号通路抑制剂(SB203580)研究其对蛋鸭小肠上皮细胞细胞活力、跨膜电阻、氧化应激相关基因以及紧密连接蛋白mRNA 相对表达量的影响,以明确MAPK 信号通路在氧化应激诱导的鸭肠上皮屏障功能障碍中的调控作用。
1 材料与方法
1.1 试验设计 试验取26 日龄鸭胚的小肠组织,参照Zhang 等方法进行细胞培养和氧化应激处理。去除肠系膜及胰腺,将小肠剖开、清洗、剪碎后,用I 型胶原酶对小肠组织消化60 min 后,吹打细胞团获得鸭小肠上皮细胞,将细胞进行差速贴壁培养,收集小肠上皮细胞,铺板培养。试验分为空白对照组(A 组)、阳性对照组(50 µmol/L HO,B 组)和氧化应激基础上添加MAPK 信号通路抑制剂组(10 µmol/L SB203580,C 组),每组3个重复。待36 h 后细胞布满培养板,B 组和C 组50 µmol/L HO处理细胞4 h 构建氧化应激模型,C 组添加10 µmol/L SB203580,为试验0 h。
1.2 细胞活力测量 使用CCK-8(Dojindo,Japan)测量细胞活力。将小肠上皮细胞以1 × 10细胞/孔接种于96 孔板中,将未分配细胞的孔用作空白对照,每组6个重复。测量各孔细胞12、24、36 h 细胞活力,将10 μL CCK-8 溶液加入细胞中,并将细胞在37℃下孵育1 h。使用酶标仪(Bio-Rad,Hercules,CA)测量各孔在450 nm 处的吸光度。使用以下公式计算细胞存活率:细胞存活率=(试验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)×100%。
1.3 跨上皮细胞电阻(TEER)测量 在Transwell12孔板中培养细胞至分化成熟,然后分别测其0、12、24、36 和48 h 阻值的变化情况,每组3个重复。细胞处理后使用细胞电阻仪 (millicell ERS-2,Millipore,USA)测定Transwell12孔板(Corning,USA)上室内细胞的TEER 值。测量各组0、12、24、36 h 和48 h TEER 值,每组3个重复。设置2个空白对照组(上室内未接种肠上皮细胞),加入相同基础培养基,每孔选定3个点,测定3 次,取平均值,再减去空白对照组的平均电阻值,即为该孔的TEER。
1.4 FITC-右旋糖苷透过率检测肠上皮细胞单层通透性TEER 测量试验结束后,上室加入200 μL 含有0.5 mg/mL FITC-右旋糖苷的无酚红1640 培养基,下室加入600 μL 无酚红1640 培养基(不含FITC-右旋糖苷)。于37℃,5%CO培养箱内避光孵育60 min,每孔上、下室分别取100 μL 培养基至黑色96 孔板,检测样品的荧光强度(激发光波长485 nm,发射光波长535 nm)。肠上皮细胞对FITC-右旋糖苷通透性用通透性系数Pa 表示,按如下公式计算:
Pa=[A]/t × 1/A × V/[L],其中[A]为下室荧光值,t 为孵育时间(以秒计算),A 为上室滤膜面积(以cm表示),V 为下室液体量,[L]为上室荧光值。试验结果均以Pa/Pc × 100%表示。
1.5 细胞RNA 提取与反转录 氧化应激模型构建后,继续培养细胞12 h,将细胞样从培养箱中取出,用PBS轻洗2 遍,采用TRIzol提取细胞RNA。核酸蛋白测定仪(NanoPhotometer-N60,Implen,GER)测定其吸光度(OD)值,样品OD在1.8~2.2 可用于后续试验,cDNA 合成按Thermo scientific 反转录试剂盒(K1622,Thermo,USA)说明书操作,反转录后的cDNA 于-80℃保存备用。
1.6 氧化应激相关基因和小肠紧密连接蛋白mRNA 相对表达量的测定 引物设计:从NCBI 上下载鸭的、核因子E2 相关因子2()、血红素氧合酶()、闭合小环蛋白()、紧密连接蛋白1()和咬合蛋白()mRNA 的序列,用Premier 5.0 软件设计引物,引物序列见表1。

表1 引物序列
荧光定量PCR:每个样品3个重复,反应体系15 µL(100 ng/µL):SYBRPCR Buffer 7.5 µL,cDNA 1 µL,forward primers 0.4 μL,reverse primers 0.4 μL,dd HO 5.7 μL。反应程序:95℃ 7 s,95℃ 5 s,60℃ 30 s,40个循环。基因的相对表达量由2表示。
1.5 统计分析 试验数据用SPSS 23.0 统计分析软件进行One-way ANOVA、Two-way ANOVA 和Duncan's 方法多重比较,以<0.05 作为差异显著性标准。
2 结果与分析
2.1 细胞形态观察 倒置显微镜下细胞形态特征如图1所示,培养36 h 后细胞形成规则的“铺路石”状(图1-A)。与对照组相比,HO处理导致细胞死亡或破坏,可观察到漂浮的细胞破碎物,细胞团中间出现空隙(图1-B)。添加SB203580 后可见少量漂浮的细胞代谢产物,细胞形态正常(图1-C)。

图1 小肠上皮细胞形态特征(×100)
2.2 MAPK 抑制剂对细胞活力的影响 如图2 所示,HO处理细胞后,细胞活力出现不同程度的降低,SB203580 处理改善了HO引起的细胞活力下降,但是添加SB203580 12~36 h 后细胞活力仍持续下降。在12 h,与A 组相比,B 组细胞活力下降到80%左右(<0.05),C 组则有所上升(<0.05)。在24 h,与A 组相比,B组细胞活力降低(<0.05),C 组细胞活力下降(>0.05);C 组细胞活力较B 组提高(<0.05)。在36 h,3 组细胞活力为A 组>C 组>B 组(<0.05)。

图2 MAPK 抑制剂对细胞活力的影响
2.3 MAPK 抑制剂对TEER 的影响 如图3 所示,HO处理使TEER 下降,SB203580 显著提高了TEER。A组细胞连续培养36 h,TEER 逐渐上升,36 h 后有所下降。B 组细胞HO处理,12 h TEER 值下降,36 h 有所上升后下降。C 组TREE 较B 组上升(<0.05)。
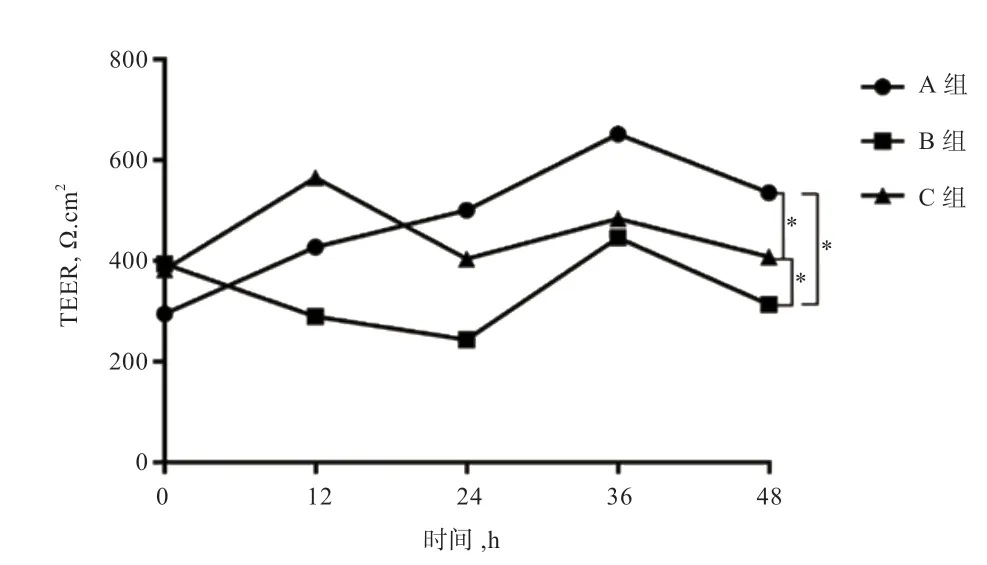
图3 MAPK 抑制剂对TEER 的影响
2.4 MAPK 抑制剂对FITC-右旋糖苷通透性(Pa/Pc)的影响 由图4 可知,与对照组相比,HO处理引起FITC-右旋糖苷通透性(Pa/Pc)增加(<0.05),添加SB203580 后显著降低。
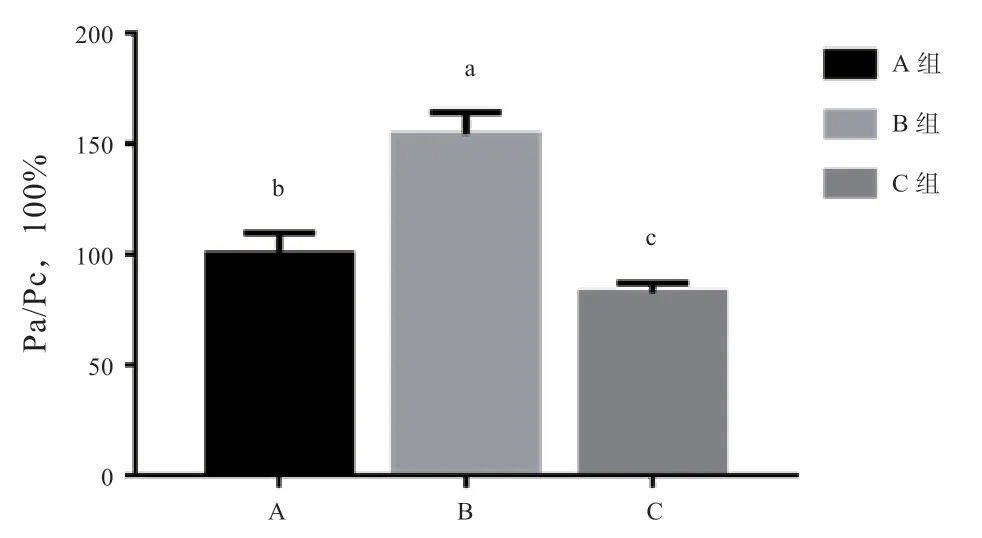
图4 MAPK 抑制剂对FITC-右旋糖苷通透性(Pa/Pc)的影响
2.5 小肠上皮细胞氧化应激相关基因mRNA 相对表达量由图5 可知,HO诱导氧化应激后,与A 组相比,B组和相对表达量提高(<0.05)。与B 组相比,C 组和相对表达量降低(<0.05)。
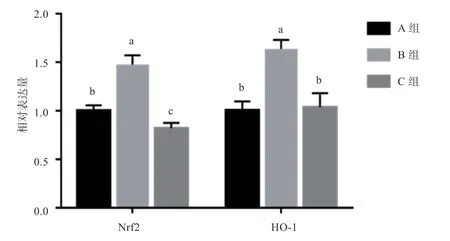
图5 MAPK 抑制剂对小肠上皮细胞氧化应激相关基因mRNA 相对表达量的影响
2.6 小肠上皮细胞紧密连接蛋白mRNA 相对表达量 由图6可知,与A 组相比,B 组相对表达量提高(<0.05),和相对表达量降低(<0.05)。与B 组相比,C 组和相对表达量提高(<0.05)。
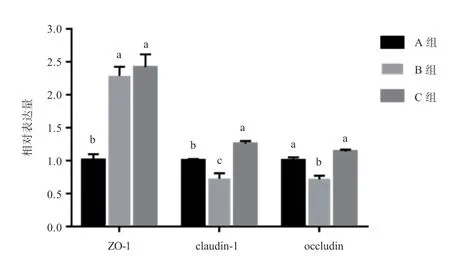
图6 MAPK 抑制剂对小肠上皮细胞紧密连接蛋白mRNA 相对表达量的影响
3 讨 论
鸭胆小、易惊,饲养管理导致应激时可诱发机体内氧化应激,在短时间内产生大量高活性氧分子,加速活性氧(ROS)在细胞内的积累,抗氧化系统失衡,导致氧化损伤过程,影响细胞活力。肠道作为重要的应激靶器官,肠上皮细胞通过内源信号应答和反馈调节维持机械屏障功能。ROS 的产生是影响细胞活力,导致细胞损伤、凋亡和坏死的主要原因。氧化应激通过p38MAPK 通路来调节和基因表达,从而产生或加深氧化应激带来的损伤。本试验发现,与对照组相比,HO诱导氧化应激导致细胞活力下降,SB203580 处理改善了HO引起的细胞活力下降,但可能受培养基中高剂量HO的影响,添加SB203580 12~36 h 后细胞活力仍持续下降。
氧化应激能够激活通路调节和的表达及活性,从而引起机体发生生理变化。是氧化应激表达的关键转录因子,通过大量ROS响应细胞损伤,与抗氧化反应元件(ARE)结合,介导的表达,在抑制细胞氧化损伤中发挥重要作用。Zhang 等研究发现,SB203580 通过抑制p38 磷酸化来抑制和的表达,并进一步阐明了和上调与p38MAPK 磷酸化有关。本试验也发现SB203580 通过抑制p38MAPK 来降低和的表达量。
应激引起鸭肠组织损伤,增加氧化应激损伤程度,并通过上调内质网应激强度和炎症反应,导致肠上皮细胞凋亡和肠黏膜屏障功能受损。TEER 和FITC-右旋糖苷通透性(Pa/Pc)是衡量肠上皮细胞通透性的常用指标之一,反映物理屏障功能变化。本试验结果表明,与对照组相比,HO处理使TEER 下降,抑制p38MAPK 信号通路显著提高了TEER 和降低FITC-右旋糖苷通透性(Pa/Pc)。紧密连接是顶端和基底外侧质膜结构域之间的界面,是细胞旁通透性的主要决定因素。应激影响肠黏膜上皮紧密连接导致肠屏障功能障碍,增加肠道通透性,肠腔中的病原体和内毒素进入循环系统,从而导致局部和系统疾病的发展。肠上皮结构和功能的完整性取决于紧密连接蛋白包括和的正常功能和调控。研究表明,和的变化与肠上皮功能障碍有关,是观察紧密连接屏障功能和通透性功能的重要指标。Zhu 等研究表明,抑制p38MAPK 信号通路的表达能调节肠上皮细胞的氧化还原平衡,从而减轻双酚A 诱导的肠屏障功能破坏。荀文娟等研究发现,抑制p38MAPK信号通路可能通过提高紧密连接蛋白mRNA 表达和降低炎性因子mRNA 表达,从而改善肠黏膜屏障功能。本试验发现,氧化应激降低了TEER,肠道通透性增加,SB203580 处理上调和表达,减轻了HO诱导的氧化应激对屏障功能的损伤。
4 结 论
在本试验条件下,SB203580 在一定程度上能够促进鸭小肠上皮细胞的生长,可有效缓解HO引起的氧化损伤,同时增加氧化损伤过程中和的表达量,保护细胞紧密连接的屏障作用,使细胞活力上升。

