贝莱斯芽孢杆菌HNU24高效拮抗茄雷尔氏菌和促进植物生长活性的研究
曹 宇,陈鹏泽,曹秀兰,胡安娜,叶雨婷,李 鹏1,2,*
(1.热带岛屿生态学教育部重点实验室,海南 海口 571158;2.海南省热带动植物生态学重点实验室,海南 海口 571158;3.海南师范大学 生命科学学院,海南 海口 571158)
茄科作物青枯病是一种由茄雷尔氏菌(Ralstonia solanacearum)引起的典型细菌性维管束土传病害,其病原能长时间存活于土壤中,对植物危害性极强[5]。该病原菌广泛分布于全球热带、亚热带以及温带的部分地区,寄主范围极广,除危害多种茄科作物外还可侵染花生、香蕉等50科200种作物[6-7]。作物种植区域发病后将导致作物大量减产甚至绝产,给农业生产造成巨大的经济损失,已成为海南樱桃番茄等茄科植物种植产业的严重制约因素。
茄科植物青枯病的防治中采用最多的方法是化学防治,容易造成农药残留和环境污染。生物防治是植物病虫害防治的新兴技术,生防产品以其环境友好、效果持久等特质近年来得到迅速发展。目前,主要的生物防治策略包括无致病力菌株、生防菌、诱导抗性及转基因植物的研究与应用[8]。资料显示,微生物、青枯立克中草药杀菌剂、乙蒜素植物仿生农药、青枯病拮抗菌等生防产品已应用于青枯病防治中[9]。但受限于海南典型的亚热带地区高温和高湿等气候环境,部分生防菌剂在海南并没有表现出很好的防治效果。
为进一步研究生物防治技术防控茄科植物青枯病,本研究从海南省樱桃番茄重病田存活的健康植株的砧木根际土壤中分离出了对茄雷尔氏菌具有高效拮抗活性的菌株,通过平板对峙的方法从分离出的菌株中筛选出一株对茄雷尔氏菌拮抗效果优良的贝莱斯芽孢杆菌(Bacillus velezensis,编号为HNU24),该菌株还表现出在番茄根系和茎部稳定定殖的特性和对番茄的显著促生长作用。本研究对防治茄科植物青枯病和采用生物防治技术提高茄科植物的产量具有重要的指导意义。
1 材料与方法
1.1 供试材料
1.1.1 供试菌强致病力茄雷尔氏菌EP1[10]、贝莱斯芽孢杆菌FZB42和HNU24由本实验室保存,其中菌株HNU24分离自海南陵水县樱桃番茄青枯病重病田健康植株的砧木根系。
1.1.2 培养基TTC固体培养基配方为葡萄糖10 g、酪蛋白水解物1 g、胰蛋白胨10 g、琼脂15 g、蒸馏水1 000 mL。TTC液体培养基配方为葡萄糖10 g、酪蛋白水解物1 g、胰蛋白胨10 g、蒸馏水1 000 mL。LB固体培养基配方为胰蛋白胨10 g、酵母浸粉5 g、氯化钠10 g、琼脂15 g、蒸馏水1 000 mL。LB液体培养基配方为胰蛋白胨10 g、酵母浸粉5 g、氯化钠10 g、蒸馏水1 000 mL。
1.1.3 番茄品种
番茄品种Moneymaker由华南农业大学汪国平教授馈赠。
1.2 平板对峙试验
将分离纯化出的HNU24和保存的茄雷尔氏菌EP1活化后分别转移至新鲜的LB液体培养基和TTC液体培养基中,均在恒温摇床上于200 rmp、28 ℃条件下振荡培养48 h;加热TTC固体培养基使其完全融化,待其降至适宜温度(37 ℃左右)后按培养基与菌液的体积比为100:1的比例向融化后的TTC培养基中加入已摇好的EP1菌液(OD600≈1.2),并彻底混匀;向直径为9 cm的培养皿中倒入20 mL混合后的培养基,待平板彻底凝固后在平板上用直径为5 mm 的打孔器打孔;分别向平板的每个孔中加40µL HNU24 菌液(OD600=2.0);在30℃培养箱中培养48 h后观察统计抑菌圈直径。平板对峙实验以贝莱斯芽孢杆菌FZB42作对照。
俩人乘坐开往郊区的公交车,颠簸了两个小时才来到这个偏僻的地方,然后像做贼似的偷偷藏在这堵矮墙后面,煞有介事地监视着五十米开外那两栋楼。
1.3 HNU24发酵液乙酸乙酯萃取物的制备
将HNU24 纯培养物置于LB 液体培养基中震荡培养(30 ℃、200 rpm)48 h,于12 000 g 离心20 min,收集上清液。于上清液中加入等体积的乙酸乙酯,充分震荡摇匀,将有机相于旋转蒸发仪中蒸干,最后使用DMSO溶液将蒸干后的萃取物溶解(浓度调整为1mg/mL),通过平板检测法检测萃取物抑制茄雷尔氏菌的活性,检测时采用DMSO做对照,其他操作参照1.2中的描述。
1.4 EP1与贝莱斯芽孢杆菌HNU24的共培养实验
将茄雷尔氏菌EP1和贝莱斯芽孢杆菌HNU24分别接种在TTC固体培养基和LB固体培养基上以获得单菌落。将EP1 和HNU24 的单菌落分别接种在10 mL 的TTC 液体培养基和LB 液体培养基中,在28 ℃、160 rpm条件下振荡培养48 h获得单培物(OD600=2.0),分别标记为A、B。按200µL的接种量将A、B分别接种在10 mL TTC 液体培养基和LB 液体培养基中;按100µL 的接种量将A、B 同时接种在10 mL TTC 液体培养基中,分别标记为MP(A)、MP(B)、CP(A+B),均在28 ℃、160 rpm 条件下振荡培养。在第6、12、18、24、30、36、42、48 h分别从MP(A)、MP(B)、CP(A+B)中取出1 mL 3种菌液,连续稀释这三种菌液(稀释倍数为10-6、10-7、10-8),将稀释后的菌液按各100µL的接种量分别在TTC固体培养基和LB固体培养基上涂板(每个稀释倍数各有3个重复),在30 ℃的培养箱培养48 h后选取菌落数量适当的(30~60个)固体培养基平板统计在不同振荡培养时间共培养EP1和HNU24的菌落数(EP1和HNU24的分别培养作为对照)。
1.5 贝莱斯芽孢杆菌HNU24的生防实验
分别将EP1 接种在10 mL 的TTC 液体培养基中,HNU24 和FZB42 接种在10 mL LB 液体培养基中,于28 ℃、180 rpm条件下进行恒温摇床培养24 h,用无菌水稀释至500 mL制成菌悬液(OD600=1.0)。选出80株健康、长势一致的番茄幼苗,分为A、B、C、D组,每组20株。A组幼苗的根蘸取无菌水后再移栽入无菌土中;B 组幼苗的根蘸取EP1 菌液后再移栽入无菌土中;C 组幼苗的根蘸取EP1 菌液前先在HNU24 菌液中浸泡5 min,然后移栽至无菌土中;D组幼苗的根蘸取EP1菌液前先在FZB42菌液中浸泡5 min,然后移栽至无菌土中。最后将4组番茄幼苗置于25 ℃温室条件下培养,每隔2 d拍照并记录每个组的番茄植株发病株数,最后分别计算各组幼苗的发病率。番茄幼苗发病率=发病幼苗数/总幼苗数×100%。
1.6 贝莱斯芽孢杆菌HNU24的促生长实验
将HNU24在10 mL的LB液体培养基中于28 ℃、180 rpm条件下恒温摇床培养48 h后,用无菌水稀释至500 mL 制成菌悬液(OD600= 1.0)。选出60 株健康、长势良好的番茄幼苗,分为CK-A、CK-B、HNU24-A、HNU24-B 4 组,每组15 株。CK-A 组用稀释50 倍的500 mL LB 液体培养基进行叶面喷施处理。CK-B 组用稀释50倍的500 mL LB培养基进行灌根处理。HNU24-A组用稀释50倍的500 mL HNU24菌液进行叶面喷施处理。HNU24-B组用稀释50倍的500 mL HNU24菌液进行灌根处理。将4组番茄幼苗置于25 ℃的温室条件下培养,每隔3 d处理一次,拍照并测量株高、茎围、鲜重和根系长度。
1.7 贝莱斯芽孢杆菌HNU24定殖能力的探究
把选出的18株健康、长势良好的番茄幼苗的根在HNU24(已经过利福平抗性筛选)菌悬液(OD600=1.0)中浸泡5 min,然后栽种在同一花盆中。每次取3株幼苗(每7 d 取样一次,4 次重复),将根表的土剥除并用无菌水反复冲洗,然后每株称取1 g根和1 g茎,用无菌水冲洗3次后用70%的酒精处理表面1.5 min,再用无菌水冲洗2 次。将上述材料分别研磨成糊状,加入1 mL 无菌水成母液,后加无菌水分别稀释100 倍、1 000倍、10 000 倍。分别取100µL 稀释液涂抹在含30µg/mL 利福平的LB 固体培养基平板上,每浓度均3 个重复,在30℃的培养箱培养48 h后选取菌落数量适当(30~60个)的固体培养基平板统计HNU24的菌落数(在进行菌落统计时以HNU24的纯培养菌落形态作为对照),同时设置空白处理(未接种)对照。按照上述方法,研究接种7、14、21和28 d后每个平板上长出菌落的形态和数目,评价HNU24在番茄幼苗根部和茎部的定殖能力。
1.8 数据统计与分析
用IBM SPSS Statistics 23.0软件进行数据处理分析,采用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 HNU24的分离鉴定和形态特征
菌株HNU24分离自樱桃番茄的根系,目前已保藏于广东省微生物菌种保藏中心,菌株保藏编号为GD⁃MCC61231,全基因组测序结果表明其为贝莱斯芽孢杆菌。HNU24菌落在LB培养基上呈乳白色,凸起且有规则的边缘。扫描电镜结果显示HNU24呈现明显的杆状结构,单个或成对排列,有的也呈短链排列;芽孢呈椭圆状,位于非肿胀胞囊的中间或末端(图1A)。
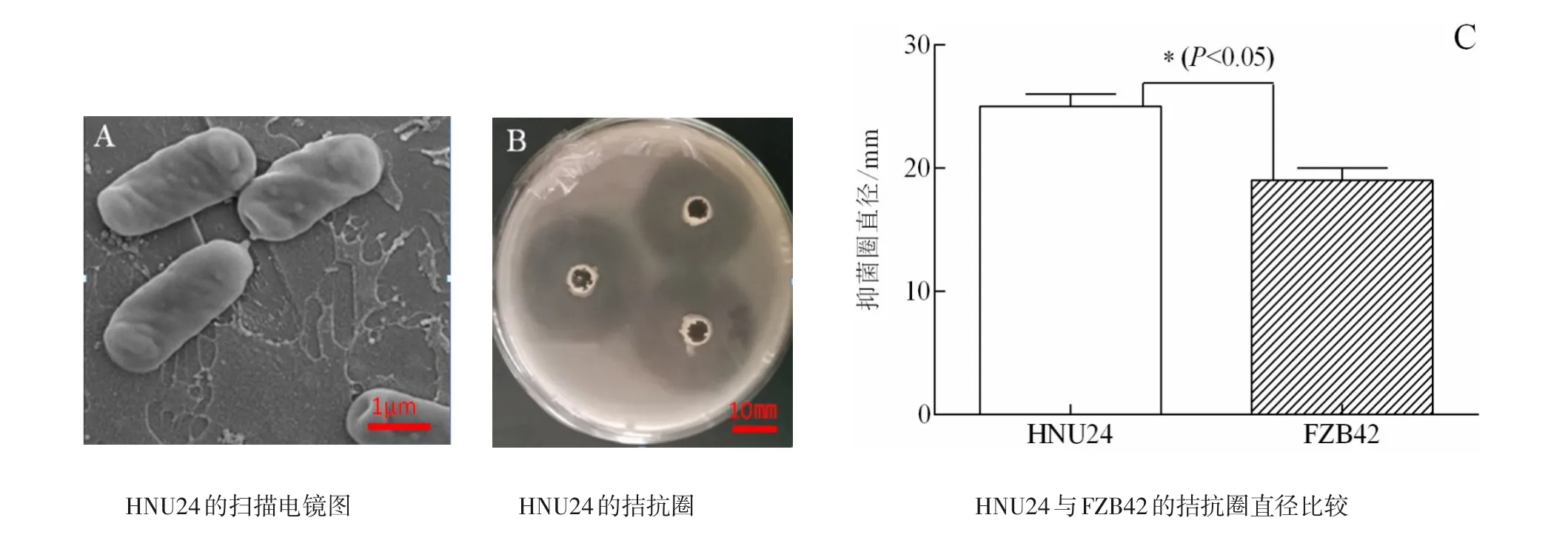
图1 贝莱斯芽孢杆菌HNU24的平板对峙实验和形态特征Figure 1 Plate confrontation experiment and morphological characteristics of the Bacillus velezensis strain HNU24
2.2 平板对峙实验
以强致病力茄雷尔氏菌EP1菌株为指示菌,用已报道的对茄雷尔氏菌具有较强拮抗活性的贝莱斯芽孢杆菌FZB42作对照,对贝莱斯芽孢杆菌HNU24对茄雷尔氏菌EP1的拮抗作用进行研究。结果发现,HNU24周围可以产生较大的透明圈,其抑菌圈直径可达25 mm(图1B),表明HNU24对EP1具有较强的拮抗效果,且HNU24对EP1的拮抗效果优于FZB42(图1C)。
2.3 EP1和HNU24共培养实验
通过稀释涂板法测定单一培养MP(A)、MP(B)和共培养CP(A+B)48 h 培养液中的菌落生长状况。在MP(A)和MP(B)中,EP1、HNU24的菌落数目均逐渐增加。在CP(A+B)中,菌株EP1的菌落数在0~24 h内逐渐增多,但24~48 h逐渐减少并在48 h时未检测到EP1,而菌株HNU24的菌落数则一直增长且和MP(A)的生长趋势接近,说明CP(A+B)后期HNU24增殖的同时显著抑制了茄雷尔氏菌EP1的生长(图2)。为进一步验证HNU24的活性代谢产物是否抑制茄雷尔氏菌生长,本研究对HNU24发酵液的乙酸乙酯萃取物进行了活性检测。结果表明,萃取物中含有可以拮抗茄雷尔氏菌的活性物质(图3)。

图2 茄雷尔氏菌EP1与贝莱斯芽孢杆菌HNU24的共培养和单独培养菌落数量变化Figure 2 Changes of colony number in single culture and co-culture of R.solanacearum and the Bacillus velezensis strain HNU24

图3 贝莱斯芽孢杆菌HNU24发酵液的乙酸乙酯萃取物对茄雷尔氏菌EP1的拮抗活性检测Figure 3 Antagonistic activity of the B.velezensis HNU24 ethyl acetate extract to R.so⁃lanacearum EP1
2.4 HNU24的生防实验
生防实验中,第12 d 番茄植株的发病情况见表1,仅接种EP1 的植株发病率为82%;同时接种EP1 和FZB42 的植株发病率为63%;同时接种EP1 和HNU24 的植株发病率为39%,且接种后第17 d 才表现出萎蔫症状,发病时间明显推迟。结果表明,贝莱斯芽孢杆菌HNU24可明显降低番茄植株青枯病的发病率,推迟发病时间,拮抗效果优于FZB42。

表1 生防实验统计Table 1 Biocontrol experiment statistics
2.5 HNU24的促生长实验
促生长实验表明,HNU24对番茄幼苗具有明显的促生长作用,结果见表2。通过HNU24菌液叶面喷洒和灌根2种方式处理的番茄幼苗经过21 d温室培养(25 ℃)后,其株高、茎粗、鲜重和根系长度等各项指标都显著高于CK-A和CK-B处理。其中,HNU24菌液喷洒处理(HNU24-A)番茄幼苗21 d后的株高、茎围、鲜重、根系长度分别是CK-A处理的1.26倍、1.25倍、1.46倍和1.09倍;HNU24菌液灌根处理(HNU24-B)番茄幼苗21 d后的株高、茎围、鲜重、根系长度分别是CK-B处理的1.20倍、1.09倍、1.39倍和1.18倍。可见,灌根和叶面喷施HNU24菌株均可以有效促进番茄幼苗的生长。
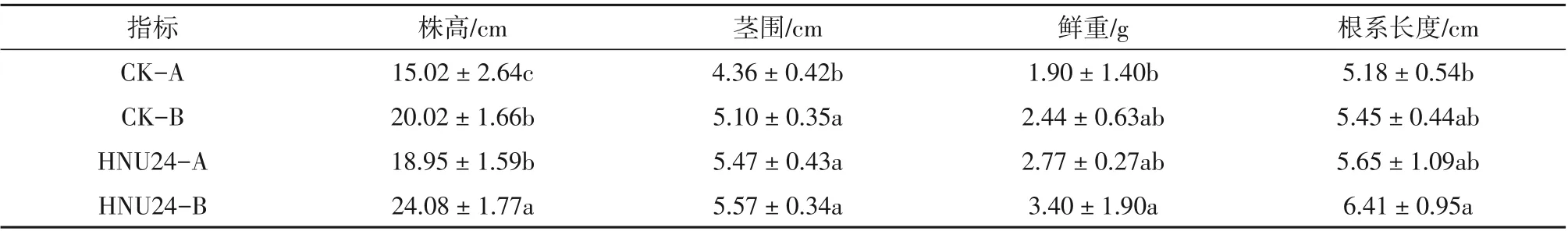
表2 贝莱斯芽孢杆菌HNU24对番茄幼苗的促生长效果Table 2 Growth promotion effect of the B.velezensis strain HNU24 on tomato seedlings
2.6 HNU24定殖能力的探究
贝莱斯芽孢杆菌HNU24定殖能力研究结果见图4。番茄植株在接种HNU24 后7、14、21 和28 d 仍可以在番茄植株根部和茎部分离得到HNU24(具有利福平抗性,30µg/mL),且分离到的菌落形态和HNU24纯培养的菌落形态一致,表明HNU24 在番茄植株根部和茎部都可以稳定定殖。从番茄植株根部分离出的HNU24菌落数明显多于番茄植株茎部,说明HNU24主要存在于番茄植株的根部,其在根部定殖后可以转移到番茄茎部。

图4 贝莱斯芽孢杆菌HNU24在番茄根部和茎部的定殖实验Figure 4 Colonization experiment of the Bacillus velezensis HNU24 on tomato roots and stems
3 讨论
芽孢杆菌能产生多种拮抗活性物质和抗逆性强的芽孢并易于在植物根际定殖,已成为国内外生防微生物研究的热点[11]。本研究从健康樱桃番茄植株的砧木根际分离到贝莱斯芽孢杆菌HNU24菌株。贝莱斯芽孢杆菌是芽孢杆菌属的一种功能性菌种,对农作物致病菌具有广谱的抗菌活性[12],对棉花黄萎病病原菌大丽轮枝杆菌(Verticillium dahliaekleb)、白菜黑斑病致病菌(Alternaria brassicae)、番茄灰霉病灰葡萄孢菌(Botrytis cinerea)、稻瘟病菌(Pyricularia grisea(Cooke)Sacc)、黑腐菌(Thielaviopsis)等植物病害均有一定的拮抗作用[13-16]。分离于黄瓜根际土的B.velezensisSQR9菌株是一种广谱拮抗菌,在农业生产中可作为生物肥料和生物防治剂,能够形成强健的生物膜,具有突出的根系定殖力,可有效促进植物生长和抑制土传病害[17]。
本研究结果表明,贝莱斯芽孢杆菌HNU24菌株对茄雷尔氏菌具有拮抗作用,具有防治茄科作物青枯病的潜力,且与国际公认具有良好拮抗效果的同属芽孢杆菌的FZB42菌株相比效果更好。在共培养实验中,HNU24的菌落数和茄雷尔氏菌EP1负相关,在2 d左右HNU24可以将EP1控制在较低水平。HNU24发酵液粗提物表现出较强的抑菌活性,证明HNU24产生的活性物质可以有效地抑制茄雷尔氏菌的生长,活性物质的产生使HNU24在HNU24和EP1共培养的过程中具有生存优势,从而抑制或杀灭共培养液中的茄雷尔氏菌。大量研究已表明,芽孢菌具有产生多种次级代谢产物的能力,如surfactin、fengycin、bacilysin、bacillaene、macrolactin和difficidin等,且这些产物往往对一些病原真菌和细菌具有较好的抑菌活性。本研究中,HNU24的发酵液粗提物具有较强的拮抗活性,说明该菌株具有一定的开发应用潜力。
实验发现,同时接种茄雷尔氏菌EP1和贝莱斯芽孢杆菌HNU24的番茄植株青枯病发病时间明显延后,且发病率从82%降到39%,表明HNU24对茄雷尔氏菌引起的番茄青枯病具有良好的防治效果。本研究结果还证明HNU24在番茄植株根部的定殖能力较强,而且对海南高温环境的适应性良好。由于茄雷尔氏菌往往是从根部侵染,且HNU24可以在根部很好地定殖,因此在种植番茄时进行蘸根或灌根处理可以在其根部形成有效的生物屏障,从而阻止茄雷尔氏菌的侵入。本研究在番茄的茎部也分离到HNU24菌株,证明HNU24菌株可以从根部转移到茎部,从而更加有效地防止病原菌的入侵。Luisa等研究发现芽孢杆菌EA-CB0575在香蕉和番茄根际有效定殖的同时还表现出一定的促生长作用[18]。Priyanka等获得的芽孢杆菌MT7菌株同样具有显著促进植物生长的作用[19]。MENG 等的实验结果表明,来源于马铃薯疥疮病抑菌型土壤的B.velezensis BAC03菌株具有ACC脱氨酶活性和分泌IAA的能力,对甜菜、胡萝卜、黄瓜、胡椒、马铃薯、萝卜、南瓜、番茄和萝卜等9种作物都具有一定的促生长作用[20-22]。本研究利用贝莱斯芽孢杆菌HNU24菌悬液通过喷洒和灌根2种方式处理番茄幼苗后,番茄幼苗的株高、茎粗、鲜重和根系长度等各项指标与对照组相比都表现出不同程度的增加,叶面喷施的处理方式具有较好的促生长效果,操作简便,易于相关产品的推广。

