五味子多糖的分离、纯化及结构表征*
张红梅,李方怿,赵春霞,王春华,颜晓晖,余河水,李正
(1.天津中医药大学中药制药工程学院,天津 301617;2.省部共建组分中药国家重点实验室,天津 301617)
五味子为木兰科植物五味子[Schisandrachinensis(Turcz.)Baill.]的干燥成熟果实。最早列于《神农本草经》上品中药,具有抗氧化、抗肿瘤、保肝、免疫调节等药理作用[1-3]。子味子作为一种传统中药,也是经典方剂生脉散和现代制剂生脉注射液的主要组成药物,其主要化学成分包括木脂素类[4]、挥发油[5]、多糖及有机酸类[6-7]等。
多糖是五味子的重要组成成分,与其生物活性密切相关。现代药理研究表明,五味子多糖具有调节免疫、抗癌、抗氧化等多种药理活性[8],且对机体几乎无毒副作用,具有高效低毒的特点[9]。因此,本实验对五味子多糖进行分离纯化,综合运用现代仪器分析技术系统和全面的研究五味子多糖的分子量、单糖组成等结构特征,以期为五味子多糖的进一步研究及开发利用提供一定借鉴与参考。
1 材料
1.1 药材 五味子(批号:17110604)由苏中药业集团股份有限公司提供,经天津中医药大学王春华副研究员鉴定为木兰科植物五味子[Schisandra chinensis(Turcz.)Baill.]的干燥成熟果实。
1.2 试剂 D-甘露糖(批号:C16J8H28561,含量≥98%)、鼠李糖(批号:SA0411GA13,含量≥98%)、D-半乳糖(批号:Z22J9H64187,含量≥98%)、D-无水葡萄糖(批号:S10S9I69833,含量≥98%)、L-阿拉伯糖(批号:T05J6C1,含量≥98%)、D-木糖(批号:B02M6W1,含量≥99%)、D-葡萄糖醛酸(批号:K14J7S9017,含量≥98%)、D-半乳糖醛酸(批号:K02A9B66077,含量≥98%)购于上海源叶生物科技有限公司;甲醇(色谱纯)、乙腈(色谱纯)购于美国Fisher公司;葡聚糖凝胶G-150、乙酸铵购于北京索莱宝科技有限公司;乙酸钠购于上海阿拉丁生化科技有限公司;重蒸酚购于北京鼎国昌盛生物科技有限责任公司;溴化钾(KBr)购于国际晶体实验室;氘代水(D2O)购于青岛艾弗斯特科贸有限公司;氢氧化钠(NaOH)购于天津市津科精细化工研究所;盐酸(HCl)购于天津市大茂化学试剂厂;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)购于上海源叶生物科技有限公司。
1.3 仪器 LC-20AD型高效液相色谱仪、RID-20A示差检测器、傅里叶变换红外光谱仪(日本岛津公司);DAWN 8型多角度激光光散射仪(美国怀雅特技术公司);ACQUITY Arc液相色谱仪、2998型二极管阵列检测器(美国Waters公司);FDU-2110型冷冻干燥机(东京理化EYELA公司);AB135-S型电子分析天平[十万分之一,梅特勒-托利多仪器(上海)有限公司];KQ2200DB型超声波清洗器(昆山超声仪器有限公司);AVANCE III 400 MHz全数字化核磁共振谱仪(瑞士Bruker公司)。
2 方法
2.1 粗多糖的提取及分级醇沉 称取130 g脱脂后的干燥的五味子,加入10倍量的纯水,提取3次,每次3 h,合并提取液,减压浓缩。采用Sevage法脱蛋白,直到在260 nm和280 nm波长下没有紫外吸收峰后,加入3倍体积的95%乙醇,置于4℃静置过夜,离心得到多糖沉淀,冷冻干燥得五味子粗多糖。
称取5.0 g五味子粗多糖,加入500 mL纯水搅拌16 h,使其充分溶胀,加入95%乙醇,使溶液中乙醇浓度依次达到20%、40%、60%、80%分别收集沉淀,沉淀依次用无水乙醇、丙酮、乙醚洗涤3次,冷冻干燥得级分 1(SCP-1)、级分 2(SCP-2)、级分 3(SCP-3)和级分 4(SCP-4)。
2.2 多糖的分离纯化 称取SCP-3配成1%的多糖溶液,使其充分溶胀,调节pH值为4.0,加入1.5%活性炭脱色[10],抽滤去除活性炭,透析48 h,冷冻干燥。取冻干的多糖200 mg加入10 mL纯水溶解,采用葡聚糖凝胶G-150进一步分离纯化,洗脱剂为 0.1 mol/L NaCl,流速为 0.3 mL/min,每 15 min收集1管,采用苯酚-硫酸法检测收集液,绘制检测曲线。根据检测曲线收集主峰部分进行合并,合并后的多糖溶液采用3000 kD透析袋透析脱盐,冷冻干燥,得五味子多糖组分SCP-3-1,备用。
2.3 SCP-3-1的含量测定
2.3.1 标准曲线的绘制 称取干燥至恒质量(105℃)的葡萄糖5.03 mg,置于50 mL容量瓶中,配制成葡萄糖标准溶液。分别精密移取葡萄糖标准溶液0.2、0.4、0.6、0.8、0.9、1.0 mL 于 6 个试管中,精密补水至1.0 mL,分别加入6%苯酚溶液1.0 mL,迅速加入浓硫酸5.0 mL,剧烈振摇,沸水浴10 min后,冰水浴至室温,490 nm处测得吸光度。以吸光度(Y)对葡萄糖浓度(X)进行线性拟合,得到线性方程[11]。
2.3.2 多糖的含量测定 称取2.98mgSCP-1、2.54mg SCP-2、2.55 mg SCP-3、2.53 mg SCP-4 和 2.50 mg SCP-3-1,分别置于5.0 mL容量瓶中定容,各取0.1 mL置于试管中,补水至1.0 mL,分别加入6%苯酚溶液1.0 mL,迅速加入浓硫酸5.0 mL,剧烈振摇,沸水浴10 min后,冰水浴至室温,490 nm处测得吸光度。根据下列公式计算多糖含量[12-15]。

式中:C为样品溶液中葡萄糖的浓度,V为样品溶液的体积,0.9为换算因子,W为样品的质量(mg)。
在小范围班级试点生物化学实验教改课题[8-9]之后,笔者确定了综合性实验教学内容,包括酪蛋白的提取、纯化、含量测定和分子量的测定等四次蛋白质的实验,质粒DNA的提取及琼脂糖凝胶电泳两次核酸实验,通过综合性实验的训练,学生基本能掌握生物大分子的分离提取和检测流程。
2.4 SCP-3-1的结构表征
2.4.1 分子量及其分布的测定 称取SCP-3-1适量加入流动相配制成浓度为2.0 mg/mL的多糖溶液,0.22 μm微孔滤膜滤过,取续滤液即得样品。采用高效分子排阻色谱法测定其纯度和分子量[16]。色谱条件为:色谱柱:TSKgel GMPWxl凝胶色谱柱(7.8 mm l.D.×30 cm,13 μm);流动相:0.003 mol/L 乙酸钠溶液;流速:0.8 mL/min进行等度洗脱;进样量:100 μL;柱温:40℃;使用 MALLS-RID 检测多糖,Astra 6软件收集及处理数据。
2.4.2 单糖组成分析
2.4.2.1 多糖的水解 将SCP-3-1样品置于具塞试管中,用2.0 mol/L三氟乙酸(TFA)进行完全酸水解(m多糖∶vTFA=2∶1),沸水浴水解 6 h,取出放至室温,用甲醇反复浓缩蒸除TFA,最后用双蒸水溶解,得多糖水解液。
2.4.2.2 衍生化产物的制备 称取D-甘露糖1.53mg、鼠李糖1.10 mg、D-半乳糖 1.50 mg、D-无水葡萄糖1.51 mg、L-阿拉伯糖 1.54 mg、D-木糖 1.50 mg、D-葡萄糖醛酸1.46 mg、D-半乳糖醛酸1.53 mg置于10 mL容量瓶,纯水定容,作为混合对照品溶液。分别取混合对照品溶液和多糖水解液200 μL,加入200 μL的 0.5 mol/L的 PMP-甲醇溶液和 200 μL的0.3 mol/L的NaOH溶液,70℃衍生化30 min,冷却至室温,加入200 μL的0.3 mol/L的HCl溶液,混匀,加入1.0 mL氯仿萃取,去除多余的PMP试剂,重复3次,8 000 r/min离心 10 min,离心半径 6.0 cm,取上清液进样测定。
2.4.2.3 色谱条件 色谱柱:Kromasil 100-5-C18(4.6 mm×250 mm,5 μm);流动相:0.1 mol/L 乙酸铵水溶液-乙腈(84∶16);柱温:35 ℃;检测波长:250 nm;流速:1.0 mL/min;进样量:20 μL。
2.4.3 红外光谱分析 称取1.50 mg SCP-3-1样品,加入150 mg干燥的KBr粉末置于玛瑙研钵中研磨均匀后压片。采用傅里叶变换红外光谱仪扫描,扫描波数范围为4 000~400 cm-1。
3 结果
3.1 粗多糖的分级醇沉结果 采用水提醇沉法提取得到五味子粗多糖,通过加入95%乙醇使五味子多糖溶液达到20%、40%、60%、80%的乙醇浓度,分级醇沉得到 SCP-1、SCP-2、SCP-3 和 SCP-4,见表1。
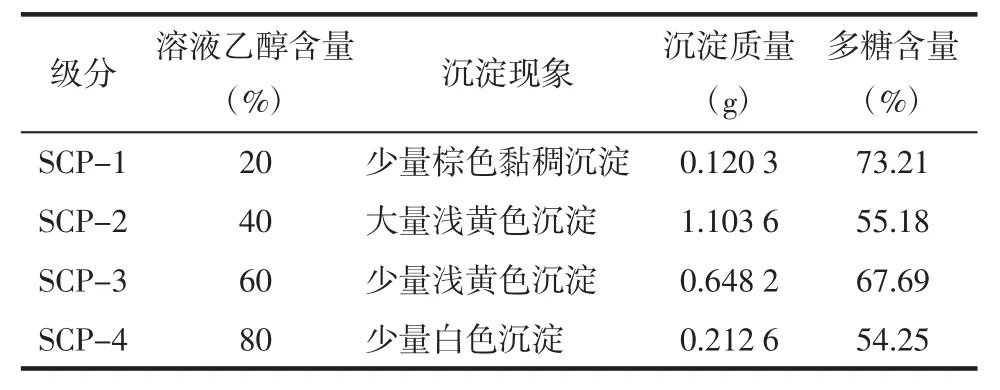
表1 不同级分的五味子多糖Tab.1 Different fractions of polysaccharide from Schisandra chinensis
3.2 多糖的分离纯化结果 SCP-3经葡聚糖凝胶柱进一步分离,以0.1 mol/L的NaCl为洗脱剂,洗脱得到纯度较高的五味子多糖。采用苯酚-硫酸法检测收集液,绘制洗脱曲线(图1),根据洗脱曲线收集主峰部分进行合并,合并后的多糖溶液采用3 000 kDa透析袋透析脱盐,冷冻干燥得SCP-3-1。
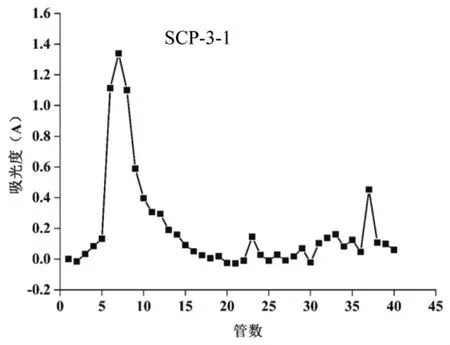
图1 SCP-3洗脱曲线Fig.1 Elution profile of SCP-3
3.3 SCP-3-1的含量测定结果 采用苯酚-硫酸法对得到的SCP-3-1的多糖含量进行测定,首先用不同浓度的葡萄糖标准溶液建立标准曲线,以吸光度为纵坐标(Y)、葡萄糖浓度为横坐标(X)进行线性拟合,得到线性方程Y=10.027 37X+0.013 89,R2=0.994 08。根据标准曲线计算出SCP-3-1的多糖含量为74.28%。
3.4 SCP-3-1的结构表征
3.4.1 分子量及其分布测定结果 采用HPSECMALLS-RID法测定多糖,Astra 6软件收集及处理数据,得到SCP-3-1的分子量为84.9 kDa,多分散指数为1.207,SCP-3-1的多分散指数接近于1且峰型为单一对称峰,说明SCP-3-1的纯度较高。见图2、表2。
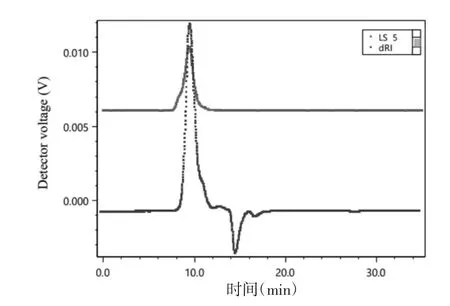
图2 SCP-3-1示差及多角度激光光散射色谱图Fig.2 Chromatograms of SCP-3-1 using MALLS-RID
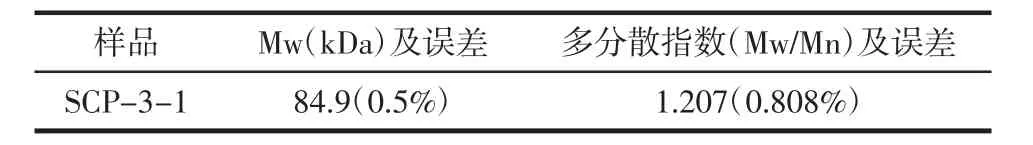
表2 SCP-3-1分子量及分子量分布测定结果Tab.2 Results of molecular weight and molecular weight distribution of SCP-3-1
3.4.2 单糖组成分析结果 采用PMP柱前衍生化HPLC法测定五味子多糖的单糖组成,TFA将多糖水解为单糖,PMP对单糖衍生化处理后,采用二极管阵列检测器检测,得到多糖的单糖组成及其摩尔比(图3)。结果表明,SCP-3-1主要由甘露糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖(摩尔比为0.09∶0.19∶19.82∶2.08∶0.13)组成。

图3 混合对照品、SCP-3-1的HPLC色谱图Fig.3 HPLC chromatograms of standard monosaccharides and acidolysis products of SCP-3-1
3.4.3 红外光谱结果 分析结果见图4。SCP-3-1具有多糖特征吸收峰,3 383 cm-1为多糖分子间或分子内氢键O-H伸缩振动的强且宽的吸收峰[17],2 927 cm-1为甲基和次甲基的C-H伸缩振动的吸收峰,1 740 cm-1处的吸收峰为酯键的特征吸收峰,说明有一部分的半乳糖醛酸是以内酯的形式存在的。1 622 cm-1为羰基的C=O伸缩振动形成的吸收峰,1 417 cm-1为C-H的变形振动的吸收峰,1 400~1 200 cm-1为C-H的变角振动,和C-H的伸缩振动构成了糖环的特征吸收,SCP-3-1在1 022、1 080和1 153 cm-1处为3个吸收峰,说明其糖环构型为吡喃型,848 cm-1处的吸收峰表明SCP-3-1含有α-吡喃糖苷键[18-20]。

图4 SCP-3-1红外光谱图Fig.4 IR spectrum of SCP-3-1
3.4.4 核磁共振波谱分析结果1H-NMR主要用于判断多糖的糖苷键构型,多糖的C1上的1H-NMR信号出现在δ 5.5~4.8 ppm,C2-C6的1H-NMR信号出现在δ 4.8~4.0 ppm,此处信号堆积严重,难以解析。通常,α构型的吡喃糖其C1上的1H-NMR信号化学位移值大于5.0 ppm,β构型的则小于5.0 ppm。13C-NMR的范围较广,通常在δ 110~96 ppm处为糖端基碳信号,其他化学位移为非端基碳信号。未发生取代的 C2、C3、C4、C5 信号通常在 δ 78~70 ppm,发生取代后在δ 85~78 ppm。未发生取代的C6信号通常在 δ 64~60 ppm,取代后在 δ 70~67 ppm[18,20-21]。
SCP-3-1的1H-NMR谱如图5所示,结果表明,δ 5.43 ppm和δ 5.42 ppm为糖端基C1的质子信号,δ 4.7~3.6 ppm为非端基质子信号,δ 3.80处的强信号含有半乳糖醛酸的甲氧酯基的甲基质子信号。化学位移δ 5.43 ppm、δ 5.42 ppm大于5.0 ppm,表明其构型为α构型,说明级分SCP-3-1的单糖是以α-糖苷键连接的。
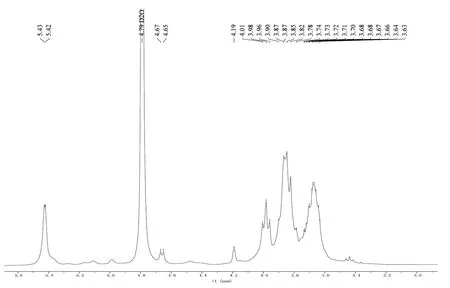
图5 SCP-3-1的1H-NMR谱Fig.5 The1H-NMR spectrum of SCP-3-1
SCP-3-1的13C-NMR谱如图6所示,结果表明,δ104.4ppm、δ99.7 ppm为异头碳的信号,δ77~70ppm为未发生取代的 C2、C3、C4、C5 的信号,δ 60.8 ppm、δ 60.5 ppm为未取代的C6的信号。

图6 SCP-3-1的13C-NMR谱Fig.6 The13C-NMR spectrum of SCP-3-1
SCP-3-1的DEPT-135谱如图7所示,δ 60.3ppm、δ 60.4 ppm和δ 60.7 ppm可能为吡喃糖6位的碳信号,且谱图中在δ84~82ppm处没有碳的共振吸收峰,表明该多糖不含有呋喃糖环。
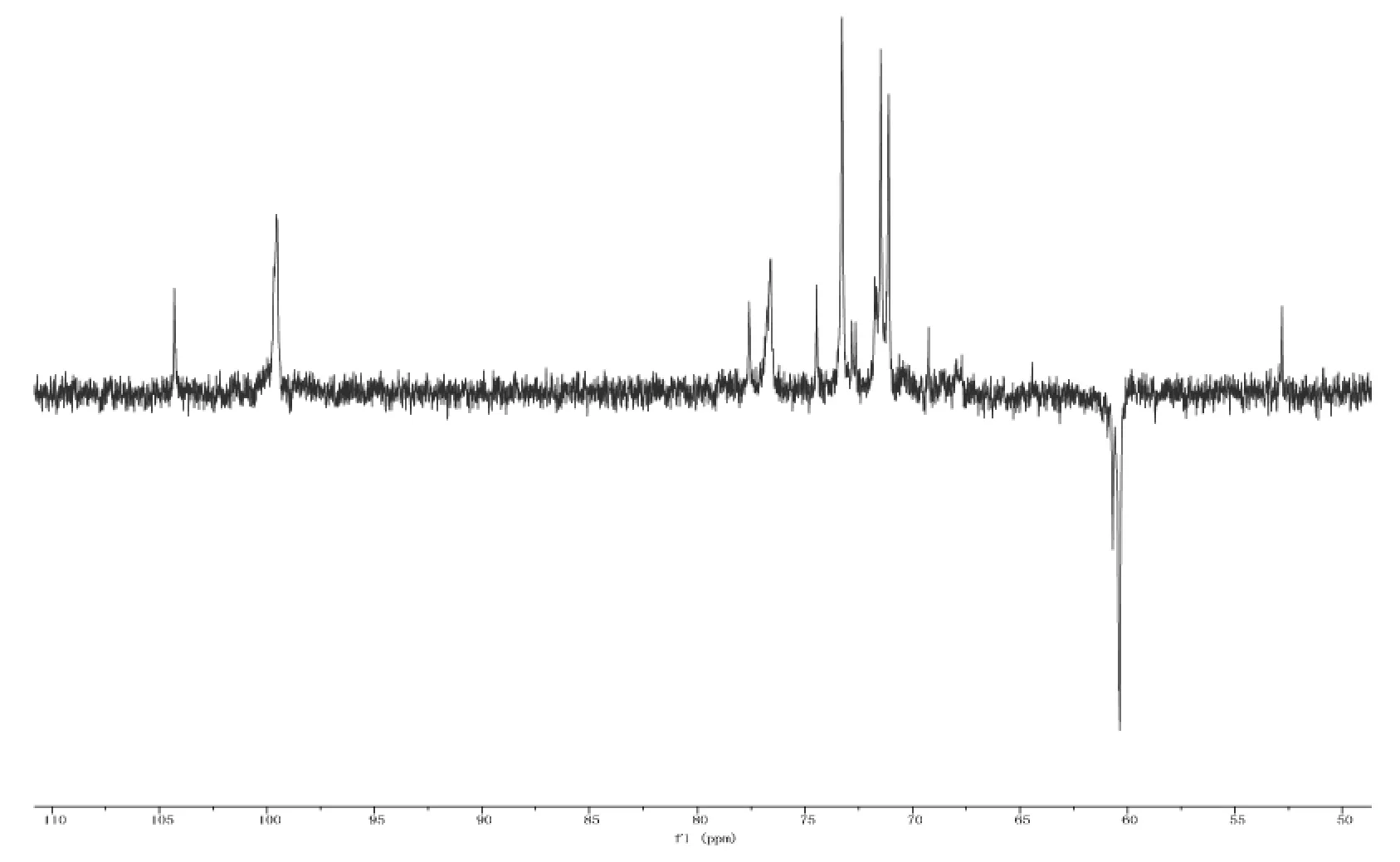
图7 SCP-3-1的DEPT-135谱Fig.7 The DEPT-135 spectrum of SCP-3-1
4 结论
多糖的分离纯化是对其结构表征的基础。从天然产物提取的粗多糖通常含有蛋白质、色素等杂质,因此,本实验通过水提醇沉法得到五味子粗多糖,分级醇沉、脱蛋白、脱色及葡聚糖凝胶G-150进一步分离纯化得五味子多糖组分SCP-3-1。经鉴定SCP-3-1是纯度较高的相对分子质量为84.9 kDa的吡喃型多糖,主要由甘露糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成。
五味子多糖是五味子的重要活性成分,也是中药的重要功效成分之一,具有多种生理活性功能。且其功能活性与相对分子质量及其分布、单糖组成等结构特征密切相关[22]。而本研究通过对五味子多糖的结构表征,为五味子药材的综合开发利用及进一步解析多糖的构效关系提供一定理论参考。