肝脏原发性癌肉瘤6例诊疗特点分析
徐海 卢起林 王代忠 陈新河
肝脏原发性癌肉瘤(primary hepatic carcinosarcoma,PHCS)是一种罕见的恶性肿瘤,2000年,WHO将肝癌肉瘤定义为一种包含恶性上皮成分和间叶性肉瘤成分的肝脏恶性肿瘤。该肿瘤临床诊断困难,侵袭性强,预后差,早期转移发生率高,诊断时常为晚期,现将6例PHCS病例特征分析如下。
资料与方法
一、病史特点
回顾性收集2014年9月至 2020年9月期间于湖北医药学院附属太和医院经病理确诊的原发肝癌肉瘤患者共6例,男性4例,女性2例,发病年龄为52~68岁,中位年龄58.5岁。5例感染乙肝,4例有乙肝肝硬化。病灶位于肝左叶2例,肝右叶4例。平均肿瘤长径8.5 cm(3.8 cm~15.0 cm)。6例患者除1例无明显症状外,其余5例患者均有不同程度上腹胀或痛。
二、实验室检查、CT及MRI影像表现
所有患者肝功能均正常;关于肿瘤标志物(CA125、CA199、AFP),2例患者均正常,1例患者CA199显著升高,1例患者AFP显著升高,其余患者升高不明显。5例患者行CT检查,2例患者行MRI检查,肿瘤平均长径为8.5 cm;CT平扫呈低密度,MRI:T1呈低信号,T2呈稍高信号,DWI呈明显高信号;增强扫描CT与MRI表现基本相同:4例患者表现为动脉期轻度强化,门脉期及延迟期呈低密度或低信号。另外2例患者则表现为边缘向中心逐渐填充强化、门静脉期和延迟期肿瘤实质呈稍低密度或稍低信号。患者实验室检查及影像资料见表1和典型影像图像见图1。
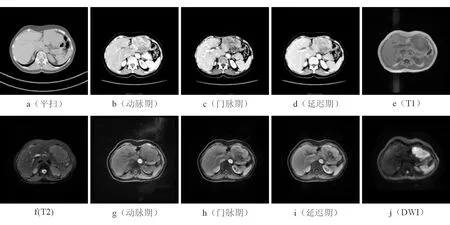
图1a-1d:CT平扫肿瘤呈低密度,增强扫描呈边缘向中心逐渐填充强化、门静脉期和延迟期肿瘤实质呈稍低密度;图1e-1j:MRI:T1呈低信号为主的混杂信号,T2呈稍高信号为主的混杂信号,增强扫描呈边缘向中心逐渐填充强化、门静脉期和延迟期肿瘤实质呈稍低信号,DWI呈明显高信号。
三、病理特征
大体标本:3例肿瘤切面呈灰白实性,其余分别呈灰红灰白实性、灰白灰黄灰红实性、灰黄灰红实性,质地中或韧。HE染色:镜下可见恶性上皮成分及恶性间叶成分,两者之间相互独立,无移行,瘤细胞呈梭形或卵圆形,胞浆少,异型性显著,核分裂像易见,局灶可见瘤巨细胞、假腺样结构,大部分区域多角形卵圆核瘤细胞呈实性片巢状或假腺样排列,部分区域瘤细胞少胞浆形态幼稚的裸核样片中密集排列伴片状坏死。免疫组化:所有患者Vimentin(肉瘤+),4例患者CKP(癌+),5例患者CK8(+),1例患者SMA(+),4例患者Ki-67(+)。其中病例5为二次手术二次病理检查,第一次病理诊断为中分化肝细胞癌,第二次病理诊断为PHCS。病理图见图2。
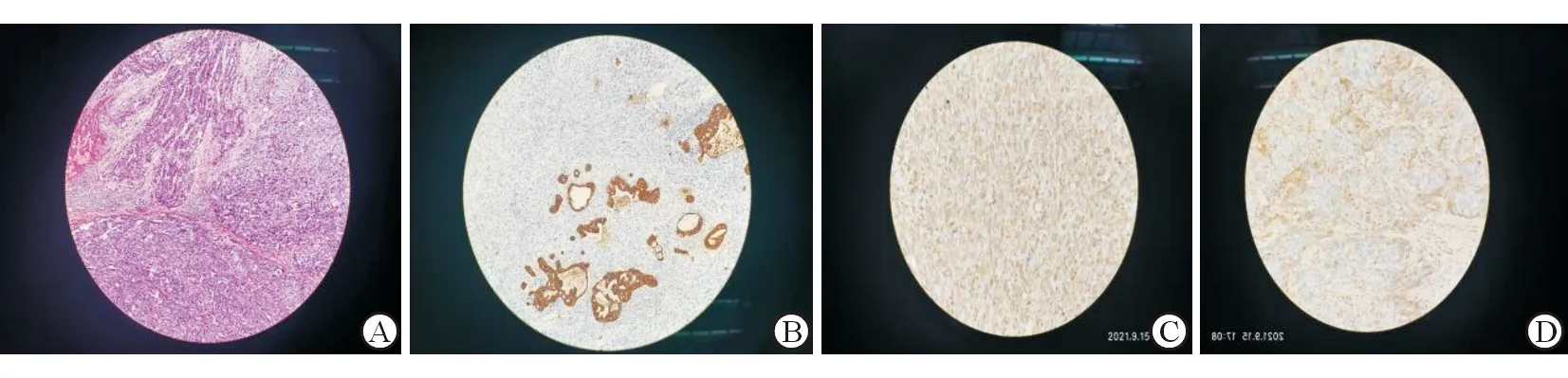
图2a HE×100 左上部分为癌区域:瘤细胞呈梭形或卵圆形,胞浆少,异型性显著,核分裂像易见,局灶可见瘤巨细胞,部分区坏死,其余部分为肉瘤区域:多角形卵圆核瘤细胞呈实性片巢状或假腺样排列,部分区域瘤细胞少胞浆形态幼稚的裸核样片中密集排列伴片状坏死。癌区域与肉瘤区域相互独立,无移行。2b: CKP(+)(癌+)×100,灶形表达。2c:Vimentin(肉瘤+)×400,灶形表达。2d:Vimentin(癌-)×400,阴性。
结 果
一、诊治经过
所有患者均行外科手术;83.3%行放疗、化疗或靶向治疗。具体治疗措施:2例术前行TACE,1例术前有肝癌切除治疗史,4例术后行TACE,1例患者术后行TACE+放疗,1例患者术后行放化疗。
二、预后
采用电话随访所有患者,无失访者,随访截至 2021年 9月,随访 1.0~26.1个月。随访截止仅有一例存活,术后生存期为13.0个月,余患者其中4例存在肝、肺、腹膜、腹腔及腹膜后淋巴结不同程度的复发或转移,1例患者因未在我院定期复查所以复发转移情况不详,其中术后最长生存期为26.1个月。6例患者中位术后生存期为9.2个月。患者具体临床资料与结果见表2。

表1 患者实验室及影像辅助检查特点

表2 患者具体临床资料
讨 论
PHCS国内外文献以个例报道居多,本研究回顾分析PHCS例数仅占研究者所在单位确诊肝脏恶性肿瘤的病例(肝细胞癌、胆管细胞癌、肝肉瘤样癌、肝癌肉瘤、胚胎性肉瘤)总数的1.40%(6/429),确实较为罕见。6例PHCS患者中,男:女为2:1,中位年龄58.5岁,与Fengli Bin[1]报道的男性好发,发病均年龄为60.5岁,较为相符。本文患者多表现为消化道非特异症状(腹胀、腹痛)。所有患者几乎均为就诊过程中行腹部CT检查发现肝脏占位,其中1例就诊时已发现双肺散在转移结节,提示此病早期转移发生率高。因此,PHCS早期诊断率的关键在于:对于存在乙肝等慢性病毒性肝炎的高危发病对象,定期腹部影像学检查,及时发现占位。本组PHCS患者肝功能均无异常,提示PHCS以肿瘤细胞扩增和转移为主,对肝细胞破坏不严重;仅有1例患者AFP显著升高,1例CA199显著升高,说明本组病例PHCS恶性上皮成分来源成分较多,但也有研究报道PHCS患者的AFP升高居多,CA19-9和CA125升高较少[2],与本组病例肿瘤标志物表达不符合,需大样本病例进一步研究其肿瘤标志物表达规律;本文患者多患有乙肝或肝硬化,由此可见肝炎病毒感染是PHCS的高危因素。
PHCS常跨肝段生长, 体积较大,为不规则状肿块,边界模糊,可直接侵犯周围组织,肿瘤的中心部分常见坏死囊变区,CT平扫上肝癌肉瘤和肝细胞癌一样呈现低密度或混杂密度肿块影;但在增强CT上呈轻、中度强化或为边缘向中心逐渐填充强化、门静脉期和延迟期肿瘤实质呈稍低密度影[3-5],与肝细胞癌典型的“快进快出”的影像表现不同。MRI上肝癌肉瘤强化显著,信号不均匀,可伴周围有大小不等的多发囊变及囊内出血[6]。本组病例影像学诊断5例定性为肝细胞癌,1例定性为胆管细胞癌,与病理诊断不符合,提示影像学检查对于PHCS仅能定性肿瘤,对于确诊PHCS价值不大。本组PHCS大体标本为实性灰白或灰红实性肿块,质韧或质中;免疫组化提示癌与肉瘤的多种来源与成分,从而病理确诊为PHCS。完善的病理检查是确诊PHCS及提示患者与远期恶劣预后的主要手段,其中1例患者第1次手术病理确诊中分化肝细胞癌,但复发后第2次手术病理诊断为PHCS,其原因可能是肝癌细胞先转化为多潜能的未成熟细胞,再分化为肉瘤成分[8];但PHCS组织学起源和发生机制包括“碰撞学说”、“化生学说”、“全能干细胞学说”、“间质诱导学说”等多种学说[7],尚未完全明确。随访本组病例中已死亡5例,术后中位生存期为9.2月,预后差。PHCS易转移、复发,对放、化疗不敏感[11],早发现、早诊断、早手术是改善预后的关键,对于术后转移而不能手术根治切除的患者,可采用阿霉素和异环磷酰胺联合放化疗治疗可以延长某些患者的生存期[12]。
综上所述,PHCS临床较为罕见,起病隐匿,临床表现无特异性,大多数患者为上腹胀或痛,可能与肿瘤生长较大产生压迫症状有关,症状特异性差,早期诊断困难,侵袭性强,早期转移发生率高,预后极差。老年男性患者,存在有乙肝等慢性病毒性肝炎、肝硬化病史者为PHCS高危人群,需定期进行肝脏影像学检查早期发现占位病变,AFP、CA125、CA199升高时应增加肝脏影像学检查频率,提高早发现、早诊断率; CT增强扫描表现为动脉期呈轻、中度强化,延迟期呈低密度或向心性强化需注意PHCS可能,确诊需免疫组化病理检查。需注意的是,肝细胞癌可向PHCS转化,从而导致预后恶化。PHCS放化疗等治疗效果不佳,早发现、早诊断、早手术是改善预后的关键。

