CBDK加氢制备CBDO的动力学研究
尤文焘,杨 磊,王呈祥,潘 腾,成有为,李 希,
1.浙江大学化学工程与生物工程学院,浙江 杭州 310027;
2.浙江恒逸研究院,浙江 杭州 310019
2,2,4,4-四甲基-1,3-环丁二醇(CBDO,C8H16O2)是一种重要的脂肪类二醇聚酯单体,具有对称结构,有顺、反两种同分异构体,主要用于生产玻璃化温度高、透明度高和抗冲击强的高性能共聚酯产品,用以取代传统聚碳酸酯,因此成为近年来的研究重点[1-2]。由CBDO、对苯二甲酸和1,4-环己烷二甲醇共聚而成的高性能聚酯,不仅提高了聚酯材料的耐温性、柔韧性与透明度等多种性能,而且无需添加有毒物质[3],绿色环保,具有广阔的应用前景[4-5]。
异丁酸酐裂解工艺是极具工业生产优势的CBDO制备工艺:异丁酸酐首先裂解生成二甲基乙烯酮(DMK),DMK经过二聚得到2,2,4,4-四甲基-1,3-环丁二酮(CBDK),CBDK经过加氢反应生成产品CBDO。其中,CBDK加氢制备CBDO是整个工艺流程中的关键步骤。CBDK的加氢反应是气液固三相反应,固相催化剂的活性组分包括Ru,Cu,Co,Ni和Pd等,载体通常为SiO2、Al2O3或铝酸盐[6-8]。目前,CBDK加氢制备CBDO的研究主要集中在高效催化剂的筛选方面,采用负载Co型催化剂进行CBDK加氢反应,在适宜条件下能得到大于65%的CBDO选择性[9];在以硅藻土为载体,以Zr为助催化剂,Ni为活性中心的催化剂上进行的CBDK加氢实验中,副产品收率仅为2%[10];以氧化硅为载体,Co、Cs为助催化剂的Cu基催化剂在此反应中也能够得到顺反比为0.4~1.1的CBDO产品[11]。本研究组在前期工作中制备了Ru/C催化剂,在最优反应条件下CBDK转化率达到99.4%,CBDO收率达到99.2%[2,12];以Ru,Cu和Zn为负载金属的高效三金属负载型催化剂对CBDO的选择性达到99%以上[13];以Fe3O4为磁性核壳的磁性核壳催化剂在保证CBDO收率的前提下,还实现了浆态床反应器中催化剂的高效分离[14]。CBDK加氢反应的催化剂研究已经比较完善,但是仍然缺乏此反应的动力学方面的研究报道。
本工作将在搅拌釜氏反应器中研究Ru/C催化剂上的CBDK加氢反应机理及动力学,以期得到该反应的动力学模型及相关动力学参数,为工业反应器的设计和优化提供理论指导。
1 实验部分
1.1 催化剂制备
Ru/C催化剂的制备采用等体积浸渍法,理论负载量为5%(质量分数)。称取1.294 g无水RuCl3固体(Ru的质量分数为45%~55%)溶于15 mL去离子水中至完全溶解;然后将Ru溶液逐滴加入10 g粉末活性炭中,边滴边搅拌(Ru溶液全部滴加完毕,至活性炭刚好吸附饱和);将混合溶液室温下放置8 h,每隔1 h搅拌混合2 min;将混合液移至鼓风干燥箱于110 ℃下干燥10 h,即得Ru/C催化剂。
1.2 催化剂表征
Ru/C催化剂及其载体的比表面积、孔结构和孔体积等通过N2吸附-脱附仪(麦克ASAP,2010)测定。Ru/C催化剂的金属Ru实际负载量通过电感耦合等离子体发射光谱仪(ICP-OES,Agilent 725ES)测定。通过X-射线衍射仪(XRD,Rigaku D/Max 2550)确定载体和催化剂的晶体结构。采用高分辨透射电镜(HRTEM,Philips Tecnai F20)和场发射扫描电镜(SEM,Utral 55)分别观察金属Ru纳米颗粒粒径和催化剂的微观形貌。
1.3 催化剂评价
所制得的Ru/C催化剂在使用前需经过还原处理:将催化剂置于石英管固定床反应器中,以50 mL/min的流量通入H2/N2混合气(H2与N2体积比为30%),并以5 ℃/min升温到200 ℃后还原3h。2,2,4,4-四甲基-1,3-环丁二酮(CBDK)由异丁酸酐(IBAN)裂解制备,纯度≥98%。
Ru/C催化剂评价实验在500 mL微型高压反应釜中进行。反应装置配备电加热系统,内置冷却盘管降温及机械搅拌。实验采用半连续操作的方式,以乙酸丁酯为溶剂,每次将配制好的300 g CBDK溶液与催化剂一次性加入反应釜内,氮气由质量流量计精确控制进入反应釜内,压力由背压阀控制到指定压力。待反应釜内溶液温度预热到指定温度后,关闭氮气,通入氢气置换反应釜内的氮气,然后开启搅拌,控制搅拌转速为800 r/min,反应开始计时。每隔一定时间取样,使用Agilent气质联用仪5977B定性判断物质结构,使用岛津气相色谱GC-2030对样品进行定量分析。
2 动力学模型分析
在本研究的实验条件下,催化剂选择性很高,CBDK完全转化时,CBDO的选择性大于99%,实验观察到的副产物包括开环产物2,2,4-三甲基-1-羟基-3-戊酮(OPKO)及其加氢产物2,2,4-三甲基-1,3-戊二醇(TMPD),OPKO脱羟基产物2,2,4-三甲基-3-戊酮(TMPO)及其加氢产物2,2,4-三甲基-3-戊醇(TMPN)和2,2,3,4-四甲基环丁酮(TBDO),副产物收率小于1.0%。CBDK加氢主反应是典型的连串反应:CBDK先快速加氢生成CBKO,再进一步加氢生成CBDO产品;在主反应进行的同时还有少量副产物生成,见图1。
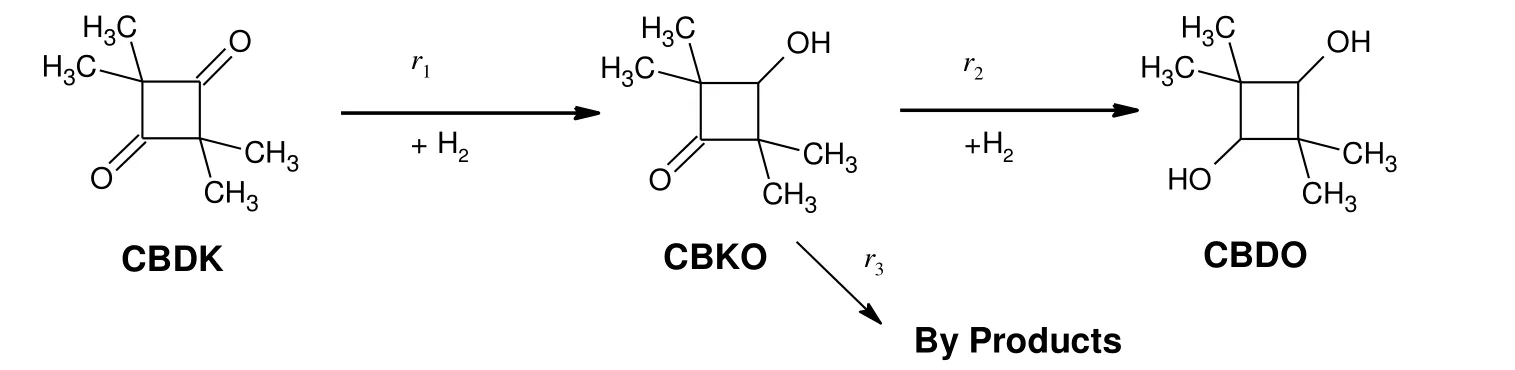
图1 CBDK加氢反应路径Fig.1 The reaction path of CBDK hydrogenation
采用Langmuir-Hinshelwood-Hougen-Watson(LHHW)型动力学模型,并假设:
(1)本研究实验条件下,只有一种反应机理起作用;
(2)在高搅拌速率条件下,液相中反应物是高度分散的,氢气在液相中是饱和的,饱和浓度符合亨利定律;
(3)催化剂只存在一种活性位点(参与反应的各组分竞争吸附,且符合理想吸附模型),溶剂乙酸丁酯的吸附可以忽略;
(4)氢气的吸附可以是解离或非解离的[15],表面加氢反应可以是单步加氢机理或两步加氢机理(Horiuti-Polanyi机理)[16];
(5)CBDK加氢反应是不可逆的(在实验条件范围内,均观察到反应的完全进行)。
基于以上假设,反应物CBDK、中间产物CBKO以及产品CBDO的平衡吸附以及速率可表示为:

氢气的解离吸附和非解离吸附及速率表示为:
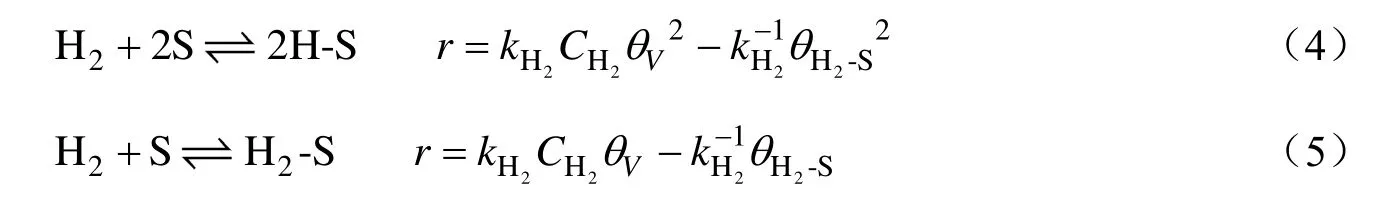
表面反应单步加氢反应机理:

表面反应两步加氢反应机理(Horiuti-Polanyi机理):
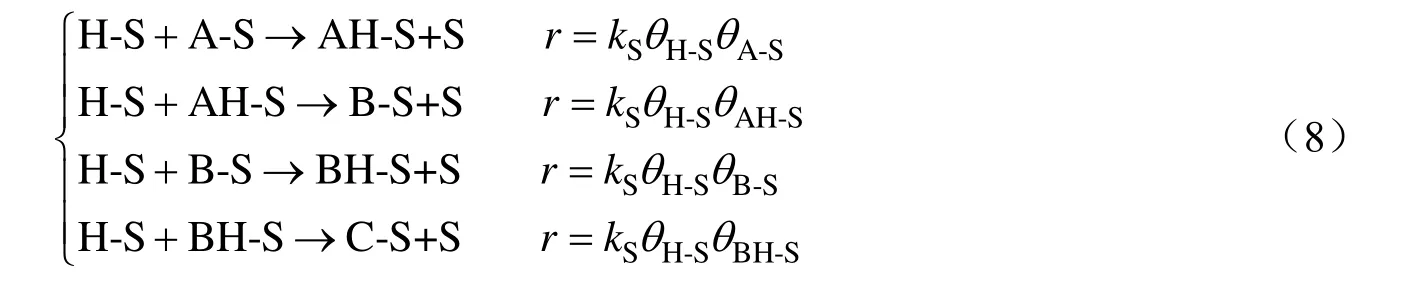
式中:S,θi和θV分别为吸附活性中心、i物质所覆盖的活性表面分率及活性表面未覆盖率;A,B,C和i-S分别为物质CBDK,CBKO,CBDO及吸附态物质i;k和k-1分别为吸附、脱附速率常数;r为反应速率。
3 结果与讨论
3.1 催化剂的表征结果
采用ICP-OES测定了制得的Ru/C催化剂的实际负载量,催化剂中Ru的质量分数为4.86%,表明浸渍法是有效的负载金属Ru的方法。采用多种表征手段对Ru/C催化剂进行了构效关系的研究,结果如图2所示。由图2(a)可知,Ru/C催化剂存在大量的介孔结构。活性炭载体比表面积为1 038.72 m2/g,孔体积为0.77 cm3/g,平均孔径为2.98 nm,而Ru/C催化剂比表面积为876.32 m2/g,孔体积为0.59 cm3/g,平均孔径为3.15 nm,说明金属Ru颗粒吸附在活性炭表面与孔道中,降低了比表面积和孔容[17]。
Ru/C催化剂微观形貌的观察结果如图2(b)所示。可见,Ru金属在活性炭表面呈现均匀分布,金属Ru颗粒的平均粒径约为2~3 nm,这有利于提高催化剂的加氢活性和选择性。图2(c)显示,活性炭载体和Ru/C催化剂均存在典型的介孔滞后回环,表明Ru金属的负载并没有破坏活性炭载体的介孔结构,而介孔的存在有利于减少催化剂内扩散,提高CBDK加氢速率,对CBDO选择性有利。此外,在图2(d)所示的Ru/C催化剂XRD表征图中,26.4°和42.2°附近出现碳物种短程有序的特征峰[18],表明了活性炭的结构在金属Ru的负载过程中得以保持。需要说明的是,金属Ru的特征峰并未检出,这主要是因为Ru颗粒在活性炭载体上高度分散和Ru纳米颗粒尺寸太小的原因[19]。
3.2 内外扩散消除实验
CBDK加氢反应是一种气液固三相反应,为了消除传质对反应的影响,实验首先探究了搅拌速度对加氢反应速率的影响。CBDK加氢主反应由两步加氢反应组成,分别是中间产物CBKO生成和消耗反应。图3展示了不同转速的实验条件下,中间产物CBKO的浓度随反应时间的变化曲线。结果显示,搅拌速度为800 r/min和1 000 r/min时,CBKO浓度的变化曲线几乎相同,可以认为此时反应已经排除了外扩散的影响,动力学实验采用的搅拌速度为800 r/min。
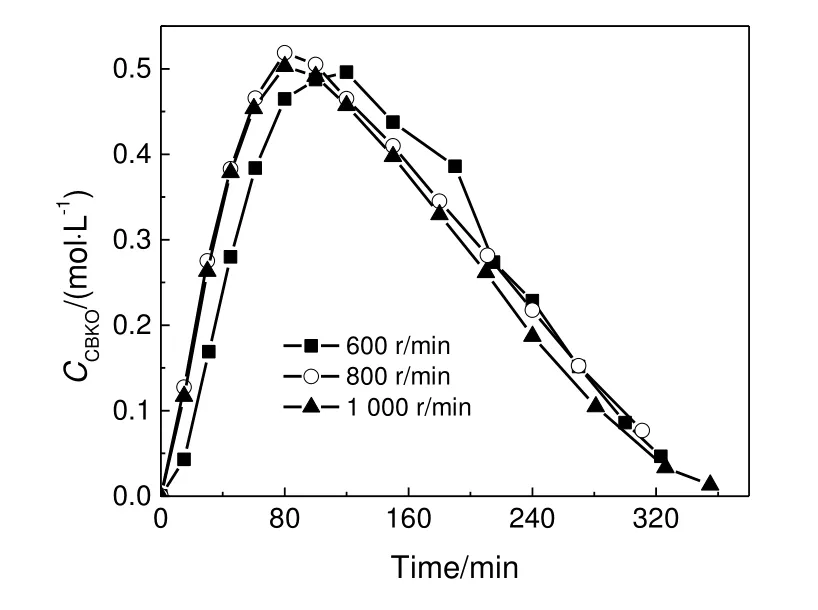
图3 搅拌速率对加氢反应影响Fig.3 Effect of stirring speed on hydrogenation reaction
采用表观反应速率计算Wheeler-Weisz模量:

式中:d为催化剂平均粒径,25 μm;Dp为有效扩散系数,8.05×10-10m2/s;ρc为催化剂颗粒密度,0.5 g/mL;robs为表观反应速率,mol/(L·s);Ci为物质i浓度,mol/L。ηφ2为可观测模量,在实验过程中,其值远小于1,可以认为反应无内扩散影响。
3.3 动力学模型
在搅拌速度为800 r/min、CBDK初始浓度为0.6 mol/L的条件下,实验考察了Ru/C催化剂催化CBDK加氢反应,得到了不同反应条件下反应产物浓度随时间的变化关系。对于CBDK加氢反应,通过假设不同的氢气吸附方式以及限速步骤(rate limiting step,RLS),如氢气吸附、反应物吸附以及表面化学反应,推导得到了不同形式的Langmuir-Hinshelwood-Hougen-Watson(LHHW)型动力学模型,结果见表1。其中,模型1~模型4分别由氢气吸附和反应物吸附为限速步骤推导得到;模型5~模型6根据表面化学反应单步加氢为限速步骤推导得到;模型7~模型8根据表面化学反应两步加氢(Horiuti-Polanyi机理)为限速步骤得到。采用表1的动力学模型对实验结果通过非线性方法回归偏差平方和(S)最小化的目标函数,求解模型参数。模型1~模型4的拟合不收敛,且模型的物理意义与实验结果相悖。以表面反应为限速步骤得到的模型5~模型8的最小偏差平方和也列于表1,其中模型5的最小化偏差平方和最小,拟合效果最优,表明CBDK加氢实验的限速步骤为表面化学反应,氢气以分子态吸附在活性位点,加氢机理为单步加氢。
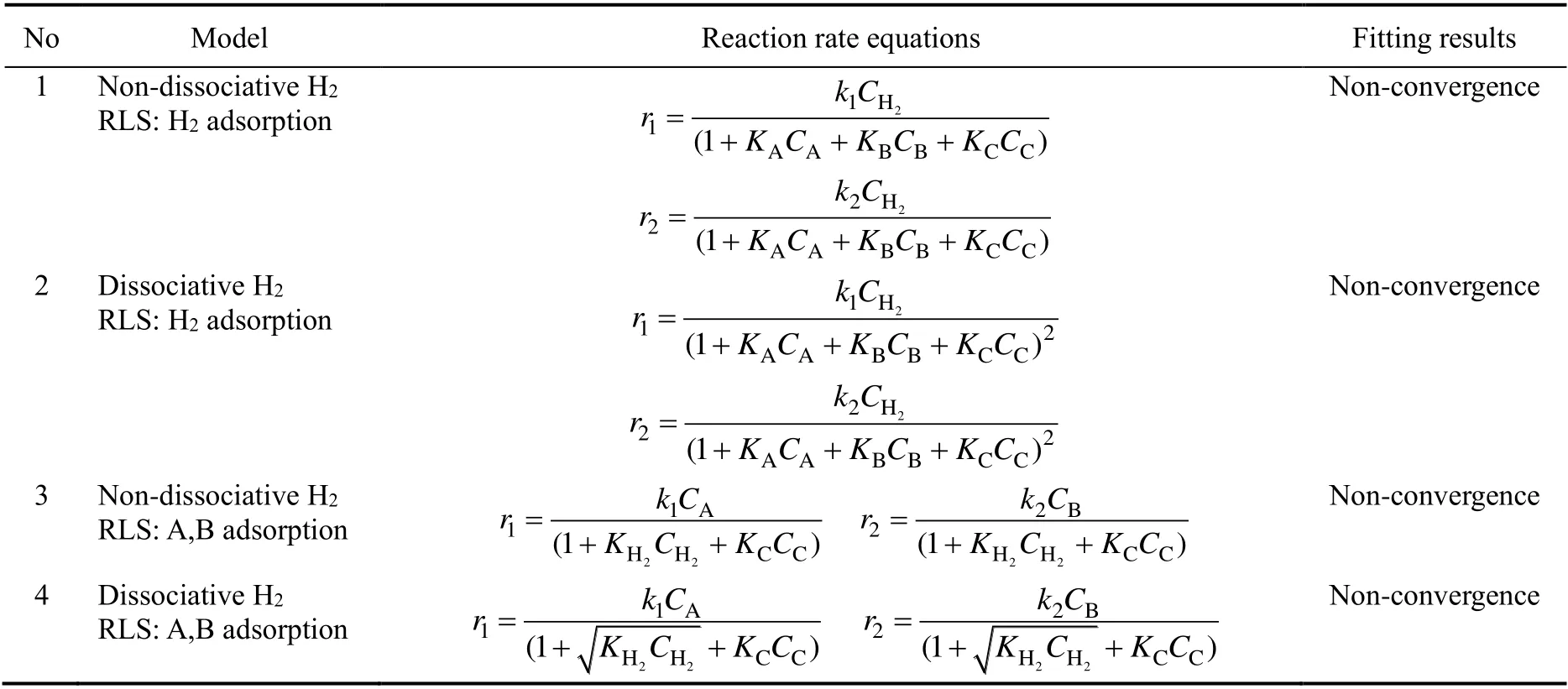
表1 动力学模型Table 1 Kinetics models

续表1
3.4 催化剂浓度对反应的影响
在搅拌速度为800 r/min,反应温度为160 ℃,氢气压力为3 MPa,CBDK初始浓度为0.6 mol/L的实验条件下,催化剂浓度对反应的影响如图4所示。
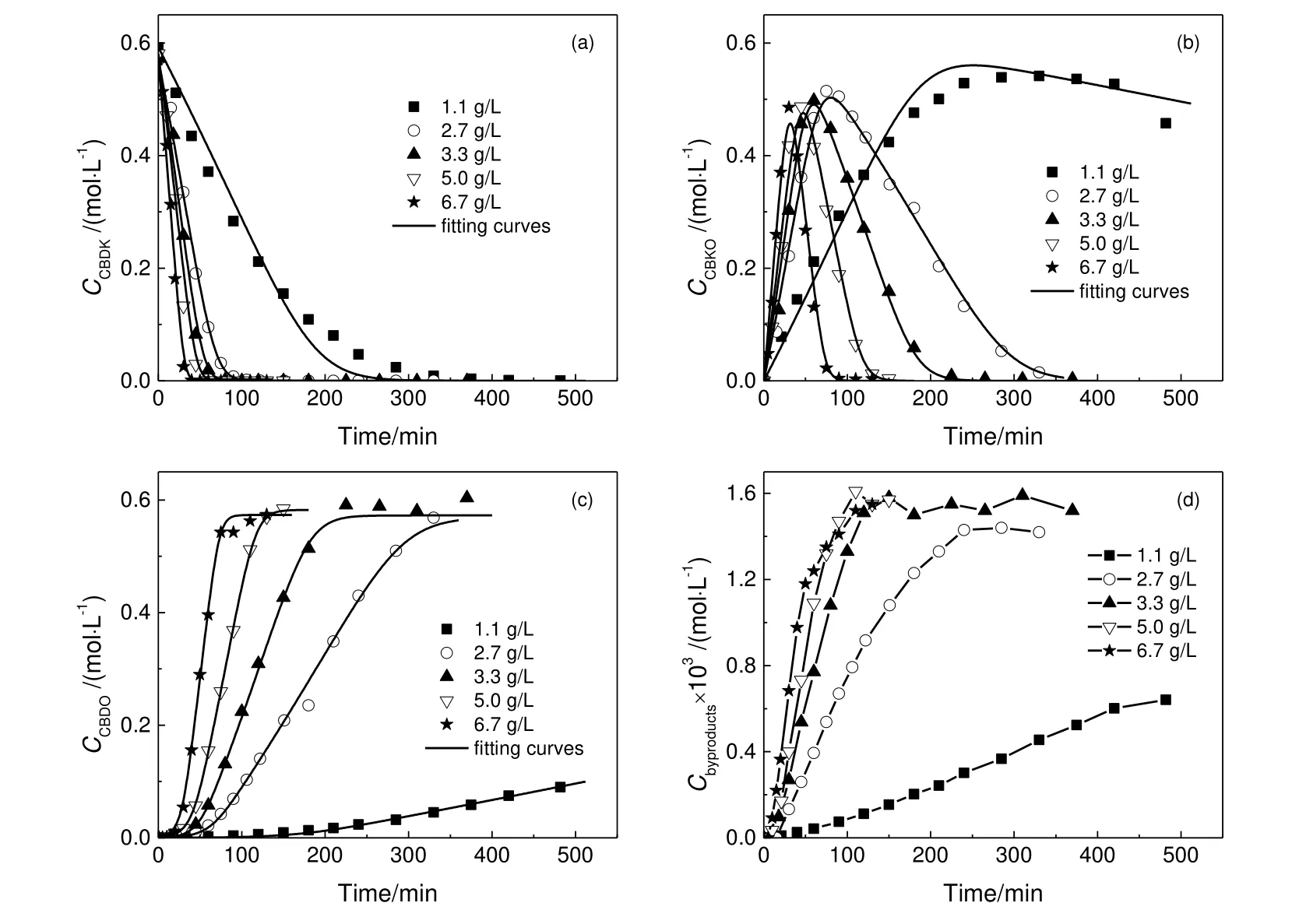
图4 催化剂浓度对反应速率的影响Fig.4 Effect of catalyst concentration on reaction rate
以不同催化剂浓度的实验数据拟合动力学模型5中的反应速率常数k1和k2,结果如图5所示。由图5可知,化学反应常数k1和k2与催化剂浓度(w)之间呈线性关系,表明在实验的催化剂浓度范围内,传质对反应的影响可以忽略。后续动力学实验所用催化剂浓度为2.7 g/L。
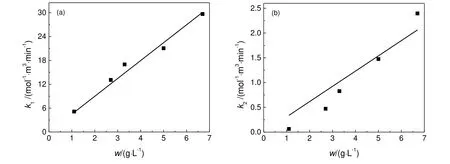
图5 不同催化剂浓度下的反应速率常数Fig.5 The reaction rate constant under different catalyst concentration
由实验数据还拟合得到了吸附平衡常数,CBDK、中间产物CBKO和CBDO的吸附平衡常数分别为951.9,280.1和60.0 mol/L。三者存在竞争吸附,随着物质中羰基数量的减少,吸附平衡常数下降,这与金属与羰基之间因协同成键作用生成的σ-π配位键有关[20]。正是因为竞争吸附现象存在,造成反应的前半段,即使CBKO的浓度积累到与CBDK相当,反应体系仍然以第一步加氢反应为主。
3.5 温度对反应的影响
在搅拌速度为800 r/min,CBDK初始浓度为0.6 mol/L,催化剂浓度为2.7 g/L的实验条件下,不同反应温度下CBDK加氢反应的各组分浓度及拟合曲线如图6所示。结果显示,升高温度对提高反应速率有显著影响,不同温度下的实验结果与拟合结果吻合很好,证明了动力学模型5的可靠性。

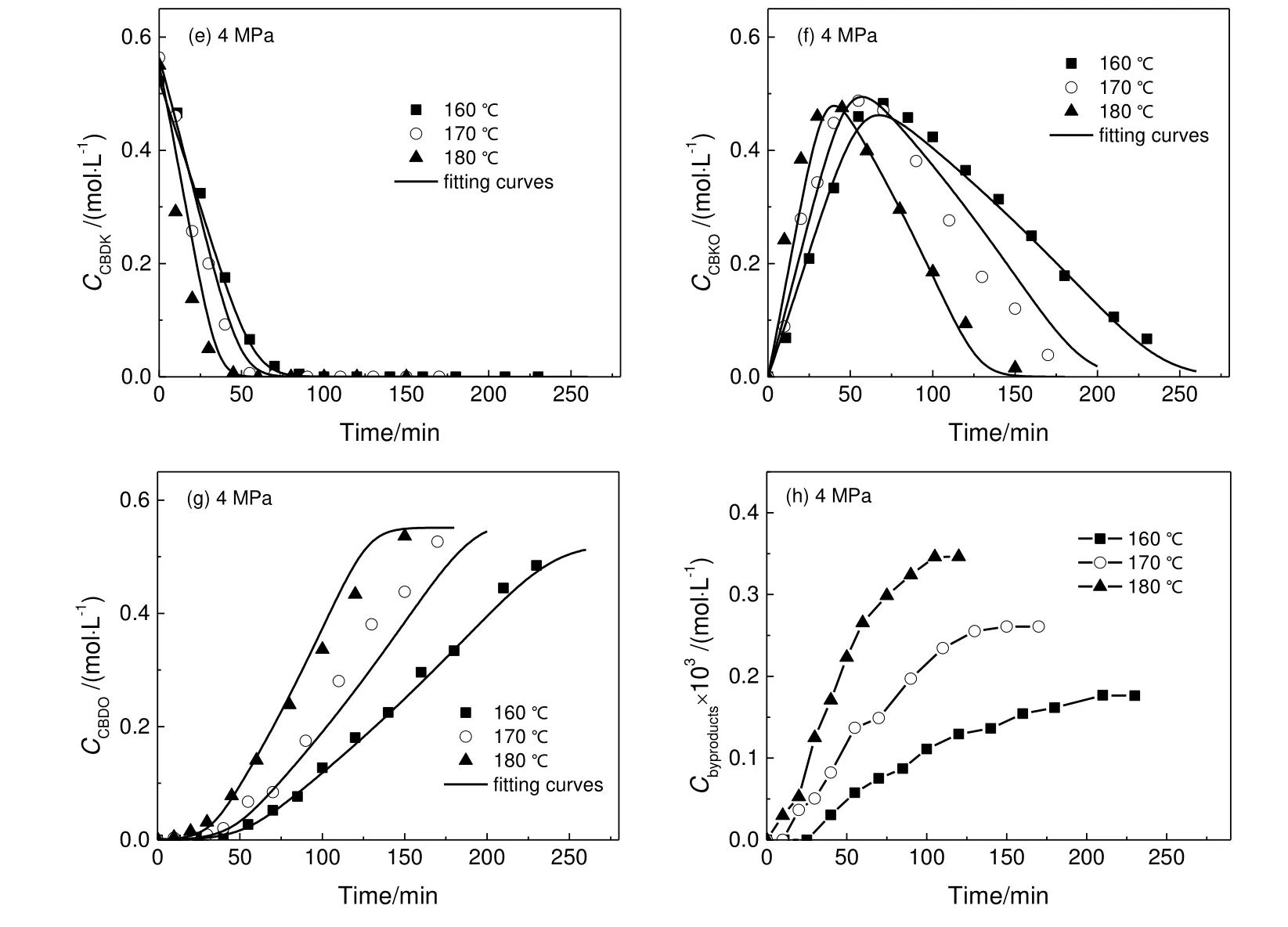
图6 不同温度下的CBDK加氢反应结果Fig.6 Reaction results of CBDK hydrogenation under different temperatures
将模型5中的反应速率常数以Arrhenius方程的形式展开进行拟合。

式中:Ea为反应活化能,kJ/mol;R为摩尔气体常数,8.314 J/(K·mol);T为温度,K。
采用Arrhenius方程拟合图5的数据得到CBDK连串加氢反应两步的活化能分别为34.7 kJ/mol和47.9 kJ/mol。与反应活化能相比,吸附活化能通常要小得多,受温度的影响较小,为了简化模型,将吸附平衡常数视为与温度无关的常数。此外,尽管升高温度有利于提高主反应的反应速率,但副产物收率也有所增加,而用于聚合的CBDO聚酯单体,对产品纯度有着很高要求,因此,较高温度条件下生产的CBDO产品对精制有着更高的要求。
3.6 氢气压力对反应的影响
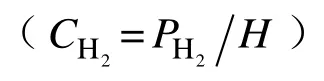
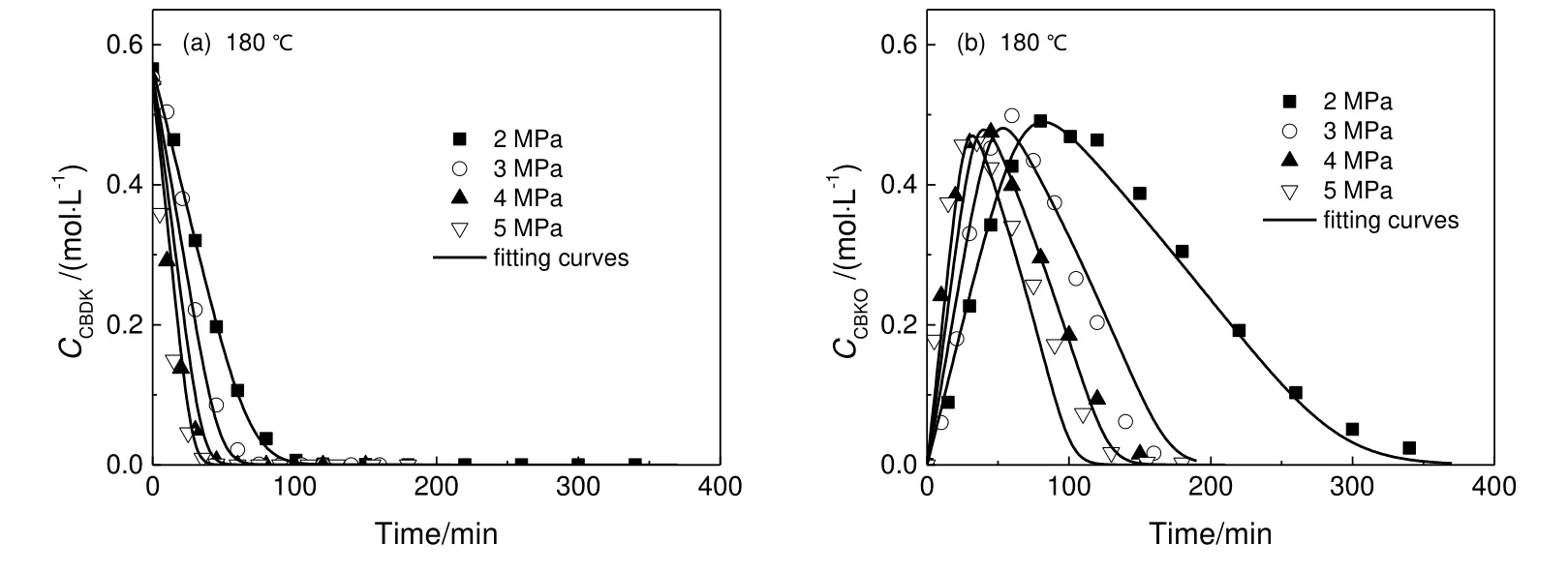
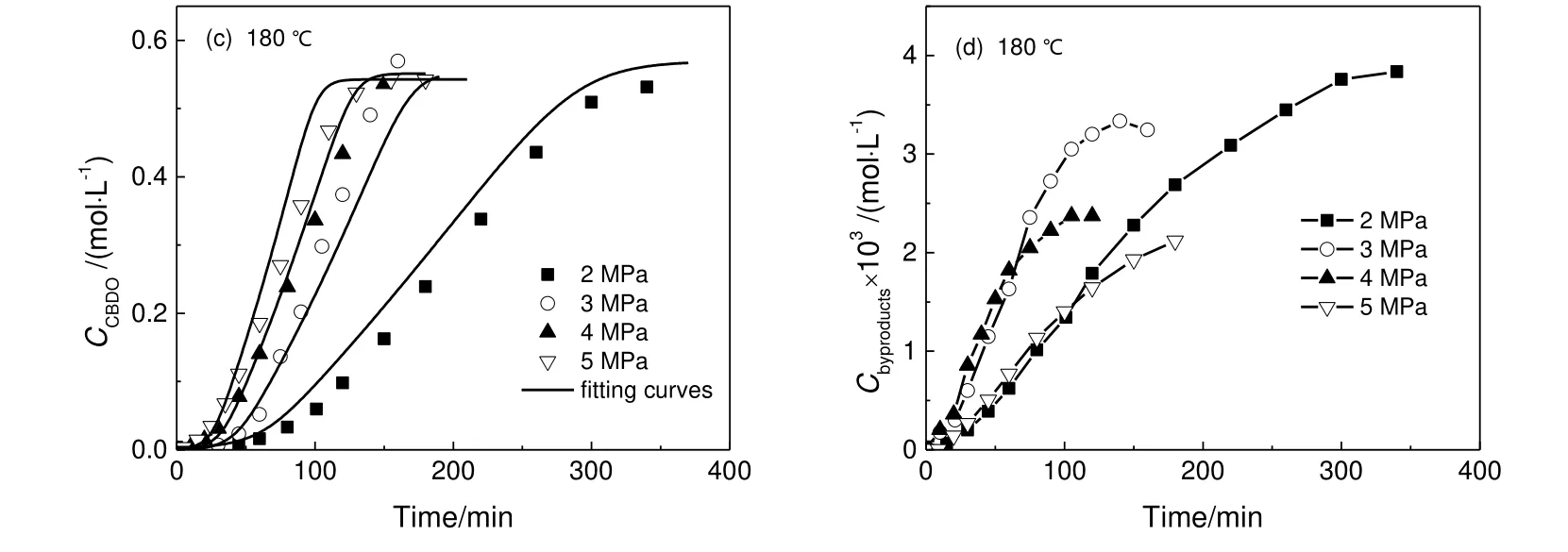
图7 压力对反应速率影响Fig.7 Effect of pressure on reaction rate
3.7 动力学方程
汇总得到CBDK液相加氢反应动力学方程如下:

式中:r为反应速率,mol/(L·s);w为催化剂浓度,g/L;Ki为吸附平衡常数,mol/L。动力学参数如表2所示。
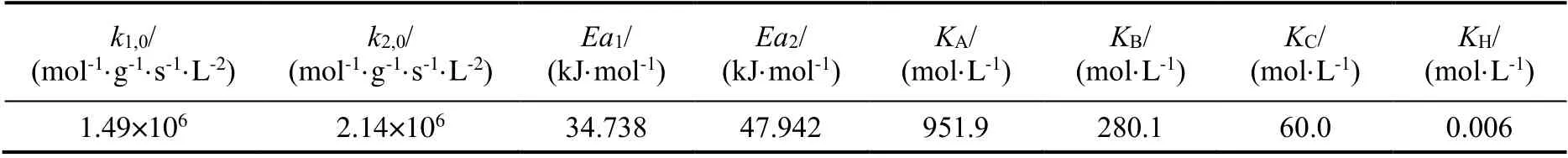
表2 CBDK液相加氢反应动力学参数Table 2 Kinetic parameters of liquid phase hydrogenation of CBDK
4 结 论
在排除传质影响的条件下,考察了催化剂浓度、反应温度、氢气压力对CBDK加氢反应的影响。通过假设不同的氢气吸附方式以及限速步骤,推导得到了不同LHHW型动力学模型,并用实验数据进行拟合,得到符合实验结果的动力学模型。结果表明,CBDK首先加氢生成中间体CBKO,之后再加氢生成CBDO,表面化学反应步骤是反应的限速步骤,氢气以分子态吸附,CBDK,CBKO和CBDO存在竞争吸附,吸附平衡常数分别为951.9,280.1和60.0 L/mol。在2~5 MPa,160~190 ℃条件下,Ru/C催化剂在CBDK加氢反应中对CBDO表现出高于99%的选择性,升温和加压都能有效提高CBDK加氢反应速率,但高温不利于CBDO选择性。第一步加氢反应的活化能为34.7 kJ/mol,第二步反应的活化能为47.9 kJ/mol。
符号说明
A—— 物质CBDKK—— 吸附平衡常数,mol/L
B—— 物质CBKOr—— 反应速率,mol/(L·s)
C—— 物质CBDOrobs—— 表观反应速率,mol/(L·s)
Ci—— 物质i浓度,mol/LR—— 摩尔气体常数,8.314 J/(K·mol)
d—— 催化剂平均粒径,25 μm S—— 吸附活性中心
Dp—— 有效扩散系数,8.05×10-10m2/sT—— 温度,K
Ea—— 反应活化能,kJ/molw—— 催化剂浓度,g/L
H—— Henry常数ρc—— 催化剂颗粒密度,0.5 g/mL
i-S—— 吸附态物质iηφ2—— Wheeler-Weisz模量
k—— 吸附速率常数 下标
k-1—— 脱附速率常数i—— 物质

