糖皮质激素对结核性脑膜炎大鼠脑组织血管内皮生长因子及受体表达的影响研究
代传扬 管弦乐 秦冠南△
(1.贵州医科大学附属医院,贵州 贵阳 550001;2.贵州中医药大学第二附属医院,贵州 贵阳 550001)
结核性脑膜炎(TBM)是由结核分枝杆菌经血行或直接侵入中枢神经系统引起的非化脓性炎症性疾病,也是肺外结核中最严重的形式,其发病率约占结核患者的10%,致死率、致残率高[1]。文献[2]报道,TBM未经治疗的患者死亡率接近100%;在接受治疗的儿童中,死亡约为20%,另有50%的患者遗留长期神经功能缺损;对于合并艾滋病者,治疗后死亡率约为60%。这既与TBM的早期症状不典型,易导致误诊有关,也与其治疗方案尚不统一有关。TBM作为感染性疾病,抗炎治疗是提高其疗效的主要手段之一。早在1952年,有学者[3]提出糖皮质激素可以减轻炎症,从而改善TBM患者预后。有研究[4-5]表明,糖皮质激素能降低TBM患者的短期死亡率,但其他研究指出糖皮质激素对TBM患者的远期生存率和致残率没有影响[6]。目前应用糖皮质激素治疗TBM仍有争议,其确切机制也未完全证实。因此,本研究通过建立大鼠TBM模型,拟研究糖皮质激素对TBM的治疗作用,探讨其可能分子机制,为临床应用糖皮质激素治疗TBM提供理论依据。
1 材料与方法
1.1主要材料 血管内皮生长因子(VEGF)单克隆抗体(Santa Cruze), 血管内皮生长因子受体1(VEGFR1)、血管内皮生长因子受体2(VEGFR2)(Abcam),7H9、7H11培养基(Difco),ELISA试剂盒(Cusabio Biotech,Newark),地塞米松磷酸钠注射液(上海现代哈森药业有限公司),注射用甲强龙(Pfizer Manufacturing Belgium NV),结核分枝杆菌H37Rv(北京市结核病胸部肿瘤研究所)。
1.2实验动物及分组 成年雄性SD大鼠20只,体质量250~300 g,购自贵州医科大学动物中心。大鼠饲养于通风、清洁、日夜节律的环境中,自由觅食。将实验大鼠随机分为4组,分别为对照(Control)组、结核性脑膜炎(TBM)组、TBM+地塞米松(DXMS)组和TBM+甲基强的松龙(MSS)组,每组5只。本研究获得了贵州医科大学附属医院动物伦理委员会的批准。
1.3方法
1.3.1TBM大鼠模型的建立 参照文献,TBM组、TBM+DXMS组和TBM+MSS组大鼠均先建立TBM模型。取在7H9培养基上生长2周的结核分枝杆菌H37Rv,经过滤、离心、分散,制成浓度为2.5×106CFU/mL菌悬液,经大鼠尾静脉注射0.2 mL/只(菌量5×105CFU/只),置于湿度(55±15)%,(21±2)℃负压环境中,保持12 h灯光/12 h黑暗的循环,动物可以方便地获取食物和水,14 d后形成结核性脑膜炎模型[7]。Control组大鼠尾静脉注射生理盐水0.2 mL。
1.3.2糖皮质激素治疗 TBM+DXMS组和TBM+MSS组大鼠在TBM模型建立后分别腹腔注射DXMS 0.4 mg/kg·d及MSS 4 mg/kg·d,TBM组大鼠腹腔注射等量生理盐水,持续一周。在用药后第7天分别断头处死进行实验指标观察,并与TBM组同期大鼠进行比较。
1.3.3脑组织含水量测定 处死动物后,尽快取出脑组织,观察脑大体标本。滤纸吸净表面血渍后,取左侧大脑半球按Elliott公式计算含水量:脑组织含水量=(湿重-干重)/湿重×100%。
1.3.4HE染色及VEGF、VEGFR1、VEGFR2免疫组织化学染色 大鼠心脏灌注取脑,多聚甲醛固定,石蜡包埋。取右侧大脑半球中1/3份全层脑组织制片。HE染色后,光镜观察脑组织病理变化。进行免疫组织化学染色,切片放入枸橼酸盐缓冲液中,98℃加热30 min进行抗原修复;3%双氧水室温封闭10 min,磷酸盐缓冲液(PBS)洗3次,5 min/次;滴加马血清封闭液,室温20 min,去除多余液体;加入一抗,4℃过夜后,在37℃复温45 min;PBS再洗3次,5 min/次;滴加生物素化二抗,37℃ 30 min;PBS洗3次,5 min/次;再加入三抗,37℃ 30 min;最后PBS清洗4次,5 min/次;DAB显色,苏木素复染;脱水、透明、封片、镜检;染色结果阅片由专人单盲进行,计数每40×高倍视野阳性细胞数。
1.3.5脑组织中炎症因子的检测 取右侧脑组织样研磨、匀浆后取上清液,按照说明通过ELISA试剂盒测定上清液中炎症因子(IL-1β、IL-6、IL-8和TNF-α)的含量。
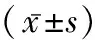
2 结 果
2.1脑组织病理形态改变 糖皮质激素治疗1周后,肉眼观察TBM组、TBM+DXMS组和TBM+MSS组大鼠脑组织均有不同程度的肿胀,表现为脑沟变浅,脑回增宽,脑膜紧张,脑膜血管扩张充血,脑室和脑池等处有较多渗出物。如图1所示,HE染色100×镜下可见Control组脑组织细胞排列整齐,形态规则;TBM组可见脑膜增厚,脑内细胞排列紊乱,蛛网膜下腔扩张,充血明显并伴有炎症细胞浸润;与TBM组比较,TBM+DXMS组和TBM+MSS组充血减轻、炎症细胞浸润减少,其中TBM+MSS组炎症细胞浸润减轻更明显。
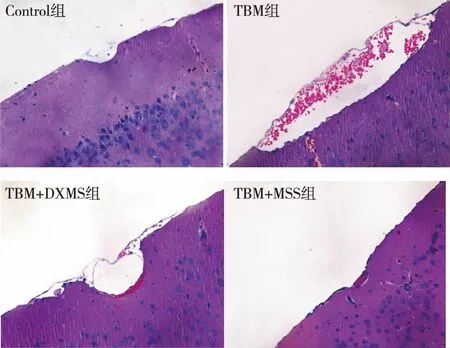
图1 各组大鼠脑组织HE染色
2.2脑组织含水量 TBM组脑组织含水量为(93.0±4.8)%,明显高于Control组(70.6±2.0)%(P<0.05)。TBM+DXMS组和TBM+MSS组脑组织含水量分别为(80.1±2.8)%和(76.7±3.1)%,低于TBM组(P<0.05),其中TBM+MSS组降低更为明显(P<0.05)。
2.3VEGF免疫组织化学 TBM组大鼠VEGF和VEGFR2表达较正常对照组增加(P<0.05),而VEGFR1未见明显变化(P<0.05)。TBM+DXMS组与TBM+MSS组VEGF表达较TBM组下调(P<0.05),VEGFR1表达上调(P<0.05);而TBM+DXMS组与TBM+MSS组VEGFR2表达与TBM组比较,均未见明显变化(P>0.05);TBM+DXMS组与TBM+MSS组上述指标间未见明显差异(P>0.05)。见表1。

表1 各组大鼠脑组织VEGF及其受体表达变化
2.4炎症因子水平 TBM组、TBM+DXMS组和TBM+MSS组大鼠脑组织中IL-1β、IL-6、IL-8和TNF-α水平较Control组升高(P<0.05);而TBM+DXMS组、TBM+MSS组上述指标均低于TBM组(P<0.05);以TBM+MSS组显著(P<0.05)。见表2。
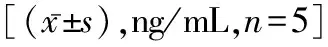
表2 各组大鼠脑组织炎症因子检测结果
3 讨 论
糖皮质激素在临床上已经广泛应用于脑水肿、脊髓损伤等中枢神经系统疾病的治疗,但其具体作用机制尚未完全明确。TBM时颅内常有明显的炎症反应,理论上糖皮质激素可以缓解炎症,减轻脑组织水肿并降低颅内压,从而减少脑组织的损伤。临床上也有较多医院经验性使用糖皮质激素治疗TBM,但疗效尚不确切[4-6]。在本研究中,我们发现糖皮质激素降低了TBM大鼠脑组织的含水量,说明糖皮质激素能够减轻TBM后继发的脑水肿。脑水肿是TBM后重要的病理改变,其病理生理机制可以是血脑屏障的破坏,或是细胞膜上离子通道的异常。而VEGF具有很强的促进病理性血管新生、增加血管通透性的作用,已被证实与部分疾病时脑水肿的形成密切相关[7-9]。但中枢系统感染时,比如TBM患者的脑水肿发生是否也与该因子有关,目前尚不明确。本研究发现,TBM后大鼠脑组织中VEGF含量增高,说明VEGF也参与了TBM后脑水肿的发生。VEGF有2种高亲和力的受体,VEGFR1和VEGFR2,两者共同调控VEGF的病理生理作用。VEGFR1和VEGFR2存在于血管内皮细胞中,正常情况下表达水平很低,但在缺血、缺氧等情况下,血管内皮中的VEGFR表达增高[8]。我们的研究也表明,VEGFR2在TBM后表达增高。但另一受体VEGFR1的表达未见明显变化,这与T.D.Crafts等[8]观察到的VEGFR变化不一致。我们推测,这可能与TBM的脑水肿形成机制与其他疾病不同有关。本研究发现,应用激素后,VEGF表达水平较TBM时下降,VEGFR1表达水平升高,而VEGFR2无明显变化,推测原因可能是VEGFR2主要表达于血管内皮,VEGF可以通过旁分泌的方式作用于血管内皮细胞,并通过与VEGFR2结合,激活PI3K/AKT信号传导途径,进而发挥生物学作用。而糖皮质激素的应用,则可能通过增加VEGFR1的表达,竞争性抑制VEGF与VEGFR2的结合,从而对VEGF的上述信号传导产生负性调节作用。
炎症反应是TBM的主要特征之一,TBM的病理生理过程也与多种炎症因子密切相关,如IL-1β、IL-6、IL-8和TNF-α等[10-11]。炎症因子的水平不仅可以用于TBM的辅助诊断,还可以用来判断患者的治疗效果和临床预后。本研究也检测了IL-1β、IL-6、IL-8和TNF-α在TBM后的表达变化,发现TBM后上述细胞因子明显增加,而应用糖皮质激素后这些细胞因子明显降低,提示糖皮质激素能够降低TBM后脑组织中的炎症因子表达,减轻TBM后的炎症反应。临床经验使用糖皮质激素治疗TBM时,具体用药选择目前尚不统一[12-13]。本研究选用了地塞米松和甲强龙两种类型的糖皮质激素进行比较,从结果可以看到,在降低脑组织炎症及脑水肿方面,甲强龙效果优于地塞米松,但二者在VEGF及受体表达方面未见明显差异。
综上所述,糖皮质激素能够减轻TBM大鼠脑水肿的发生,我们推测这是通过对VEGF及其受体的差异调控降低了血脑屏障通透性;糖皮质激素还能减轻TBM大鼠脑内炎症的程度和炎症因子的表达;相较于地塞米松,TBM大鼠使用甲强龙后脑水肿及炎症因子表达水平下降更为明显。目前,糖皮质激素在TBM的治疗中仍有争议,动物模型的研究为糖皮质激素在TBM治疗中的应用提供了理论依据。但该工作目前尚不完善,今后的研究可以进一步完善VEGF配体的检测,结合现有糖皮质激素对VEGF及其受体的实验结果,更好地解释糖皮质激素在TBM时脑水肿的作用机制,并将糖皮质激素使用中可能的副作用纳入研究。

