氧化胁迫下桑椹多酚及其微胶囊对肌原纤维蛋白结构及凝胶性能的调控
候雨雪,李登龙,林伟玲,刘学铭,林耀盛,唐道邦,王旭苹,张贤斌,叶宇游,程镜蓉*,朱明军
(1.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)(2.华南理工大学生物科学与工程学院,广东广州 510006)(3.喀什大学生命与地理科学学院,新疆喀什 844000)(4.中山市黄圃镇农业服务中心,广东中山 528429)(5.博罗县农业农村综合服务中心,广东惠州 516100)
肌原纤维蛋白是肌肉加工过程中的主要功能蛋白[1],约占肉蛋白总量的55%。它在加热或氧化过程中可以形成凝胶,在肉制品质构形成和口感维持中发挥着重要作用[2]。研究表明,适度氧化有助于促进肌原纤维蛋白质的交联,促进蛋白凝胶性能的发挥,而过度氧化则会破坏蛋白质间的相互作用,不利于蛋白凝胶化过程[3]。为了有效调控蛋白质的氧化,人们往往在肉制品中添加一些抗氧化剂。过度使用传统的抗氧化剂(如亚硝酸钠)存在潜在的遗传毒性和致癌风险,逐渐被人们所摒弃[4];而植物多酚作为一种天然植物次级代谢产物[5],有良好的抗菌、抗氧化的效果[6],近年来备受人们关注。研究表明,多酚具有抗炎、抗氧化和抗肿瘤等多种功效;长期摄入还有助于抑制糖尿病、肥胖、帕金森帕金森综合征、阿尔兹海默症[7]。
前期研究发现,植物多酚可以有效抑制蛋白质的氧化[8],但是酚类物质与蛋白质的结合会削弱蛋白凝胶性能,这将不利于酚类物质在富蛋白类食品中的应用[9]。与此同时,在热加工过程中酚类物质容易受到热损伤,这也不利于食品中酚类物质的保留及产品功能性的发挥。包埋是一种广泛用于提高活性物质稳定性的技术,它能通过壁材的屏障作用有效缓解活性成分与外界环境因子的相互作用。β-CD是由7个葡萄糖残基以α-1,4-糖苷键连接而成的环状化合物[10],内腔疏水,表面亲水,经常被用作精油或者其他活性物质的包埋材料[11]。前期研究已经证实桑椹多酚可以有效抑制蛋白质的氧化,并发现β-CD对桑椹多酚进行包埋可以有效改善酚类物质的热稳定性[12],但是将其与桑椹多酚结合制成微胶囊后将如何影响蛋白质结构及功能特性还鲜有研究。鉴于此,本研究采用β-环糊精为壁材,制备桑椹多酚微胶囊,以期减弱酚类物质与蛋白质的相互作用,并构建氧化体系,以探究在氧化胁迫下桑椹多酚微胶囊对蛋白质结构及功能特性的影响。
1 材料与方法
1.1 原料与试剂
猪里脊肉购自广东华润万家超市,储存于-4 ℃;Na3PO4、MgCl2、NaCl、EDTA、CuSO4、酒石酸钾钠、NaH2PO4、Na2HPO4、十二烷基硫酸钠、丙酮、DTNB(5,5-二巯基-2,2-二硝基苯甲酸)、尿素、2,4,6-三硝基苯磺酸、L-亮氨酸、2,2-盐酸脒基丙烷、三氯乙酸,均为分析纯,来自天津市大茂化学试剂公司;三羟甲基氨基甲烷,分析纯,广州市齐云生物试剂厂;亚油酸、盐酸胍、甘氨酸、偶氮二异丁脒盐酸盐,均为分析纯,上海瑞永生物试剂厂;脂肪氧化酶(LOX)(分析纯),日本东京化成工业株式试剂厂;β-环糊精,分析纯,上海市麦克林生化试剂厂。
1.2 仪器与设备
pH计,赛多利斯科学仪器股份有限公司;TGL-16M冷冻高速离心机,湖南湘仪仪器有限公司;UV-1800紫外-可见分光光度计,日本岛津;MOS-450圆二色谱光谱仪,法国Bio-Logic公司;DSC200F3差示扫描量热仪,Germany Bruck;TA-XT.PLUS,英国SMS;T25D均质机,德国IKA集团;UltraScan VIS色度仪,美国Hunter Lab;SN-3400电子扫描电镜,株式会社日立制作所。
1.3 试验方法
1.3.1 桑椹多酚微胶囊的制备
桑椹多酚的制备参考Xu等[13]的方法。酚类物质、黄酮和花青素总含量的测定方法参考Li等[14]的方法,总酚含量使用福林酚法测量,总黄酮含量使用分光比色法测量,花青素含量使用AOAC pH示差法测量,本研究中制备的桑椹多酚样品中酚类物质、黄酮和花青素的总含量分别为406.00±1.36 mg没食子酸当量(GAE)/g、94.47±1.08 mg槲皮素当量(QE)/g和73.59±1.25 mg矢车菊素-3-葡萄糖苷当量(C3GE)/g。桑椹多酚微胶囊的制备参考Li等[14]的方法,采用超声法制备桑椹多酚微胶囊。芯/壁的比例为1:6,超声时间为1.5 h,超声功率为450 W,超声温度为25 ℃。
1.3.2 肌原纤维蛋白的提取
肌原纤维蛋白的提取方法是参考Cheng等[15]的方法,所得肌原纤维蛋白保存于4 ℃,并于48 h内使用。蛋白浓度通过双缩脲法[16]测定。
1.3.3 肌原纤维蛋白复合物的制备
室温下,将肌原纤维蛋白使用PBS(0.037 mol/L Na2HPO4·12H2O,0.163 mol/L NaH2PO4·2H2O,0.6 mol/L NaCl,pH 6.25,下同)适当稀释,使用PBS配制10 mg/mL的MP、β-CD和MPM溶液,取0.28 mL上述溶液加入到10 mL肌原纤维蛋白溶液,制备10 mg/mL的肌原纤维蛋白复合物,3000 r/min均质30 s,混匀溶液,获得肌原纤维蛋白复合物。
1.3.4 肌原纤维蛋白氧化处理
亚油酸/脂肪氧合酶氧化体系(LOX)的构建:10 mmol/L亚油酸,3750 U/mL脂肪氧化酶。
氧化实验:分别取10 mL上述制备的10 mg/mL的肌原纤维蛋白复合物,加入20 mL的LOX氧化体系溶液,将样品至于37 ℃水浴锅水浴加热4 h,然后加入5 mg奎诺二甲基丙烯酸酯(Trolox),摇匀后终止反应。阴性对照和阳性对照组分别为未经氧化的肌原纤蛋白溶液和未添加桑椹多酚的肌原纤蛋白氧化溶液,处理方法同上。为消除游离酚类物质对特定检测显色反应(巯基、自由氨基等)的干扰,用纯净水洗涤样品溶液三次后再复溶于10 mL PBS。
1.3.5 蛋白羰基值测定
蛋白羰基值的测定参考向荣[17]的方法,并适当改动。每次取溶液0.1 mL测量。
1.3.6 巯基和二硫键含量测定
游离巯基根据参考文献[18]中的方法,并适当修改后测定。取两份0.5 mL样品,加入2.5 mL Tris-Gly-8 mol/L尿素溶液,旋涡震荡30 s,混匀;其中,一组加20 μL Ellman试剂(实验组),另一组加20 μL Tris-Gly溶液(对照组),37 ℃水浴15 min,离心(10000 r/min,5 min),使用紫外分光光度计于412 nm处测定上清液吸光值,得游离巯基值。摩尔消光系数为13.6×103L/(mol·cm),计算公式如下:
式中:
蛋白总巯基含量的测定:取两份0.2 mL样品,分别加入2 mL Tris-Gly-8 mol/L尿素溶液,然后加入20 μLβ-巯基乙醇,37 ℃下水浴15 min,然后加入50%三氯乙酸至最终浓度为10%(m/V),离心(10000 r/min,5 min),弃去上清液,沉淀用丙酮洗涤三次,振荡混匀,离心(10000 r/min,5 min),再将沉淀溶于3 mL的Tris-甘氨酸-8 mol/L尿素缓冲液,振荡混匀,在实验组中加入20 μL Ellman试剂,在对照组中加入20 μL Tris-甘氨酸缓冲液,悬浮液于37 ℃下水浴15 min,离心(10000 r/min,5 min),测定412 nm处吸光值,计算总巯基含量。二硫键含量(nmol/mg蛋白)计算公式如下:
二硫键含量(nmol/mg蛋白)=(总巯基含量-游离巯基含量)/2
1.3.7 自由氨基含量测定
自由氨基值的测定参考Emilia等[19]的方法并适当地改进。取样品溶液200 µL于10 mL试管中,向其中加入2 mL 1%十二烷基磺酸钠和1 mL 0.01%三硝基苯磺酸,旋涡振荡30 s,混匀,将样品置于50 ℃水浴锅中避光反应30 min,加入2 mL 0.1 mol/L亚硫酸钠终止反应,待降温至室温后,在420 nm处测吸光度。以L-亮氨酸为标准品绘制标准曲线,样品自由氨基值(nmol/mg蛋白质)根据所绘标准曲线来计算。
1.3.8 二级结构测定
采用MOS-450圆二色谱光谱仪分析肌原纤维蛋白二级结构的变化。用0.6 mol/L PBS将样品调整为0.5 mg/mL,将样品加入到1 mm的石英比色皿中,扫描温度20 ℃,扫描波长190~260 nm,扫描速率60 nm/min,带宽为1 mm,每0.5 s取一个点。所得结果为三次扫描的平均值并扣除相应溶剂背景。
1.3.9 三级结构测定
通过测定内源性色氨酸荧光和热稳定性分析肌原纤维蛋白三级结构的变化。
色氨酸荧光的变化使用FluoroMax-3荧光分光光度仪测定。使用0.6 mol/L PBS将样品的蛋白浓度稀释为0.25 mg/mL,于室温下以295 nm为激发波长,激发间距为5 nm,发射间距为5 nm,用500 nm/min速率收集数据,记录300~400 nm的光谱值。
热稳定性通过DSC200F3分析。取10 mg/mL的蛋白样品38 mg,密封于铝坩埚中,升温速率为5 ℃/min,测定范围为20~100 ℃。
1.3.10 凝胶性能测定
将样品中的蛋白浓度统一调整为20 mg/mL,取8 mL样品置于直径为30 mm的磨口平底玻璃瓶,密封。将上述样品置于水浴锅中加热,起始温度为25 ℃,保温5 min,以1 ℃/min线性升温至73 ℃,保温5 min。取出样品,冰水浴30 min降温,然后将样品置于4 ℃冰箱冷藏12 h。将样品取出后,在室温下静置2 h,测定凝胶性能。
凝胶强度:除去凝胶表面的液体,测试前、中、后速度均为1 mm/s,形变程度为样品高度的30%,测定时间间隔5.0 s。使用P0.5探头,触发力为5.0 g,触发类型为自动。刺破凝胶所需的初始压力即为凝胶强度[20]。
凝胶白度使用UltraScan VIS色度仪进行测定。测定前需对仪器进行自检及校正,每个样品测量重复三次,取其平均值。凝胶白度值按下式计算[21]:
式中:
L*——亮度值;
a*——红度值;
b*——黄度值。
凝胶持水能力(WHC)根据Park等[22]的方法测定。称取凝胶5 g,离心(4 ℃,10000 r/min,10 min),除去上清液。持水力的计算公式为:
式中:
m——离心管质量;
m1——离心前离心管和样品的总质量;
m2——离心后离心管和样品的总质量。
1.3.11 凝胶微结构分析
样品冻干后,固定于设有黑色双面粘带的托盘,用电子扫描电镜(日立SN-3400)观察凝胶微观表面结构。
1.3.12 数据分析
每个实验都进行3次独立实验,数据结果为平均值±标准差。使用SPSS 19.0统计软件程序做出分析。显著性差异使用Anova和Duncan进行分析,其中p<0.05标志着差异具有显著性。
2 结果与讨论
2.1 MPM对肌原纤维蛋白氨基酸侧链的化学修饰
从表1中的数据可以看出,经过氧化后,羰基、二硫键含量显著上升(p<0.05),巯基与氨基含量显著下降(p<0.05)。在蛋白质的氧化过程中,氨基酸的NH或者NH2与OH·侧链基团发生反应,生成羰基[23];含硫氨基酸(如半胱氨酸残基)容易被活性氧氧化[3],形成二硫键。与对照组相比(OX组),桑椹多酚处理的肌原纤维蛋白羰基化程度显著下降(p<0.05),巯基向二硫键的转变得到了缓解,并且氨基含量显著提高(p<0.05),这说明桑椹多酚具有良好的抗氧化效果。这是因为桑椹多酚富含酚羟基,是良好的氢供体,因而具有清除自由基,使自由基链式反应减慢或终止的能力[24]。而添加桑椹多酚微胶囊组与桑椹多酚组相比,羰基、二硫键、巯基、氨基含量无显著变化(p>0.05),说明β-CD对桑椹多酚的抗氧化能力无显著影响。

表1 LOX氧化体系下肌原纤维蛋白的氨基酸侧链修饰调节Table 1 Amino acid side chain modification and regulation of myofibrillar protein treated with LOX oxidation systems (nmol/mg pro)
2.2 MPM对肌原纤维蛋白二级结构的影响
肉制品的加工和贮藏过程中蛋白质逐渐被氧化,其结构被展开,会诱发α-螺旋的解旋及其向β-转角等结构的转变[25]。由表2中的数据可以看出,氧化后的肌原纤维蛋白的α-螺旋减少,同时伴随着β-转角、β-折叠和无规卷曲的增加,这是由于蛋白质的解折叠造成的[26]。添加了桑椹多酚组的α-螺旋的解旋更加严重,这可能是因为α-螺旋主要通过分子内的羰基氧和氨基氢之间形成的氢键来维持稳定的,而桑椹多酚富含多羟基结构,干扰了氢键的稳定性,从而引起α-螺旋的解旋[27]。Cao等[28]将绿原酸添加到肌原纤维蛋白中,也观察到了α-螺旋的解旋。而桑椹多酚微胶囊组与氧化对照组(OX组)相比,α-螺旋增加,β-转角减少,这表明桑椹多酚微胶囊抑制了α-螺旋的解旋,这有可能是β-CD对桑椹多酚进行包埋后,强化了蛋白质的氢键作用,使蛋白质的α-螺旋结构更加稳定。
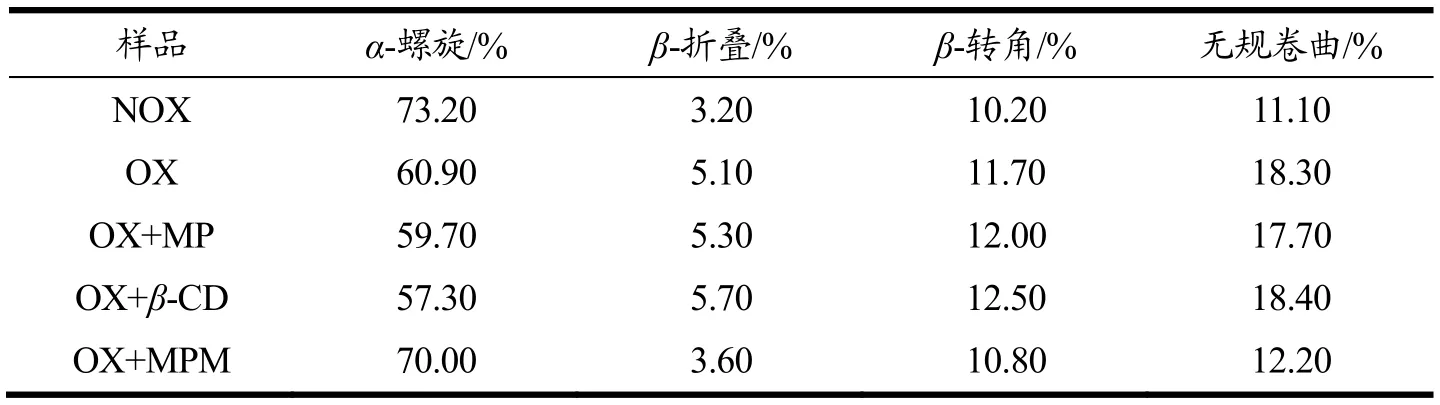
表2 LOX氧化体系中肌原纤维蛋白二级结构的变化Table 2 Changes of the myofibrillar protein secondary structure after oxidation with LOX system
2.3 MPM对肌原纤维蛋白三级结构的影响
2.3.1 内源性色氨酸荧光特性分析
图1为内源性色氨酸荧光特性的变化曲线。色氨酸对其所处的微环境的极性极其敏感[28],当蛋白质处于折叠状态时,色氨酸残基位于核心(疏水区域),展现了较高的荧光强度;当蛋白质处于展开或者半展开的状态时,更多的色氨酸残基就会暴露于蛋白质分子表面,会导致荧光强度的降低[24]。因此,氧化后肌原纤维蛋白结构逐渐被展开。由1图中的数据可以看出,不同处理组的肌原纤维蛋白荧光强度明显降低,表明肌原纤维蛋白的三级结构受到了不同程度的破坏。MP修饰后的蛋白荧光猝灭效应较对照组(NOX)显著增强,这主要是因为桑椹多酚中富含多羟基水溶性酚酸会提高色氨酸微环境的极性,导致荧光猝灭效应增强[24]。MPM的添加进一步加剧了荧光强度的下降,这可能是因为β-CD富含羟基结构[29],它们的加入同样会改变色氨酸的疏水环境,这也可以从β-CD处理的样品组得到证实。
2.3.2 DSC分析
DSC作为判断蛋白结构及热稳定性变化的关键指标。图2为不同处理条件下肌原纤维蛋白DSC曲线,未经氧化处理的肌原纤维蛋白图谱中显示出两个吸热峰,最大热转变温度(Tmax)分别为54.50 ℃和62.00 ℃,分别来自于适度酶解后肌球蛋白尾部变性和肌动蛋白变性[30]。氧化后,肌球蛋白尾部和肌动蛋白的热吸收峰发生移动,Tmax升高为60.80 ℃。MP和MPM的添加使得Tmax分别降低为48.30 ℃和45.80 ℃,Cao等[28]的研究也出现了同样的现象,表明酚类物质的添加促进了肌原纤维蛋白结构的展开,适度降低了蛋白质的热稳定性。
2.4 MPM对肌原纤维蛋白凝胶性能的影响
蛋白质的凝胶化是决定肉制品质构的重要环节。在升温过程中,肌原纤维蛋白逐渐展开并交联,形成具有一定黏弹性的三维网状结构,从而实现凝胶化,赋予肉制品特殊的口感[31]。凝胶强度反映蛋白质形成凝胶的能力,在经过氧化后,蛋白凝胶强度显著增加。这主要是因为氧化诱导了蛋白质结构的展开,促进了蛋白质的交联与聚集,一定程度上有助于凝胶三维网状结构的形成。与此同时,氧化还可以促进二硫键的生成,加强蛋白质之间的相互作用[32],因此蛋白质凝胶网络结构得到了提高。MP和MPM组蛋白质凝胶强度出现了明显下降(p<0.05),这可能是因为酚类物质对蛋白质的修饰作用并不利于蛋白质的交联。而MP和MPM组的凝胶持水性显著增强(p<0.05),可能是因为多酚可以抑制蛋白质氧化,对蛋白质降解起到了保护作用,使凝胶孔隙更加均匀,凝胶网络结构更加致密,从而提高了凝胶的持水性[33]。
氧化会使凝胶白度显著降低(p<0.05),从66.50下降到60.07,桑椹多酚的介入会进一步降低凝胶白度(51.53,p<0.05),这可能与桑椹多酚自身的色泽有关。Balange等[34]的研究也发现,在鱼糜中添加0.60%的酚类化合物时,鱼糜的凝胶白度也出现显著下降。将桑椹多酚用β-环糊精包埋后,与直接添加桑椹多酚相比,显著地提高了凝胶白度,说明微胶囊处理能有效缓解桑椹多酚对肌原纤维蛋白凝胶白度造成的负面影响。
2.5 MPM对蛋白凝胶显微结构的影响
图3为不同处理条件下的肌原纤维蛋白凝胶的微观结构。由图3可以看出,未经氧化的蛋白凝胶孔径较大,表面粗糙,孔隙分布不均;经过氧化后的凝胶表面平整度有所改善,孔洞明显减少。此结果与Zhang等[3]的结果一致,这可能是因为适当的氧化会促进蛋白质的展开所致[35],这也可以从凝胶强度的结果得以证实(表3)。当肌原纤维蛋白经MP或MPM处理后,凝胶表观平整度有了进一步改善,蛋白凝胶变得更加致密、光滑,尤其是MPM处理组。这可能是MP使肌原纤维蛋白结构适度展开,促进了蛋白质分子间的相互作用,而氧化诱导下,蛋白质分子间的交联作用更加剧烈,因此,形成的凝胶结构更为致密。氢键、疏水作用力、二硫键等作用力在凝胶结构维持中发挥着重要作用,而MPM处理后的肌原纤维蛋白的氢键作用得到了显著加强(表2),可能是造成其良好凝胶结构的重要原因。

表3 氧化前后凝胶的强度、白度和持水力Table 3 Effects of oxidation and polyphenols on gel strength,whiteness and water holding capacity
3 结论
本研究探讨了LOX氧化体系下桑椹多酚及其微胶囊对肌原纤维蛋白结构及凝胶特性的影响。研究发现桑椹多酚能有效减少因氧化而引起的肌原纤维蛋白羰基和二硫键含量上升,同时抑制巯基和自由氨基含量下降。桑椹多酚有助于提高肌原纤维蛋白凝胶的持水性,使蛋白质的凝胶持水性从20.22%提高到了23.11%(p<0.05),改善其表观结构,但不利于凝胶白度和凝胶强度的维持。利用β-CD对多酚进行包埋有助于缓解桑椹多酚对肌原纤维蛋白凝胶色泽带来的不利影响,强化蛋白质的氢键作用,进一步改善肌原纤维蛋白凝胶的结构。此研究为进一步改善富桑椹多酚型肉制品的品质提供了新思路。

