二巯基乙醇解决CD38单克隆抗体对输血前检测的干扰及疗效分析*
袁 燕,邓超干,蔡钦泉,罗钦泉
深圳市罗湖区人民医院输血科,广东深圳 518001
多发性骨髓瘤是一种浆细胞异常增殖的恶性疾病,在很多国家是血液系统第2 位常见恶性肿瘤,仅次于淋巴瘤[1]。随着新药出现及检测手段的提高,多发性骨髓瘤的诊断和治疗不断改进和完善。 2019年7月,中国国家药品监督管理局批准达雷妥尤单抗(DARA)上市,该药是人源化抗CD38IgG1κ单克隆抗体,可以通过多种免疫介导的作用机制诱导肿瘤细胞的快速死亡。文献[2]增加了达雷妥尤单抗联合治疗部分及相关注意事项,随着指南的修订,DARA已经成为了一种高效的治疗多发性骨髓瘤的一线药物。CD38是一种完整的跨膜糖蛋白,在红细胞表面也有不同程度的表达[3-5]。它具有多种功能,包括酶活性、细胞内钙调节和受体介导的黏附。DARA的抗骨髓瘤活性通过CD38单克隆抗体(简称CD38单抗)介导的免疫机制发生,包括补体依赖性细胞毒性、抗体依赖性细胞毒性、抗体依赖性细胞吞噬作用和免疫抑制调节性T细胞的免疫调节性耗竭,通过CD38直接的表面信号传导途径,发生肿瘤细胞凋亡[6]。CD38单抗免疫机制会干扰输血相容性检测,导致抗体筛查阳性和交叉配血不合。本文通过回顾2例使用DARA治疗的多发性骨髓瘤患者接受32次输血治疗,总结分析0.2 mol/L二巯基乙醇(2-Me)对输血相容性检测的处理及输血实践的影响。
1 资料与方法
1.1研究对象 病例1:男性患者,64岁,2016年确诊多发性骨髓瘤,先后行硼替佐米/地塞米松(VD)方案、硼替佐米/阿霉素/地塞米松(PAD)方案治疗后,病情好转,期间曾有输血治疗。2020年2月病例1患者因多发性骨髓瘤再次入院,2020年2-4月其在本院行DARA+PAD治疗,由于病例1患者贫血因此给予其输血治疗。病例2:女性患者,62岁,既往无重大病史,孕2产2,无输血史,2020年6月发现肾功能不全入院,诊断为多发性骨髓瘤。病例2患者一直在本院进行规律化疗和其他对症治疗,2020年6月20日至2021年6月行DARA+PAD方案治疗,由于病例2患者贫血因此给予其输血治疗。病例1和病例2患者输注的血液来自无偿献血者,由深圳市血液中心分离制备为去白细胞悬浮红细胞。
1.2对照 阴性对照为未使用CD38单抗治疗且无不规则抗体的血浆标本;阳性对照为未使用CD38单抗治疗但不规则抗体阳性,经鉴定3份标本中分别含抗E、抗JKa、抗M抗体。采用0.2 mol/L的2-Me 处理抗筛细胞前后进行抗体筛查实验,验证2-Me消除CD38单抗干扰对意外抗体检测的影响。
1.3仪器与试剂 戴安娜全自动血型配血仪(型号:WADiana Compact);久保田离心机(型号:KA-2200);电热恒温水槽(型号:CU-600型);正反定型血型卡(西班牙 Diagnostic Grifols,批号:18009.01、20012.01);抗人球蛋白卡(西班牙 Diagnostic Grifols,批号19116.01、19189.01、20122.01);ABO血型反定型细胞(上海血液生物,批号:20205304、20205308、20205335);抗体筛查细胞(上海血液生物,批号:20207043、20217005);十二系抗体鉴定细胞(上海血液生物,批号:20200226、20200611、20201113);凝聚胺试剂(珠海贝索,批号:A191001、A191101、A200802); 0.2 mol/L 2-Me(上海血液生物,批号:20191201、20200302、20201901)。
1.4处理红细胞 用移液器吸取待灭活红细胞(献血者红细胞、抗筛细胞),用生理盐水悬浮,1 000×g离心1 min后弃掉上清液;用生理盐水洗涤4次;最后1次洗涤后吸取25 μL压积红细胞,用生理盐水配制成 2%~5% 待灭活红细胞悬液(20 μL压积红细胞加500 μL生理盐水配制为3%的红细胞浓度);2%~5%待灭活红细胞悬液与0.2 mol/L 2-Me 1∶4混合;37 ℃水浴孵育30 min,孵育期间混匀3~4 次;孵育结束后用生理盐水洗涤4次,弃去上清液,用生理盐水配成需要的红细胞悬液浓度。
1.5检测方法 病例1和病例2患者标本用微柱凝胶法行ABO和RhD血型试验、直接抗人球蛋白试验(DAT-IgG);抗筛细胞和献血者红细胞灭活前后均采用微柱凝胶法、凝聚胺法与病例1和病例2患者标本行抗体筛查、交叉配血。按照试剂说明书进行试验和结果判读[7]。
1.6红细胞输注效果评价 病例1和病例2患者输注红细胞后24~48 h内检测血红蛋白,依据血红蛋白增加值和临床症状体征的改善,综合判断红细胞输注效果。
2 结 果
2.1CD38单抗治疗前病例1和病例2患者输血相容性检测 病例1和病例2患者在治疗前抗体筛查、DAT-IgG、自身对照均阴性、交叉配血实验主次侧均无凝集无溶血,见表1。
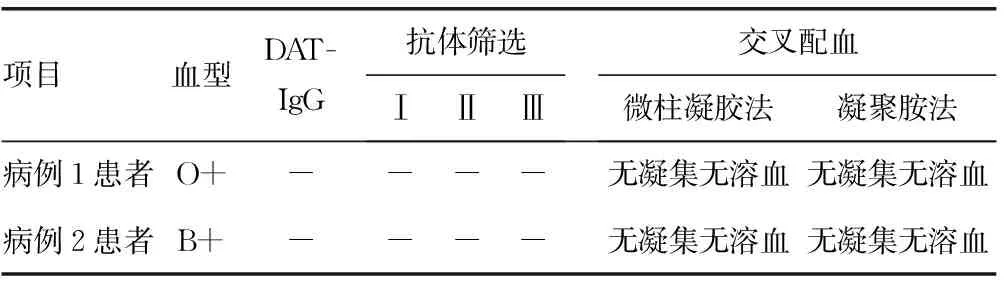
表1 CD38单抗治疗前病例1和病例2患者输血相容性检测结果
2.2CD38单抗治疗后病例1和病例2患者输血相容性检测 病例1和病例2患者ABO和RhD血型不受影响,自身对照和DAT-IgG阳性。见表2。抗体筛查试验选择含抗E、抗JKa、抗M抗体血浆做对照,用2-Me处理抗筛细胞,结果见表3。交叉配血试验,用0.2 mol/L的2-Me处理献血者红细胞前后进行试验,结果见表4。

表2 CD38单抗治疗后病例1和病例2患者血型、DAT-IgG、自身对照结果
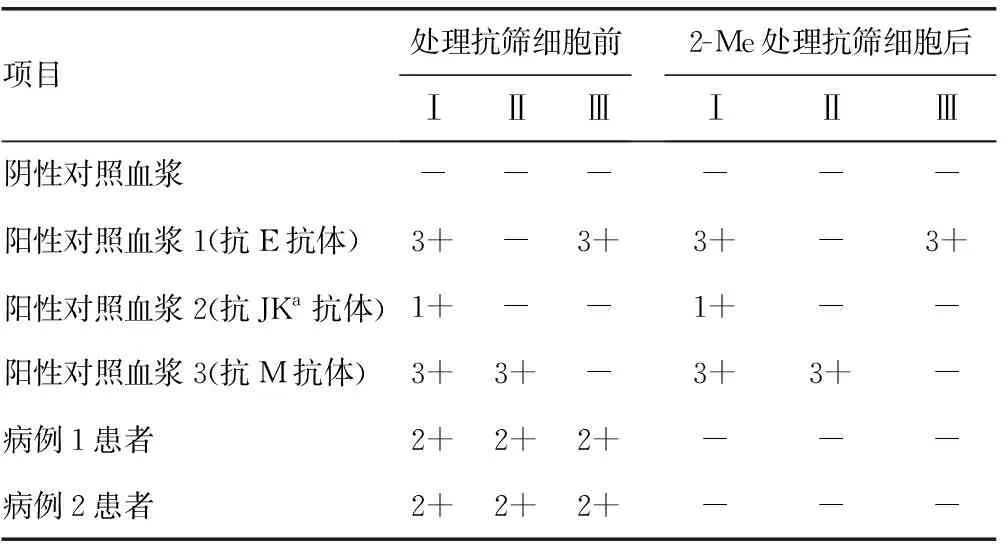
表3 CD38单抗治疗后病例1和病例2患者和对照抗体筛查结果

表4 抗CD38单抗治疗后病例1和病例2患者交叉配血结果
2.3输注效果评价 微柱凝胶法交叉配血主侧无凝集,次侧凝集强度小于或等于自身对照及DAT-IgG凝集强度,故判为相合。住院治疗期间,病例1患者共输注13次、病例2患者共输注19次相合红细胞。输注后24~48 h内复查血常规,依据输注1 U红细胞可使体质量为60 kg的成年人血红蛋白(Hb)水平提高约5 g/L[或使血细胞比容(HCT)提高约0.015%]及临床症状体征的改善,综合判断红细胞输注有效。病例1和病例2患者输注前后Hb及HCT变化情况见表5、6。
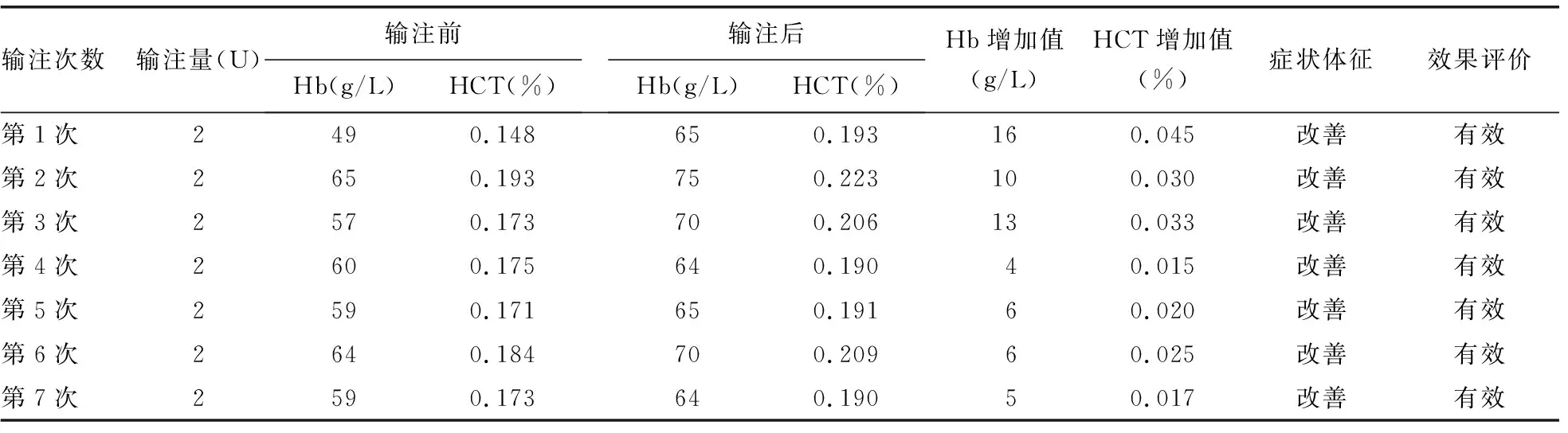
表5 病例1患者输注红细胞效果评价
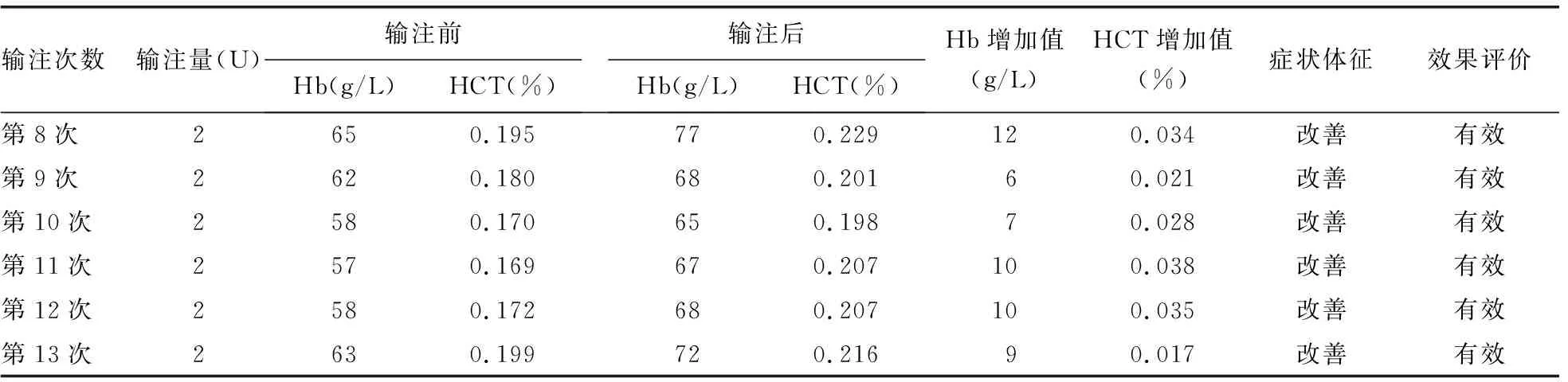
续表5 病例1患者输注红细胞效果评价
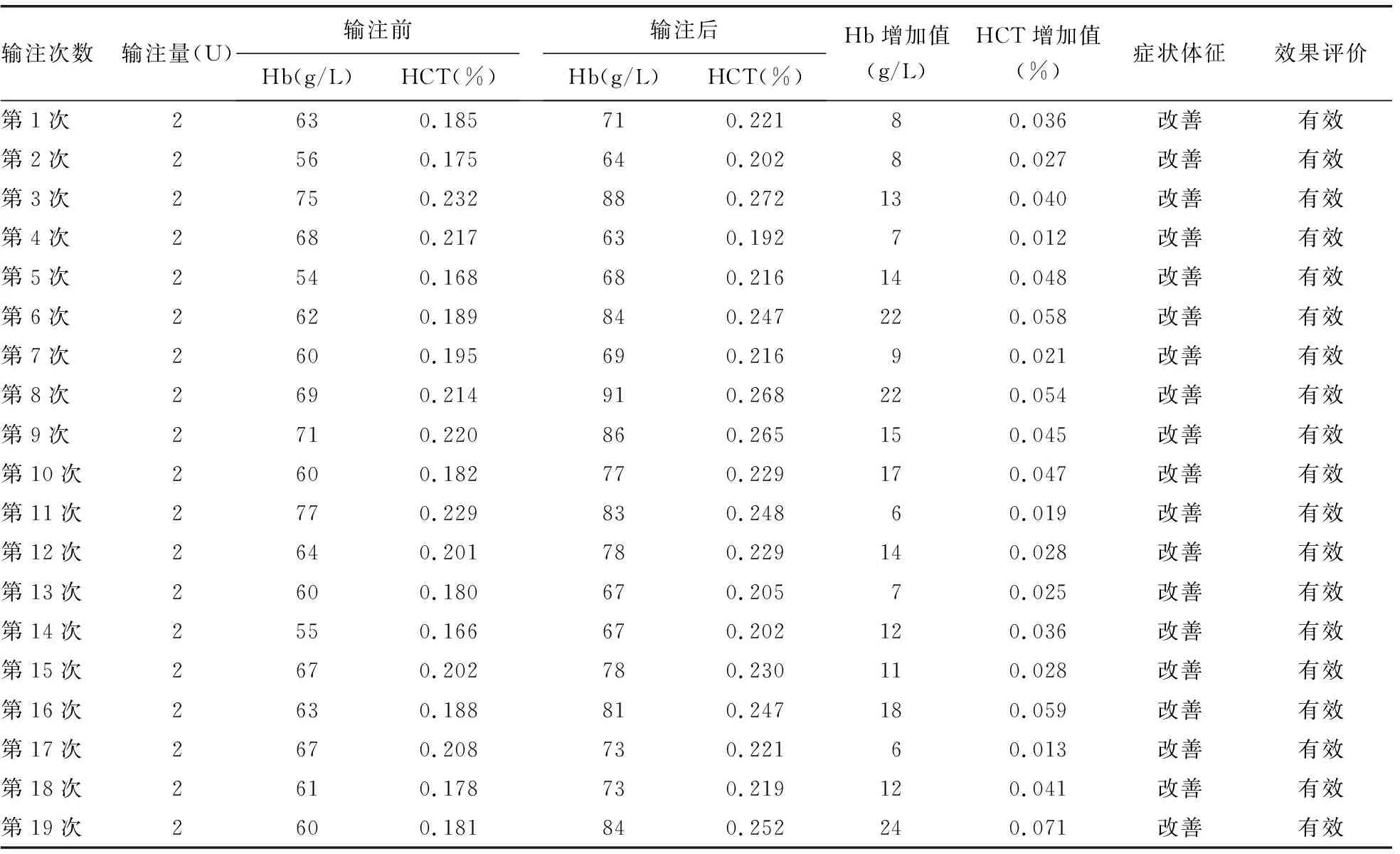
表6 病例2患者输注红细胞效果评价
3 讨 论
本研究中病例1和病例2患者使用CD38单抗治疗3 d后开始输血相容性检测,ABO及RhD血型检测不受影响,符合DE VOOGHT等[8]报道的CD38抗原与抗CD38单抗的结合不影响患者ABO和RhD血型鉴定;直接抗球蛋白实验由用药前阴性转为阳性,病例1患者呈1+凝集,病例2患者呈±凝集,由于CD38单抗药物治疗疾病时会结合到患者红细胞表面,而红细胞表面有不同程度表达的CD38抗原分子[3-5],导致了DAT-IgG不同程度的阳性,符合SULLIVAN等[9]研究表明。
交叉配血和不规则抗体筛选实验时,CD38单抗会结合到献血者和筛选红细胞表面,干扰交叉配血实验主侧和不规则抗体检测[10-11]。本研究中交叉配血试验同时采用微柱凝胶法和凝聚胺法,微柱凝胶法主侧结果均为2+凝聚,凝聚胺法主侧为无凝集,说明凝聚胺试验对CD38相关的抗原-抗体反应不敏感,符合YEH等[12]报道的CD38单抗不干扰凝聚胺试验。也可以解释为在低离子环境下,CD38分子在胞外携带负电荷的羧基,极易与凝聚胺分子结合,进而干扰CD38分子与CD38单抗的结合。所以当患者需要紧急输血时,没有足够的时间解决CD38单抗引起的凝集,可选择凝聚胺法进行交叉配血试验,同时参考用药前的抗体筛选结果,发放经凝聚胺法交叉配血相合的献血者红细胞即可。有条件的实验室可对患者进行Rh血型分型,发放经凝聚胺法交叉配血相合且Rh表型与患者相匹配的献血者红细胞,可最大限度降低致敏和同种抗体产生的风险[13]。
本报道中处理献血者红细胞和抗筛红细胞的方法参考文献[14]的操作标准,因国内尚无0.2 mol/L的二硫苏糖醇(DTT)商品试剂,本实验室无法获得此试剂,考虑2-Me和DTT都属于还原剂,故采用市售0.2 mol/L的2-Me处理红细胞。病例1和病例2患者输注经2-Me处理后微柱凝胶法交叉配血相合的红细胞后,均无溶血等输血不良反应。本研究显示,每输注2 U红细胞后Hb及HCT值均有增加,偶有Hb增加低于10 g/L,分析其原因可能与病例1和病例2患者输液导致血液稀释有关,随访发现其症状和体征均有改善,故综合判断输注有效。说明经0.2 mol/L的2-Me处理红细胞配血相合后可安全输注给经DARA治疗的患者,符合邵林楠等[15]提出的0.2 mol/L DTT与0.2 mol/L的2-Me去除红细胞表面CD38抗原效果基本一致,无DTT试剂时可以用2-Me替代,也符合糜坚青等[13]制订的2-Me处理红细胞的制备和检测流程。
本报道中处理后的红细胞主侧交叉配血都会呈轻微溶血反应,糜坚青等[13]提出该溶血是由2-Me试剂引起,并非不规则抗体的作用,不同品牌2-Me会出现不同程度的溶血,应避免使用造成大量溶血的试剂。处理后的献血者红细胞行微柱凝胶法交叉配血,主侧部分呈弱凝集反应,这可能与试剂处理红细胞的能力、红细胞上CD38抗原数量、2-Me的浓度、2-Me与红细胞的比例、微柱凝胶卡的灵敏度有关,本文未做更深入的研究。0.2 mol/L的2-Me灭活红细胞过程中需多次洗涤及孵育,整个操作过程耗时较长,并非所有献血者都能相合,因此建议实验室在每次交叉配血试验时准备多份献血者红细胞平行处理,可缩短DARA治疗患者等待输血时间及减少试剂的消耗。
2-Me会使红细胞上的某些抗原反应性变性或减弱,在评估使用这些试剂的试验结果时,应考虑到这一点。已知2-Me能使红细胞表面的Kell血型抗原变性,由于东亚人群中Kell血型多态性单一,基本为K-k+型,K+血型的频率约为0.07%,一般不做Kell血型抗原检测[16],因此本研究未采取Kell血型抗原阳性为对照试验,采用3个阳性对照标本,分别为高频抗E抗体、抗JKa抗体、抗M抗体,选择包含以上3个对应抗原的抗筛细胞反应,处理细胞前后的试验结果一致,说明2-Me未破坏红细胞上的E抗原、JKa抗原、M抗原,证明2-Me处理红细胞方法有效。
与此同时,DARA治疗患者及其家属、护理人员、医生、输血科工作人员都需要了解CD38单抗药物治疗后对输血相容性检测的干扰及对输血治疗的影响。输血科工作人员在进行输血前审核时,应注意输血申请单上的临床诊断,当抗体筛选发现有非特异性凝集,需仔细查看患者的病例及用药史,并与临床医生充分沟通,及时选择正确的检测方法。
综上所述,使用0.2 mol/L的2-Me处理红细胞后再进行输血相容性检测,可消除CD38单抗的干扰,为CD38单抗治疗的患者提供安全有效的血液。

