肠易激综合征病人血清连蛋白、单核细胞趋化蛋白-1水平与肠道菌群、炎症反应及胃肠症状严重程度的相关性
王建刚,胡宜涛,杨兰艳
肠易激综合征(irritable bowelsyndrome,IBS)属于慢性功能性胃肠疾病,以反复发作的腹部不适、伴随大便性状和习惯的改变为主要临床特征,中国人群IBS 总患病率为6.5%[1]。IBS 发病机制复杂,多项研究发现,肠道微生态失衡、炎症介质异常表达在IBS 发生、发展、转归过程中始终发挥重要作用[2-3]。IBS 病人排便性状改变可能与紧密连接的结构和功能改变有关。血清连蛋白(Zonulin)可以调节细胞之间的紧密连接,并可以调节肠腔和血液之间的液体、大分子和白细胞的运动及防止微生物定殖[4]。单核细胞趋化蛋白-1(monocytechemotactic protein-1,MCP-1)为炎性反应重要的趋化因子,通过与靶细胞膜上相应受体结合,在炎症反应、肿瘤生成和发展、免疫性疾病发生等方面发挥生物学功能[5-7]。本文通过检测IBS 病人血清Zonulin、MCP-1水平,探讨其与肠道菌群、炎症反应及胃肠症状严重程度的相关性,以期为IBS 的临床诊断和治疗提供新的思路。
1 资料与方法
1.1 一般资料选取2017 年2 月至2020 年3 月云南省第三人民医院收治的92例IBS病人作为研究对象,其中男39 例,女53 例;年龄(37.57±5.76)岁,范围为25~50 岁;病程(6.85±1.19)年,范围为2 个月~12 年。依据IBS 诊断标准[8]将以上病人分为便秘型IBS(IBS-C)35 例(IBS-C 组),腹泻型IBS(IBS-D)57例(IBS-D 组)。纳入标准:①研究对象符合IBS诊断标准;②病人自愿参加本研究且签署同意书;③年龄≥18 岁。排除标准:①合并消化道器质性疾病、消化道出血及消化道手术史;②合并严重内科疾病、内分泌疾病或严重感染者;③近4 周内使用过微生态制剂、抗生素等药物者;④既往有精神意识障碍病史者。同时纳入同期于云南省第三人民医院体检的50例健康志愿者作为对照组。本研究符合《世界医学协会赫尔辛基宣言》相关要求。三组一般资料比较,见表1。
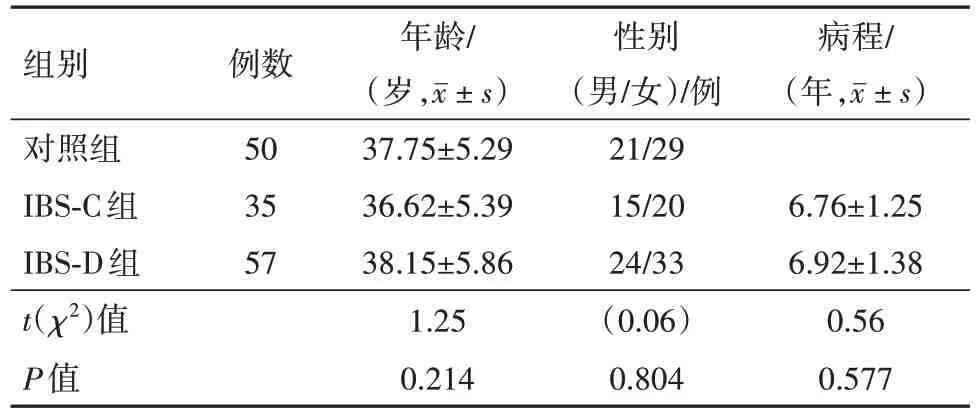
表1 肠易激综合征92例及对照组50例一般资料比较
1.2 方法 (1)抽取所有研究对象晨起空腹静脉血3 mL置于防凝管内,室温静置20 min,3 000 r/min 离心10 min 取上清液,置于低温(-80 ℃)保存。应用酶联免疫吸附法检测血清Zonulin、MCP-1、白介素-6(Interleukin-6,IL-6)、白介素-8(Interleukin-8,IL-8)、白细胞介-10(Interleukin-10,IL-10)水平,试剂盒均购自上海一研生物科技有限公司。(2)肠道菌群检测:应用光冈法对肠道双歧杆菌、乳杆菌、肠杆菌、肠球菌进行培养,方法如下:无菌棉签取适量中段新鲜的粪便5 g,加入5 mL厌氧稀释液均匀,按10倍稀释法连续稀释至10-9,选择合适的稀释度分别接种于不同培养基中,每种稀释度接种3 个平板。肠球菌采用需氧培养基培养,双歧杆菌、乳杆菌、肠杆菌采用厌氧培养基培养。取3个平板上菌落的平均数,计算出每克标本中的菌含量。(3)IBS 临床症状严重程度评分系统(IBS clinical symptom severity score system,IBS-SSS)从腹痛程度、频率、腹胀程度、排便满意度及对生活的影响5 个方面评估IBS 病人症状严重程度,评分越高,症状越严重[9]。
1.3 统计学方法数据应用SPSS 20.0 统计学软件分析。计量资料以±s表示,三组方差齐性的组间比较采用单因素方差分析+LSD法,两组间比较采用独立样本t检验。计数资料以例(%)表示,采用χ2检验。采用Pearson 相关性分析检验两变量关联程度。检验水准为α=0.05。
2 结果
2.1 三组间Zonulin、MCP-1 水平比较 IBS-C、IBS-D 病人血清Zonulin 水平、MCP-1 水平较对照组高(P<0.05),IBS-D 组病人血清MCP-1 水平高于IBS-C组(P<0.05)。见表2。
表2 肠易激综合征92例及对照组50例血清连蛋白(Zonulin)、单核细胞趋化蛋白-1(MCP-1)水平比较/±s
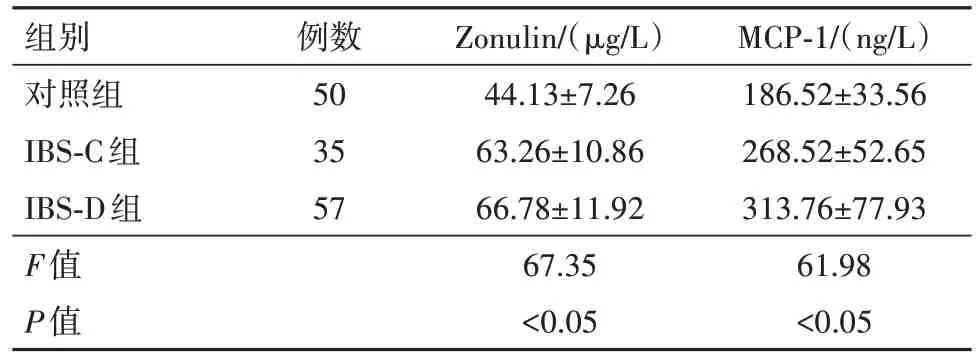
表2 肠易激综合征92例及对照组50例血清连蛋白(Zonulin)、单核细胞趋化蛋白-1(MCP-1)水平比较/±s
组别对照组IBS-C组IBS-D组F值P值例数50 35 57 Zonulin/(µg/L)44.13±7.26 63.26±10.86 66.78±11.92 67.35<0.05 MCP-1/(ng/L)186.52±33.56 268.52±52.65 313.76±77.93 61.98<0.05
2.2 不同分组间肠道菌群、炎症反应及胃肠症状严重程度比较 IBS-D 组乳杆菌、双歧杆菌含量低于对照组和IBS-C 组,肠杆菌、肠球菌含量高于对照组和IBS-C 组(P<0.05),IBS-C 组乳杆菌、双歧杆菌含量低于对照组,肠杆菌含量高于对照组(P<0.05);IBS-D 组IL-6、IL-8 水平高于对照组和IBS-C 组,IL-10水平低于对照组和IBS-C组(P<0.05),IBS-C组IL-6、IL-8 水平高于对照组(P<0.05);IBS-C 组和IBS-D 组IBS-SSS 评分差异无统计学意义(P>0.05)。见表3。
表3 肠易激综合征92例及对照组50例肠道菌群、炎症反应及胃肠症状严重程度比较/±s

表3 肠易激综合征92例及对照组50例肠道菌群、炎症反应及胃肠症状严重程度比较/±s
指标乳杆菌/(CFU/g)双歧杆菌/(CFU/g)肠杆菌/(CFU/g)肠球菌/(CFU/g)IL-6/(ng/L)IL-8/(ng/L)IL-10/(ng/L)IBS-SSS评分系统/分对照组(n=50)8.21±1.28 7.83±1.31 7.42±0.83 6.87±0.71 9.82±2.56 29.68±6.73 40.26±8.43 IBS-C组(n=35)6.96±0.98 7.02±1.15 8.18±0.92 7.02±0.86 16.59±4.63 38.93±10.25 36.71±7.29 275.26±82.63 IBS-D组(n=57)5.73±0.87 5.96±0.97 9.36±0.81 8.23±1.21 25.62±5.39 62.57±13.68 18.26±3.85 293.65±90.18 F值73.36 35.97 71.56 30.25 174.49 130.77 166.41 0.97 P值<0.05<0.05<0.05<0.05<0.05<0.05<0.05 0.334
2.3 Zonulin、MCP-1与肠道菌群、炎性因子及胃肠症状严重程度相关性比较 Pearson 相关分析显示,IBS-C 组中血清Zonulin 水平与乳杆菌、双歧杆菌含量呈负相关(P<0.05);IBS-D 组中血清Zonulin 水平与乳杆菌、双歧杆菌含量呈负相关(P<0.05),Zonulin水平与肠杆菌含量、MCP-1 水平、IBS-SSS 评分呈正相关(P<0.05),MCP-1 水平与乳杆菌及双歧杆菌含量、IL-10 水平呈负相关(P<0.05),与IL-6 及IL-8 水平、IBS-SSS评分呈正相关(P<0.05)。见表4。

表4 Zonulin、MCP-1与肠道菌群、炎性因子及胃肠症状严重程度相关性比较
3 讨论
随着人们生活节奏的改变,IBS 发病率逐年上升,严重影响人们的身心健康和生活质量,现有研究认为IBS 的发生可能与精神心理压力、胃肠道动力异常、内脏高灵敏度、肠道免疫和炎症反应、“脑-肠-菌”轴失调、肠道微生态环境改变等因素有关[10]。炎症反应在IBS 发生发展中的作用也日渐受到关注,促炎的细胞因子水平升高和抑炎的细胞因子分泌不足可能影响IBS的临床表现和病程。Zonulin是可调节肠道屏障功能的生理性蛋白,可通过调控肠道紧密连接蛋白表达及分布而影响肠壁通透性、肠壁组织的机械屏障、细菌移位及全身炎症[11]。本研究结果显示,IBS 病人血清Zonulin 水平显著高于对照组,提示IBS 病人出现明显的结肠屏障作用异常,紧密连接蛋白表达降低,同时伴随血清Zonulin 水平显著增高。Singh 等[12]的研究结果显示,IBS 病人血清Zonulin 水平上调,且在IBS-C 和IBS-D 病人中,其血清Zonulin水平均与排便习惯和频率有关,这与本研究结论存在一定差异,推测可能是由于东西方人种的体质不同。MCP-1 作为CC 趋化因子家族中的一员,是参与免疫细胞募集、成熟和激活的重要介质,能诱导IL-2、IL-6 或细胞黏附分子的合成,MCP-1 表达上调可诱发细胞凋亡,损伤组织。有研究发现[13],MCP-1可诱导促炎性巨噬细胞募集,诱导调节其他炎性因子的产生与释放,启动低度炎症级联反应,导致肠道炎性损伤。在IBS 病人血清中MCP-1水平上升,且IBS-D 病人血清MCP-1 水平高于IBS-C病人,MCP-1 黏附于内皮细胞,有利于单核细胞移动、黏附迁移及诱导单核细胞转化为巨噬细胞。巨噬细胞本身也可合成与分泌MCP-1,进一步增加血清中MCP-1 的水平。Chira 等[14]的研究显示,IBS-D病人血清MCP-1 水平明显高于健康者和IBS-C 病人,可能与脂质过氧化或氧化应激有关的低度炎症在IBS的发病机制中的作用相关。
肠道微生态异常在IBS 的发生及发展中起到较为重要作用。肠道菌群紊乱导致肠道黏膜屏障被破坏,肠道动力学变化,内脏灵敏度过敏,可直接或通过菌群代谢产物间接调节炎症反应[15],导致病人腹胀、腹痛、消化不良等诸多不适感。本研究中,与对照组相比,IBS-C 和IBS-D 病人的乳杆菌和双歧杆菌含量明显降低,且IBS-D 组低于IBS-C 组,肠杆菌含量明显增高,且IBS-D 组高于IBS-C 组,这些研究结果均提示IBS 病人肠道菌群发生了改变,益生菌含量减少,致病菌含量增多,从而影响了正常的肠黏膜屏障结构和免疫防御功能。不同亚型IBS 病人的肠道目标菌群水平也不同,这可能与不同亚型IBS 发病机制不同有关。胡乐义等[16]分析50 例IBS病人和25例健康志愿者肠道菌群变化,与对照组相比,IBS-D 病人肠杆菌含量明显增加,双歧杆菌及乳杆菌含量明显减少,IBS-C 病人肠杆菌、双歧杆菌及乳杆菌含量无明显变化。以上结果与本研究结果存在一定差异,这可能与纳入的研究对象饮食习惯、经济条件、生活环境存在差异有关。
作为炎性细胞因子,IL-6、IL-8 和IL-10 通过不同的途径在机体的炎症过程中发挥作用。IBS 病人的免疫调节因子(包括促炎和抗炎细胞因子)也发生了改变,促炎细胞因子,如IL-6、IL-8 水平升高,抑炎因子IL-10 水平降低[17]。实验结果显示在IBS 病人,尤其是IBS-D 病人血清的IL-6、IL-8 表达增加,IL-10表达减低,推测促炎因子和抑炎因子的失衡促进了炎症的发生、发展和持续存在,导致局部肠组织损伤,最终表现出IBS-D 的临床症状,进一步证实了炎症和免疫异常在IBS-D 发病机制中起重要作用。IBS-C 组与对照组相比IL-10 水平无明显变化,但IL-6、IL-8 水平高于对照组且低于IBS-D 组,推测IBS-C 病人免疫系统紊乱和炎症反应程度较低,亦进一步说明在IBS 的不同分型存在不同的病理生理学机制,同时也提示不同亚型IBS 病人需要选取不同的药物治疗方案。
肠道紧密连接蛋白、肠道菌群的改变和肠道炎症反应相互影响、互为因果,从不同角度影响IBS 的发生、发展和转归。本文研究结果显示,对于IBS-D病人,血清Zonuli水平与乳杆菌、双歧杆菌含量呈负相关,与IBS-SSS 评分呈正相关;血清MCP-1 水平与乳杆菌、双歧杆菌含量及IL-10 水平呈负相关,与IL-6、IL-8、MCP-1 水平呈正相关。而对于IBS-C 病人,血清MCP-1 与乳杆菌、双歧杆菌含量呈负相关。肠道菌群通过调节肠道紧密连接蛋白和炎症反应来影响肠道屏障功能。有动物研究显示,益生菌可通过改善紧密连接相关蛋白从而恢复肠上皮细胞间紧密连接结构的完整性,达到改善肠道的通透性、保护肠道机械屏障的目的;同时通过调控TLR4-NF-κB 信号通路及细胞因子平衡调节免疫屏障,减轻肠道细菌移位及慢性炎症反应[18]。Moser等[19]研究显示,IBS-D 病人口服合生元治疗,随着治疗进展,病人血清Zonulin水平降低,IBS疾病严重程度也相应减轻。柯少雄等[20]研究显示,IBS-D 病人肠道菌群的紊乱在肠道慢性、低级别炎症的形成和维持中起着关键作用。对于IBS病人,尤其IBS-D病人,MCP-1、Zonulin 与肠道菌群、炎症反应及疾病严重程度相关,提示二者有希望作为临床IBS 诊断和疗效评价的辅助指标。
综上所述,IBS 病人血清Zonulin、MCP-1 水平明显增高,对于IBS 病人,尤其IBS-D 病人,MCP-1、Zonulin 与肠道菌群、炎症反应及疾病严重程度相关,这些结果有助于阐明IBS 病人肠道中改变的菌群结构、肠道屏障相关蛋白、血清中的细胞因子与炎症因子在IBS中的作用机制,对于IBS的诊断和疗效评价具有一定指导意义。

