蜂斗菜素对宫颈癌细胞增殖、细胞周期和凋亡的影响
谢玲玲
宫颈癌是全球妇女第四大常见恶性肿瘤,其转移性导致患者预后较差,手术和放化疗是其主要治疗方式[1-2]。中医在癌症的治疗中一直发挥着重要作用,研究表明,中药可联合化疗治疗局部晚期宫颈癌,提升病人生存质量,降低化疗不良反应[3]。
蜂斗菜素是菊科蜂斗菜属植物的有效成分之一,具有抗炎症、解痉挛的疗效,还有潜在的抗癌活性[4]。研究表明,蜂斗菜素可抑制人神经母细胞瘤细胞、胃癌细胞增殖和诱导细胞凋亡[5-6]。蜂斗菜素对宫颈癌是否有抑制作用尚不清楚。丝/苏氨酸蛋白激酶(AKT)信号通路在宫颈癌细胞的增殖、凋亡等过程中具有重要调节作用[7]。本研究自2019 年3—10 月以宫颈癌细胞系Siha 为主要研究对象,假设蜂斗菜素通过AKT 信号通路调节宫颈癌细胞周期、增殖及凋亡,并对其进行验证。以期为宫颈癌的治疗提供新的思路。
1 材料与方法
1.1 材料人宫颈癌细胞系SiHa 购自美国ATCC;DMEM 高糖培养液培养基胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司,蜂斗菜素(批次20181005)购自西安天瑞生物技术有限公司;四氮唑蓝(thiazolyl blue tetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、AKT信号通路激活剂IGF-1、胰蛋白酶购自美国Sigma-Aldrich 公司;CCK-8 试剂盒、细胞周期和细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;抗体、细胞周期蛋白D1(cyclin D1)抗体、细胞周期蛋白依赖性激酶2(CDK2)抗体、活化的半胱氨酸天冬氨酸蛋白酶3(Cleaved-caspase-3)抗体、活化的半胱氨酸天冬氨酸蛋白酶9(Cleaved-caspase-9)抗体、磷脂酰肌醇3-激酶(PI3K)抗体、p-PI3K 抗体、AKT 抗体、p-AKT 抗体和β 肌动蛋白(β-actin)抗体购自英国Abcam;流式细胞仪购自美国BD 公司,全自动酶标仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养在DMEM 高糖培养液中培养人宫颈癌SiHa 细胞,培养液中添加10% FBS、100 U/mL 青霉素和100 mg/L 链霉素,培养条件:在湿度95%,37 ℃5%二氧化碳培养箱中培养细胞,隔天换一次培养液,消化传代,收集对数生长期细胞进行实验。
1.2.2 四甲基偶氮唑盐比色法(MTT)测定在蜂斗菜素处理后SiHa 细胞的活性取对数生长期的SiHa细胞,胰蛋白酶消化细胞,培养基稀释细胞,以浓度2×103个细胞/孔(200µL 细胞)接种于96 孔板,在培养24 h 后加入不同终浓度(5、15、45µmol/L)的蜂斗菜素(实验组)和空白培养液(对照组),分别在培养至24、48 和72 h 时进行MTT 实验,加入20 µL(5 g/L)MTT 溶液,培养4 h,弃培养上清,每孔加入150µL DMSO,室温振荡10 min 溶解结晶,酶标仪检测490 nm处的吸光度(A)值。
1.2.3 流式细胞术检测细胞周期和凋亡率用胰蛋白消化对数生长期的SiHa 细胞,以浓度5×105个细胞/孔接种于6 孔板,培养48 h 后加入不同终浓度(5、15、45µmol/L)的蜂斗菜素(实验组)和空白培养液(对照组),继续培养48 h 后收集细胞,根据细胞周期检测试剂盒和细胞凋亡检测试剂盒说明书,分别上流式细胞仪检测并计算各组G0~G1期、S 期、G2~M期细胞百分比及细胞凋亡率。
1.2.4 蛋白质印迹法(Western blotting)实验收集经5、15、45 µmol/L 的蜂斗菜素培养48 h 的SiHa 细胞,加入RIPA 裂解液裂解细胞并超声破碎,收集上清,检测蛋白浓度。将蛋白样本进行SDS-PAGE,转PVDF 膜,脱脂奶粉室温封闭2 h,分别加入一抗,cyclinD1 抗体(1∶3 000)、CDK2 抗体(1∶2 000)、Cleaved caspase-3 抗体(1∶1 000)、Cleaved caspase-9抗体(1∶1 500)、p-PI3K 抗体(1∶1 000)、PI3K 抗体(1∶1 000)、p-AKT 抗体(1∶1 000)、AKT 抗体(1∶1 000)和抗β-actin 抗体(1∶5 000),4 ℃过夜孵育。洗膜3次,然后加入稀释的酶标二抗,室温条件孵育2 h,显影拍照。以β-actin为内参照,分析蛋白水平。
1.3 统计学方法用SPSS 19.0 软件进行数据统计分析。满足正态分布的定量资料用±s表示,非正态分布数据采用中位数(下、上四分位数)[M(P25,P75)]表示,两组比较采用独立样本t检验;多组间比较采用单因素方差分析,进一步地两两比较采用LSD 法,不同浓度时间点间交互作用指标采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度蜂斗菜素对宫颈癌SiHa 细胞增殖的影响用5、15、45 µmol/L 的蜂斗菜素处理宫颈癌SiHa细胞,结果发现在24、48和72 h细胞OD值均显著降低,在45 µmol/L 浓度和72 h 时抑制率达到最高,呈浓度和时间依赖性(P<0.05),细胞活力(OD490)在不同浓度、不同时间点间、浓度×时间均差异有统计学意义(F浓度=69.84,P浓度<0.001;F时间=36.87,P时间<0.001;F浓度×时间=26.56,P浓度×时间<0.001);见表1。
表1 不同浓度的蜂斗菜素对宫颈癌细胞SiHa活力的影响/±s
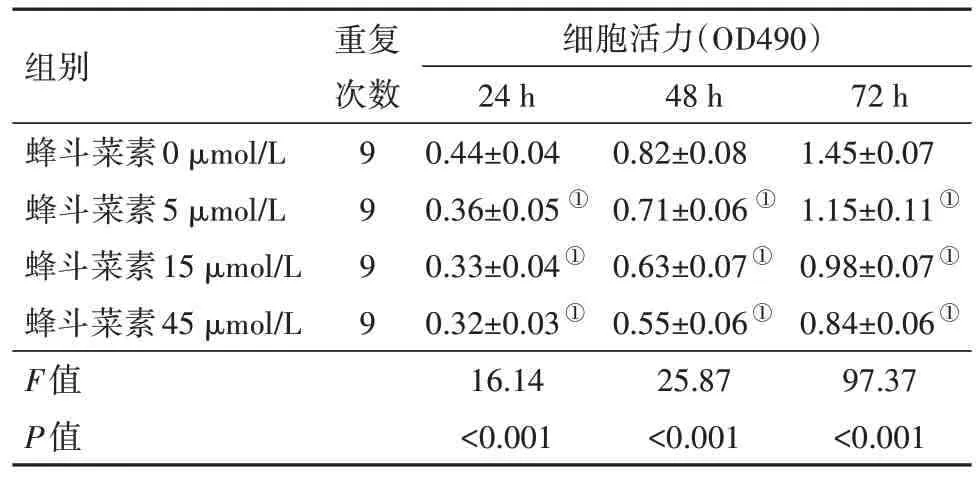
表1 不同浓度的蜂斗菜素对宫颈癌细胞SiHa活力的影响/±s
注:①与蜂斗菜素0µmol/L组相比较,P<0.05。
组别蜂斗菜素0µmol/L蜂斗菜素5µmol/L蜂斗菜素15µmol/L蜂斗菜素45µmol/L F值P值重复次数9 999细胞活力(OD490)24 h 0.44±0.04 0.36±0.05 ①0.33±0.04①0.32±0.03①16.14<0.001 48 h 0.82±0.08 0.71±0.06 ①0.63±0.07①0.55±0.06①25.87<0.001 72 h 1.45±0.07 1.15±0.11①0.98±0.07①0.84±0.06①97.37<0.001
2.2 不同浓度蜂斗菜素对宫颈癌细胞周期的影响与蜂斗菜素0 µmol/L 相比,蜂斗菜素5 µmol/L组、15 µmol/L 组和45 µmol/L 组的SiHa 细胞中cyclin D1 和CDK2 表达量均降低(P<0.05),G0~G1期细胞百分比显著升高(P<0.05),S 期细胞百分比显著降低(P<0.05),G2~M期细胞百分比变化不显著(P>0.05),见图1和表2。
表2 不同浓度的蜂斗菜素对宫颈癌SiHa细胞中细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性激酶2(CDK2)蛋白表达和细胞周期的影响/±s
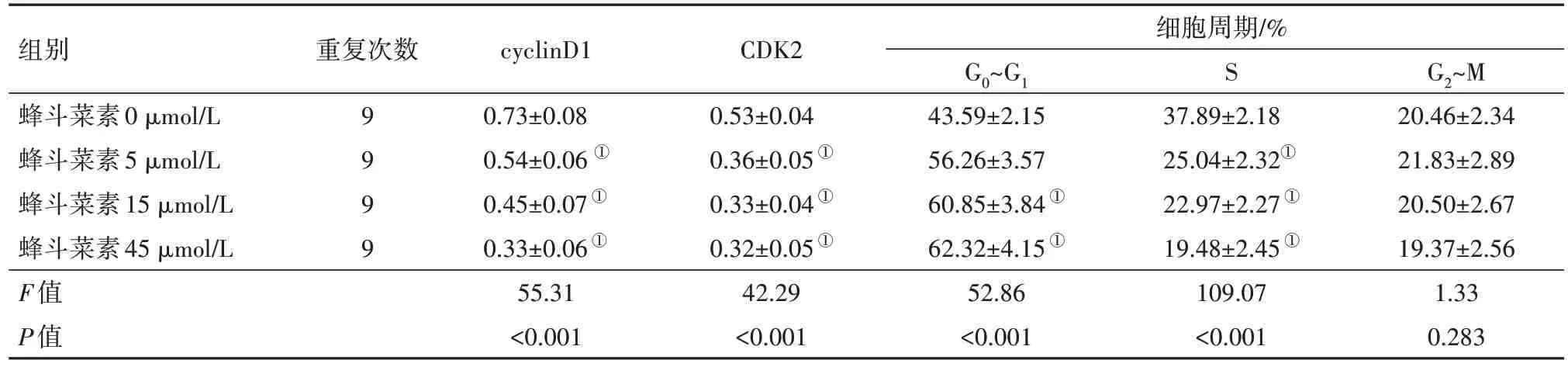
表2 不同浓度的蜂斗菜素对宫颈癌SiHa细胞中细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性激酶2(CDK2)蛋白表达和细胞周期的影响/±s
注:①与蜂斗菜素0µmol/L组相比较,P<0.05。
组别蜂斗菜素0µmol/L蜂斗菜素5µmol/L蜂斗菜素15µmol/L蜂斗菜素45µmol/L F值P值重复次数9 999 cyclinD1 0.73±0.08 0.54±0.06 ①0.45±0.07①0.33±0.06①55.31<0.001 CDK2 0.53±0.04 0.36±0.05①0.33±0.04①0.32±0.05①42.29<0.001细胞周期/%G0~G1 43.59±2.15 56.26±3.57 60.85±3.84①62.32±4.15①52.86<0.001 S 37.89±2.18 25.04±2.32①22.97±2.27①19.48±2.45①109.07<0.001 G2~M 20.46±2.34 21.83±2.89 20.50±2.67 19.37±2.56 1.33 0.283
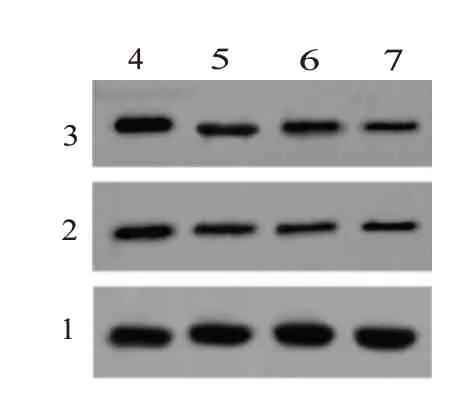
图1 蛋白质印迹法检测cyclinD1和CDK2蛋白的表达
2.3 不同浓度蜂斗菜素对宫颈癌细胞凋亡的影响与蜂斗菜素0 µmol/L 相比,蜂斗菜素5 µmol/L组、15 µmol/L 组和45 µmol/L 组的SiHa 细胞中Cleaved caspase-3 和Cleaved caspase-9 蛋白表达量均升高(P<0.05),细胞凋亡率也显著升高(P<0.05),见图2和表3。
表3 不同浓度的蜂斗菜素对宫颈癌细胞SiHa凋亡的影响/±s
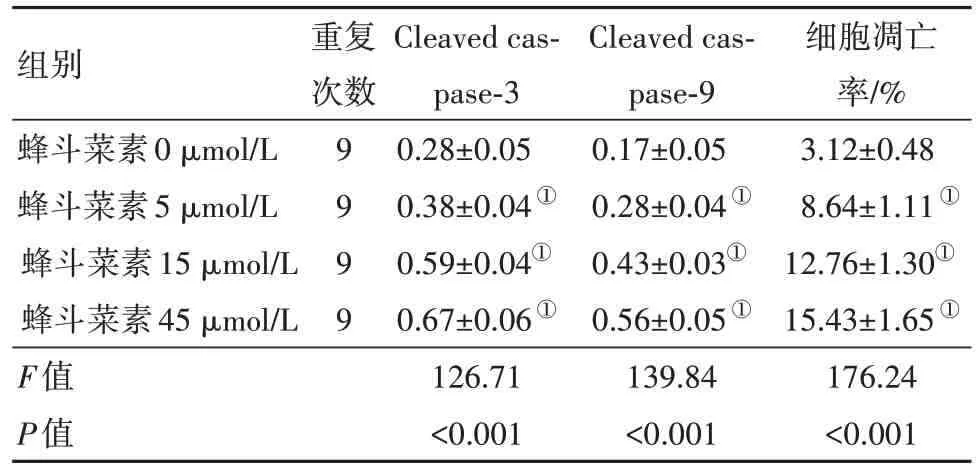
表3 不同浓度的蜂斗菜素对宫颈癌细胞SiHa凋亡的影响/±s
注:Cleaved-caspase-9 为活化的半胱氨酸天冬氨酸蛋白酶9;Cleaved-caspase-3为活化的半胱氨酸天冬氨酸蛋白酶3。①与蜂斗菜素0µmol/L组相比较,P<0.05。
组别蜂斗菜素0µmol/L蜂斗菜素5µmol/L蜂斗菜素15µmol/L蜂斗菜素45µmol/L F值P值重复次数9999 Cleaved caspase-3 0.28±0.05 0.38±0.04①0.59±0.04①0.67±0.06①126.71<0.001 Cleaved caspase-9 0.17±0.05 0.28±0.04①0.43±0.03①0.56±0.05①139.84<0.001细胞凋亡率/%3.12±0.48 8.64±1.11①12.76±1.30①15.43±1.65①176.24<0.001
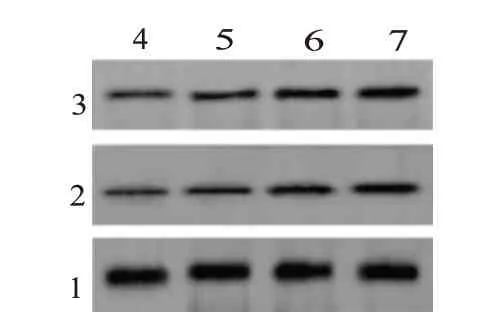
图2 蛋白质印迹法检测Cleaved caspase-3和Cleaved caspase-9蛋白表达
2.4 不同浓度蜂斗菜素对宫颈癌细胞AKT 信号通路的影响与蜂斗菜素0 µmol/L 相比,蜂斗菜素5µmol/L 组、15µmol/L 组和45µmol/L 组的SiHa 细胞中p-PI3K 和p-AKT 蛋白表达量均显著降低(P<0.05),PI3K 和AKT 蛋白含量无显著变化,见图3和表4。
表4 不同浓度的蜂斗菜素对宫颈癌细胞AKT信号通路的影响/±s

表4 不同浓度的蜂斗菜素对宫颈癌细胞AKT信号通路的影响/±s
注:PI3K 为磷脂酰肌醇3-激酶,AKT 为丝/苏氨酸蛋白激酶,p-AKT 为磷酸化的丝/苏氨酸蛋白激酶。①与蜂斗菜素0µmol/L 组相比较,P<0.05。
组别蜂斗菜素0µmol/L蜂斗菜素5µmol/L蜂斗菜素15µmol/L蜂斗菜素45µmol/L F值P值重复次数9999 p-PI3K 0.52±0.04 0.43±0.03①0.32±0.05①0.18±0.03①131.14<0.001 PI3K 0.43±0.04 0.41±0.05 0.44±0.04 0.40±0.05 1.46 0.243 p-AKT 0.63±0.05 0.38±0.06①0.27±0.05①0.14±0.04①152.59<0.001 AKT 0.52±0.05 0.54±0.06 0.51±0.05 0.53±0.06 0.49 0.691
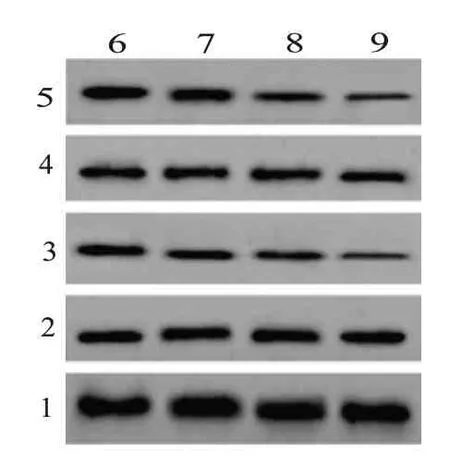
图3 不同浓度蜂斗菜素对宫颈癌细胞AKT信号通路的影响
2.5 AKT 信号通路激活剂部分逆转蜂斗菜素对宫颈癌细胞的抑制作用用45 µmol/L 蜂斗菜素和AKT 信号通路激活剂IGF-1 处理SiHa 细胞,结果发现,IGF-1 可促进AKT 信号通路蛋白p-PI3K 和p-AKT的表达,SiHa细胞在24、48和72 h时细胞OD值均显著升高(P<0.05),见图4和表5。
表5 AKT信号通路激活剂IGF-1和蜂斗菜素对宫颈癌SiHa细胞AKT信号通路和细胞增殖的影响/±s
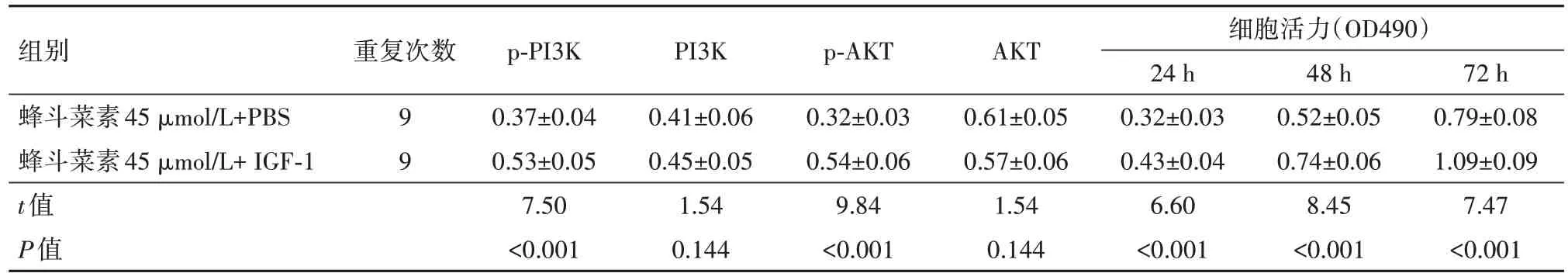
表5 AKT信号通路激活剂IGF-1和蜂斗菜素对宫颈癌SiHa细胞AKT信号通路和细胞增殖的影响/±s
注:PI3K为磷脂酰肌醇3-激酶,AKT为丝/苏氨酸蛋白激酶,p-AKT为磷酸化的丝/苏氨酸蛋白激酶。
组别蜂斗菜素45µmol/L+PBS蜂斗菜素45µmol/L+IGF-1 t值P值重复次数99 p-PI3K 0.37±0.04 0.53±0.05 7.50<0.001 PI3K 0.41±0.06 0.45±0.05 1.54 0.144 p-AKT 0.32±0.03 0.54±0.06 9.84<0.001 AKT 0.61±0.05 0.57±0.06 1.54 0.144细胞活力(OD490)24 h 0.32±0.03 0.43±0.04 6.60<0.001 48 h 0.52±0.05 0.74±0.06 8.45<0.001 72 h 0.79±0.08 1.09±0.09 7.47<0.001

图4 AKT信号通路激活剂部分逆转蜂斗菜素对宫颈癌细胞的抑制作用
2.6 AKT 信号通路激活剂和蜂斗菜素对宫颈癌Si-Ha细胞周期和凋亡的作用与蜂斗菜素45µmol/L+PBS组相比,蜂斗菜素45µmol/L+IGF-1组SiHa细胞中增殖相关蛋白cyclinD1 和CDK2 表达量显著升高,凋亡蛋白Cleaved caspase-3 和Cleaved caspase-9表达均降低,细胞凋亡率降低,G0~G1 期细胞百分比显著降低,S 期细胞百分比显著升高,均差异有统计学意义(P<0.05),见图5和表6。
表6 丝/苏氨酸蛋白激酶(AKT)信号通路激活剂IGF-1和蜂斗菜素对宫颈癌SiHa细胞增殖、凋亡和细胞周期的影响/±s
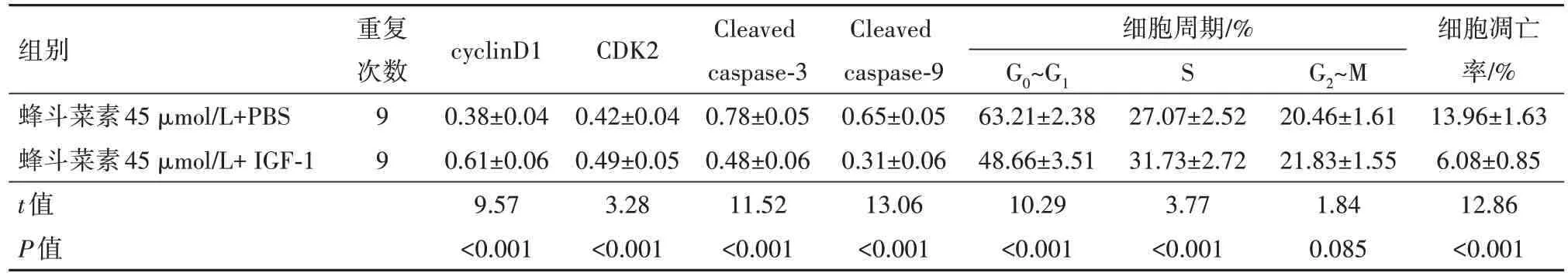
表6 丝/苏氨酸蛋白激酶(AKT)信号通路激活剂IGF-1和蜂斗菜素对宫颈癌SiHa细胞增殖、凋亡和细胞周期的影响/±s
注:cyclin D1为细胞周期蛋白D1,CDK2为细胞周期蛋白依赖性激酶2,Cleaved-caspase-3为活化的半胱氨酸天冬氨酸蛋白酶3。
组别蜂斗菜素45µmol/L+PBS蜂斗菜素45µmol/L+IGF-1 t值P值重复次数99 cyclinD1 0.38±0.04 0.61±0.06 9.57<0.001 CDK2 0.42±0.04 0.49±0.05 3.28<0.001 Cleaved caspase-3 0.78±0.05 0.48±0.06 11.52<0.001 Cleaved caspase-9 0.65±0.05 0.31±0.06 13.06<0.001细胞周期/%G0~G1 63.21±2.38 48.66±3.51 10.29<0.001 S 27.07±2.52 31.73±2.72 3.77<0.001 G2~M 20.46±1.61 21.83±1.55 1.84 0.085细胞凋亡率/%13.96±1.63 6.08±0.85 12.86<0.001

图5 IGF-1和蜂斗菜素对宫颈癌SiHa细胞中增殖及凋亡相关蛋白表达的影响
3 讨论
在发展中国家,每年大约有25万多人死于宫颈癌;宫颈癌病人确诊时多为晚期,病人治疗效果差,化疗的副作用导致病人生存质量低[8]。研究表明,多种中药(黄芪提取物和萹蓄提取物等)均对宫颈癌HeLa 细胞具有抑制作用[9-10],中药联合放化疗的综合治疗方法可有效提高病人机体免疫功能,降低不良反应,提高病人生存质量[11]。
蜂斗菜素是药食两用蜂斗菜的有效活性成分之一,有抗炎、解痉、抗癌活性。研究表明,蜂斗菜素可通过AKT/mTOR 通路抑制人结肠癌细胞系SW-620 的增殖,诱导细胞凋亡,抑制细胞的迁移和侵袭[12]。蜂斗菜素可抑制骨髓瘤细胞增殖并诱导细胞凋亡[13]。蜂斗菜素也对神经母细胞瘤细胞具有增殖抑制作用和周期阻滞作用,促进细胞凋亡[14]。蜂斗菜素对宫颈癌是不是也具有同样的抑制作用尚不清楚。本研究用5、15、45µmol/L蜂斗菜素处理宫颈癌SiHa细胞,通过检测发现,细胞OD 值随培养时间和蜂斗菜素浓度升高均逐渐降低,细胞凋亡率升高,呈浓度和时间依赖性,细胞中增殖蛋白cyclin D1、CDK2 含量降低,凋亡蛋白Cleaved caspase-3 和Cleaved caspase-9 含量升高,G0~G1期细胞百分比升高,S期细胞百分比降低,说明蜂斗菜素可使SiHa细胞停滞在G0~G1期,抑制细胞增殖并促进细胞凋亡,与上述研究结果[14]类似。本研究结果证实了蜂斗菜素对宫颈癌细胞具有抑制作用,但具体机制还有待研究。
AKT 信号通路在肿瘤的进展、转移及耐药性中都发挥重要作用,且AKT 信号通路蛋白AKT 和p-AKT 在宫颈癌组织中表达上调,导致AKT 通路异常激活[15]。多种药物包括白桦脂醇、顺铂等均可通过AKT 信号通路抑制宫颈癌细胞的增殖并促进细胞凋亡[16-17]。且蜂斗菜素可通过AKT/mTOR 通路抑制人结肠癌细胞[12],因此本研究假设蜂斗菜素通过AKT 信号通路抑制宫颈癌细胞。通过检测发现,蜂斗菜素处理后SiHa 细胞中p-PI3K 和p-AKT 蛋白含量均显著降低,说明AKT 信号通路被抑制;而AKT信号通路激活剂IGF-1 处理被蜂斗菜素抑制的SiHa细胞后p-PI3K 和p-AKT 含量升高,蜂斗菜素对SiHa细胞的抑制作用被部分逆转,说蜂斗菜素确实通过AKT信号通路抑制SiHa细胞。
综上所述,本研究阐述了蜂斗菜素可能通过AKT 信号通路阻滞宫颈癌SiHa 细胞周期停滞,抑制细胞增殖并促进细胞凋亡。蜂斗菜素对宫颈癌可能具有的潜在治疗作用。

