二磷酸腺苷核糖基化因子6对甲状腺乳头状癌细胞增殖和转移的影响
席羽,周冬梅,2,赵锛活,3,安军,李伟,2
甲状腺癌(thyroid cancer,TC)是内分泌系统最常见的恶性肿瘤,在全球恶性肿瘤发病率中排第9位[1-3]。甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是TC 中最常见的类型,约占所有甲状腺癌的80%[4-6]。二磷酸腺苷核糖基化因子6(ADP-ribosylation factor 6,ARF6)是Ras 超家族中的一个小分子GTP 结合蛋白,属于ARF 亚家族成员,在哺乳动物的组织中广泛表达并且具有高度保守性[7]。目前研究表明,ARF6 蛋白的活化和高表达与乳腺癌、胰腺癌、肺癌等多种肿瘤的侵袭转移密切相关[8]。然而ARF6在PTC中的作用尚未见报道。
2020年6月至2021年1月,本研究探讨了ARF6对PTC 细胞B-CPAP 增殖和转移能力的影响及其可能的信号通路。
1 材料与方法
1.1 细胞及试剂人甲状腺乳头状癌细胞株BCPAP 购自中国科学院细胞库;Control、shARF6、3×Flag-Vector 及3×Flag-ARF6 质粒购自湖南长沙优宝生物公司;RPMI-1640 细胞培养液购自武汉塞维尔公司;胎牛血清购自浙江天杭生物科技股份有限公司;EdU 试剂盒购自锐博生物;CCK-8试剂购自美国ApexBio 公司;Transwell 小室购自无锡耐思生物科技有限公司;ARF6、细胞外调节激酶1/2(ERK1/2)、p-ERK1/2、上皮型钙黏蛋白(E-cadherin)及基质金属蛋白酶-9(MMP-9)、β肌动蛋白(β-actin)抗体和相应二抗购自武汉三鹰生物技术有限公司;ECL 发光液购自武汉爱博泰克生物科技有限公司。
1.2 方法
1.2.1 细胞培养 B-CPAP 细胞使用含10%胎牛血清的RPMI-1640 培养基。细胞密度约80%时传代,吸弃细胞培养基,使用PBS 洗1 遍,加入0.25%胰酶消化液,细胞开始变圆后,除去胰酶,加入新鲜培养基进行吹打混匀,传代比例为1∶3。常规置于37 ℃,5%二氧化碳的细胞培养箱中进行培养。
1.2.2 ARF6 稳定转染细胞系的建立将ARF6 核心质粒和2 种辅助质粒按2∶1∶1 的比例共转染293T细胞,72 h 后收集上清慢病毒。利用试剂盒检测病毒滴度。将对数生长期的B-CPAP细胞铺于6孔板,密度50%,贴壁后加入适当慢病毒,同时按照1∶1 000 加入polybrene 侵染试剂,12 h 后换液,48 h 观察荧光,加入嘌呤霉素进行筛选,最终得到稳定表达Control和shARF6的细胞系。引物如下:
shARF6#1 正向引物:gatccGGAACAAGGAAATGCGGATCCTTCAAGAGAGGATCCGC-ATTTCCTT -GTTCCTTTTTTg;
shARF6#1 反向引物:aattcAAAAAAGGAACAAGGAAA-TGCGGATCCTCTCTTGAAGGATCCG -CATTTCCTTGTTCCg;
shARF6#2 正向引物:ga-tccGCAAGACAACAATCCTGTACATTCAAGAGATGTACAGGATT-GTTGTCTT-GCTTTTTTg;
shARF6#2 反向引物:aattcAAAAAAGCAAGACAACAATCCTGTACAT-CTCTTGAATGTACAG-GATTGTTGTCTTGCg;
shARF6#3 正向引物:gatccGGACGTA-GGATGAAGAGAAAGTTCAAGAGA-CTTTCTCTTCATCCTACGTCCTTTTTTg;
shARF6#3 反向引物:aattcAAAAAAGGACGTAGGATGAAGAGAAAGTCTCTTGAACTTTCTCTTCATCCTACGTCCg。
1.2.3 瞬时转染将对数生长期的细胞铺于6孔板中,密度约80%。取1.5 mL 无菌离心管加入100µL转染缓冲液,加入适量质粒后混匀。再取另一只1.5 mL 无菌离心管加入100µL 转染缓冲液,加入转染试剂后混匀,转染试剂体积(µL):质粒质量(µg)=3∶1。随后将两管中的液体融合混匀,室温静置20 min。随后加入到细胞中放入培养箱,6 h后换液。
1.2.4 蛋白质印迹法(Western blotting) 将提取的蛋白进行SDS-PAGE 电泳,电转后用3% BSA 封闭,在4 ℃环境下进行一抗孵育过夜(ARF6 浓度1∶1 000、ERK1/2 浓度1∶500、p-ERK1/2 浓度1∶500、E-cadherin 浓度1∶1 000、MMP-9 浓度1∶500、β-actin浓度1∶5 000),用1×TBST 清洗3 次,每次10 min,然后在室温下二抗孵育2 h(浓度1∶4 000),用1×TBST清洗3 次,每次10 min。最后在暗室进行底物反应,并通过化学发光系统检测目的蛋白的表达水平。灰度值通过Image J软件进行检测。
1.2.5 EdU 实验将对数生长期细胞以4×103~1×105细胞/孔接种于96 孔板。充分贴壁后EdU 试剂A标记2 h;弃培养基清洗后4%多聚甲醛固定细胞30 min,弃固定液;2 g/L 甘氨酸中和多聚甲醛5 min,弃甘氨酸;0.5% Triton-X-100 打孔10 min;清洗后用新鲜制备的Apollo 混合液避光染色30 min;0.5% Triton-X-100 清洗10 min;甲醇清洗5 min;1×Hoechst33342 反应液避光染核30 min;随后立即避光观测。
1.2.6 CCK-8 实验将对数生长期细胞以1×103~1×104细胞/孔接种到96 孔板,每孔体积200 µL,以完全培养基为对照,放入培养箱中培养。从第2 天起每天同一时间加入20 µL 的CCK-8 试剂,细胞培养箱中反应4 h。酶标仪于波长450 nm 检测光密度。
1.2.7 Transwell 实验在24 孔板中放入转移培养皿(Transwell,培养皿直径6.5 mm,微孔径8.0 µm),将基质胶Matrigel 铺在转移培养皿上室,凝固后取对数生长期的细胞重悬于无血清1640培养基中,调节浓度至1×106细胞/毫升,取100µL 细胞悬液加入上室,转移培养下室加600µL含10%的胎牛血清的1640 培养基。于37 ℃,5%二氧化碳细胞培养箱中孵育24 h。用棉签轻轻擦去膜上细胞,甲醇固定30 min,0.5%结晶紫染色5 min,在每张膜中央部分和周围部分各随机取3个视野拍摄,计数膜下细胞,以膜下细胞的数量多少表示侵袭能力。迁移实验为不添加基质胶Matrigel,其余步骤相同。
1.3 统计学方法采用SPSS 22.0 软件进行统计分析。计量资料用±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 ARF6 沉默细胞系的构建用Western blotting测定了3 种shARF6 质粒在293T 细胞中对ARF6 蛋白的沉默效率,shARF6#1、shARF6#2、shARF6#3 组的ARF6 蛋白表达水平分别为Control 组的(0.41±0.04)、(1.07±0.09)、(1.15±0.04),shARF6#1 组ARF6蛋白表达水平的降低差异有统计学意义(P<0.05)。因此,我们选择shARF6#1 质粒进行后续试验,通过慢病毒技术构建稳定沉默ARF6 的B-CPAP 慢病毒细胞系。通过荧光观察阳性细胞所占比例在80%以上;Western blotting 检测结果显示B-CPAPshARF6#1 细胞系中ARF6 的蛋白表达水平为对照组的(31.22±0.83)%,表明稳定沉默ARF6 的慢病毒细胞系构建成功。见图1。

图1 蛋白质印迹法(Western blotting)检测B-CPAP细胞中ARF6沉默细胞系的表达:A为检测三种沉默ARF6质粒的表达情况;B为检测B-CPAP细胞系的ARF6表达情况
2.2 沉默ARF6 抑制B-CPAP 细胞的增殖和转移EdU 实验结果显示,shARF6#1组EdU 阳性细胞的比例为(33.75±1.50)%,对照组为(39.65±2.21)%。将对照组标化为1 后进行统计,结果显示与对照组相比shARF6#1 组EdU 阳性细胞比例明显下降(P<0.05)。
CCK-8实验显示,在第1、2、3、4、5天,shARF6#1组的OD 值分别为(0.46±0.01)、(0.50±0.01)、(0.55±0.02)、(0.60±0.02)和(0.66±0.03),而对照组的OD值分别为(0.44±0.01)、(0.54±0.01)、(0.64±0.02)、(0.75±0.03)和(0.83±0.03)。将第一天吸光度标化为1 后进行统计可知,shARF6#1 组的增殖活性显著低于对照组(P<0.05)。
Transwell实验结果显示,shARF6#1组侵袭细胞数为(614.66±18.52)个,其对照组侵袭细胞数为(898.38±38.94)个。将对照组标化为1进行统计,结果显示shARF6#1 组的侵袭细胞数明显低于其对照组(P<0.05)。shARF6#1 组迁移细胞数为(588.67±18.02)个,其对照组迁移细胞数为(922.32±34.91)个。将对照组标化为1 进行统计,结果显示shARF6#1 组的迁移细胞数明显低于其对照组(P<0.05)。
2.3 过表达ARF6 促进B-CPAP 细胞的增殖和转移瞬时转染外源性3×Flag-ARF6 质粒,Western blotting 检测转染效率见图2。在B-CPAP 细胞中瞬转过表达ARF6 的质粒24 h 后进行相关实验。EdU实验结果显示,3×Flag-ARF6 组EdU 阳性细胞数的比例为(46.53±4.09)%,对照组为(36.89±2.27)%。将对照组标化为1 后进行统计,结果显示与对照组相比,3×Flag-ARF6 组EdU 阳性细胞数明显增多(P<0.05)。
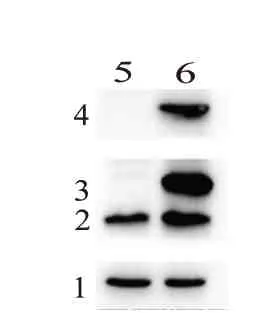
图2 蛋白质印迹法检测B-CPAP细胞中ARF6过表达效率
CCK-8 实验显示,在第1、2、3、4、5 天,3×Flag-ARF6 组的OD 值分别为(0.48±0.01)、(0.66±0.01)、(0.81±0.02)、(0.93±0.02)和(1.06±0.03),而对照组的OD 值分别为(0.45±0.01)、(0.55±0.01)、(0.63±0.01)、(0.73±0.02)和(0.81±0.02)。将第一天吸光度标化为1后进行统计可知,3×Flag-ARF6组的增殖活性明显高于对照组(P<0.05)。
Transwell 实验结果显示,3×Flag-ARF6 组侵袭细胞数为(943.68±24.69)个,其对照组侵袭细胞数为(758.42±10.78)个。将对照组标化为1进行统计,结果显示3×Flag-ARF6 组的侵袭细胞数明显高于其对照组(P<0.05)。3×Flag-ARF6 组迁移细胞数为(974.68±23.68)个,其对照组迁移细胞数为(726.32±27.04)个。将对照组标化为1 进行统计,结果显示3×Flag-ARF6 组的迁移细胞数明显高于其对照组(P<0.05)。
2.4 ARF6 对p-ERK1/2、E-cadherin 和MMP-9 蛋白水平的调控情况 Western blotting 结果显示,与Control 组相比,shARF6#1 组MMP-9 蛋白水平降低(P<0.05),E-cadherin 蛋白水平升高(P<0.05),p-ERK1/2蛋白水平降低(P<0.05)。过表达ARF6时结果相反(MMP-9,P<0.05;E-cadherin,P<0.05;p-ERK1/2,P<0.05)。见表1、表2、图3。
表1 蛋白印迹法检测沉默二磷酸腺苷核糖基化因子6(ARF6)后细胞外调节激酶1/2(ERK1/2)、上皮型钙黏蛋白(E-cadherin)及基质金属蛋白酶-9(MMP-9)蛋白表达水平/±s

表1 蛋白印迹法检测沉默二磷酸腺苷核糖基化因子6(ARF6)后细胞外调节激酶1/2(ERK1/2)、上皮型钙黏蛋白(E-cadherin)及基质金属蛋白酶-9(MMP-9)蛋白表达水平/±s
组别Control组shARF6#1组t值P值样本量×重复次数2×3 2×3 MMP-9/β-actin 0.78±0.09 0.30±0.08 9.76 0.000 E-cadherin/β-actin 0.62±0.15 1.23±0.11 8.03 0.000 p-ERK1/2/β-actin 1.11±0.05 0.21±0.07 25.63 0.000 ERK1/2/β-actin 1.10±0.06 1.11±0.04 0.34 0.741
表2 蛋白印迹法检测过表达二磷酸腺苷核糖基化因子6(ARF6)后细胞外调节激酶1/2(ERK1/2)、上皮型钙黏蛋白(E cadherin)及基质金属蛋白酶-9(MMP-9)蛋白表达水平/±s

表2 蛋白印迹法检测过表达二磷酸腺苷核糖基化因子6(ARF6)后细胞外调节激酶1/2(ERK1/2)、上皮型钙黏蛋白(E cadherin)及基质金属蛋白酶-9(MMP-9)蛋白表达水平/±s
组别3×Flag-Vector组3×Flag-ARF6组t值P值样本量×重复次数2×3=6 2×3=6 MMP-9/β-actin 0.50±0.05 0.94±0.03 18.48 0.000 E-cadherin/β-actin 0.95±0.09 0.30±0.11 11.20 0.000 p-ERK1/2/β-actin 0.65±0.07 1.27±0.08 14.29 0.000 ERK1/2/β-actin 1.01±0.05 1.12±0.06 3.45 0.006

图3 蛋白质印迹法检测基质金属蛋白酶-9(MMP-9)、上皮型钙黏蛋白(E-cadherin)、细胞外调节激酶1/2(ERK1/2)蛋白及其磷酸化水平的调控:A为蛋白质印迹法检测沉默ARF6后MMP-9,E-cadherin,p-ERK1/2和ERK1/2蛋白表达水平;B为蛋白质印迹法检测过表达ARF6后MMP-9,E-cadherin,p-ERK1/2和ERK1/2蛋白表达水平
3 讨论
PTC 是最常见的甲状腺恶性肿瘤[4-5,9],近几十年来国内外PTC 的发病率和死亡率都呈逐渐上升趋势[4-5,9]。PTC 的临床症状缺乏典型性,肿瘤体积通常不大,且生长速度缓慢,极易被忽视[10]。早期PTC 病人预后良好,而晚期PTC 病人的5 年生存率仅为59%左右[11]。部分类型的PTC 侵袭能力强,且有去分化倾向,可能发展为低分化或未分化癌,预后极差[12]。因此,研究PTC 发生发展的分子机制,寻找对应的分子靶标,可以为PTC 的治疗提供理论依据。
ARF6 是ADP-核糖基化因子(ARF)家族的一员,其通过调节细胞质膜转运和细胞内肌动蛋白的组装参与细胞分裂、黏附、生长、侵袭、转移等细胞生命活动[8,13]。大量研究表明,ARF6 在多种肿瘤中高表达并参与调节肿瘤的发生发展,如乳腺癌、胰腺癌、肺癌等[8,14-18]。在乳腺癌细胞中,ARF6 可招募AMAP1,进而结合间质特异性蛋白EPB41L5,促进上皮-间质转化和局部粘附动力学,导致乳腺癌细胞的侵袭和迁移能力增强[19-20]。同时,ARF6 和AMAP1是KRAS和TP53突变的主要靶点,可促进胰腺癌的侵袭[15]。另外,在非小细胞型肺癌中ARF6的蛋白表达量明显升高,可作为潜在的生物标志物[21]。但目前为止,ARF6 在PTC 发生发展中的作用尚无报道。在本研究中,我们通过EdU、CCK-8和Transwell实验证明:在甲状腺乳头状癌细胞B-CPAP中,ARF6 可促进B-CPAP 细胞的增殖和转移能力。因此,我们推测ARF6 在PTC 发生发展的过程中起着重要的作用,可能成为PTC 的一个潜在的生物学标志物,但其相关调控机制尚不清楚。
接着,我们通过Western blotting实验对ARF6调控B-CPAP 细胞增殖和转移能力的机制进行了初步的探讨。ERK1/2 是丝裂原活化蛋白激酶(MAPKs)超家族中的一员,其异常激活与细胞增殖、侵袭和迁移密切相关[22]。研究表明,Verteporfin 通过ERK1/2 信号通路抑制甲状腺乳头状癌细胞的增殖和细胞周期[23]。MMP-9 是肿瘤细胞侵袭和转移的重要因子之一,主要参与细胞外基质的降解,对肿瘤的侵袭和转移有促进作用[24]。已有研究表明MMP-9 与甲状腺癌的侵袭和转移呈正相关[25]。Ecadherin 是经典钙黏蛋白家族的一员,通过促进粘附连接的溶解进而调控肿瘤细胞上皮-间质转化和迁移,其表达下降或缺失可促进恶性肿瘤的发生和转移[26]。研究表明,E-cadherin 低表达、Ezrin 高表达与PTC 的侵袭转移有关[27]。本研究中,我们发现,沉默ARF6 后ERK1/2 的磷酸化水平、MMP-9 的表达量降低、E-cadherin 的表达量升高,而过表达ARF6时结果相反。据此,我们推测,ARF6 调节B-CPAP细胞增殖和转移可能与促进ERK1/2 的磷酸化水平、增加MMP-9 的表达及抑制E-cadherin 的表达有关,但其具体机制仍有待进一步探索。
综上所述,ARF6 可以促进甲状腺乳头状癌细胞的增殖和转移能力,其机制可能与ARF6 激活ERK1/2、促进MMP-9 表达及抑制E-cadherin 表达有关,推测ARF6 有望成为甲状腺乳头状癌分子靶向治疗及预后评估的一个潜在的生物学标志物。

