凝血因子XI基因变异致下消化道出血病因分析
王欢欢,刘媚娜,谢海啸,贾恺琦,曾蔓霖,王明山
温州医科大学附属第一医院 医学检验中心 浙江省检验诊断及转化研究重点实验室,浙江 温州325015
遗传性凝血因子XI(coagulation factor XI,FXI)缺陷症是一种由FXI基因变异导致的罕见遗传性出血性疾病[1],由ROSENTHAL等[2]在1953年首次报道。患者临床出血表现轻重不一,主要表现为创伤或手术后出血增多,女性可见月经过多,少有明显的自发性出血症状[3]。由于FXI活性水平高低与出血程度并无明显相关性,因此当前的实验室方法难以评估FXI缺陷患者的出血风险[4]。下消化道出血(lower gastrointestinal bleeding, LGIB)的定义为屈氏韧带以远的肠道出血[5],包括小肠出血和结直肠出血。LGIB临床常见,占全部消化道出血的20%~30%[6]。本研究对一个由FXI基因无义变异导致的遗传性凝血因子XI缺陷症患者行内镜下直肠息肉摘除术后出现下消化道异常出血进行临床资料和基因变异分析,探讨FXI基因变异与治疗后下消化道异常出血的关系。
1 对象和方法
1.1 研究对象 选择2021年8月于温州医科大学附属第一医院消化内科收治的1例内镜下直肠息肉摘除术后出现下消化道异常出血患者作为研究对象。调查患者及家系其他成员共3代5人,均无自发性出血倾向,家系遗传图谱见图1。选取100名20~58岁的体检健康者建立实验室凝血指标参考范围,其中男55例,女45例,无肝肾功能障碍及其他基础疾病。本研究通过本院临床研究伦理委员会批准(2021年伦审第17号),所有受试者均签署知情同意书。
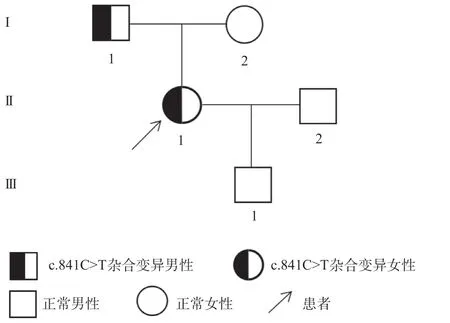
图1 遗传性FXI缺陷症家系图
1.2 仪器与材料
1.2.1 仪器:自动血液凝固分析仪(法国Stago公司,型号:STA-R Max)、LifePro热循环仪[赛默飞世尔科技(中国)有限公司,型号:TC-96/G/H(b)A]、基因测序仪(美国ABI公司,型号:3730XL)、酶标仪(上海美谷分子仪器有限公司,型号:SpectraMax iD3)。
1.2.2 试剂:FXI活性(FXI activity, FXI:C)试剂由法国Stago公司配套提供(批号:255645),DNA提取试剂盒购自北京天根生化科技有限公司(批号:S7425),人凝血因子XI酶联免疫吸附测定试剂盒购自上海江莱生物科技有限公司(批号:JL42275)。
1.2.3 引物:根据FXI 基因序列(GenBank AY193837),采用Primer 5.0软件设计覆盖FXI基因所有外显子区域及侧翼序列的13对引物,由上海桑尼生物科技有限公司合成,见表1。

表1 FXI基因的引物序列及扩增片段长度
1.3 方法
1.3.1 标本采集与处理:采集研究对象外周静脉血2.7 mL,以0.109 mol/L枸橼酸钠1:9 抗凝,3 000 r/min离心10 min,上层乏血小板血浆用于凝血指标的检测,下层血细胞用于提取基因组DNA。
1.3.2 凝血指标检测:凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、纤维蛋白原(fibrinogen, FIB)、凝血因子VIII活性(factor VIII activity, FVIII:C)、凝血因子IX活性(FIX:C)、凝血因子XI活性(FXI:C)、凝血因子XII活性(FXII:C)和狼疮抗凝物(lupus anticoagulant, LA)等凝血指标均在自动血液凝固分析仪上进行测定;FXI:Ag(FXI antigen, FXI:Ag)采用酶联免疫吸附测定法。所有操作步骤均严格按照试剂说明书进行。
1.3.3 DNA提取及PCR扩增:采用DNA提取试剂盒提取患者及其家系成员的外周血基因组DNA。PCR反应体系包括2×Taq PCR MasterMix 12.5 μL,双蒸水8.0 μL,DNA模块2.0 μL,10 μmol/L上下游引物各1.0 μL。用LifePro热循环仪扩增,反应条件如下:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共30个循环,再72 ℃延伸10 min,4 ℃保存[7]。PCR产物送上海桑尼生物科技有限公司进行电泳和纯化,然后使用基因测序仪进行测序。
1.3.4 测序分析:通过Chromas软件与美国NCBI基因库所公布的FXI基因序列进行比对,分析测序峰图,发现变异位点后检测家系成员相应的变异位点区域。
1.3.5 致病性及蛋白模型分析:根据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)遗传变异分类标准和指南,判断所发现的变异位点致病等级。用PyMol软件分析FXI基因变异前后FXI蛋白结构的改变。
2 结果
2.1 临床资料 患者,女,33岁,汉族,因“直肠息肉摘除术后3 d,血便2 d”入院。既往无肝肾疾病病史,也无明显自发性出血倾向,自述月经规律,经量正常。入院当日实验室检查:白细胞4.63×109/L、血红蛋白109g/L、血小板264×109/L;粪隐血试验(+);PT:14.7 s、APTT:50.9 s;肝功能、肾功能及肿瘤标志物均正常。全腹CT提示:直肠致密影。入院后予禁食,同时予止血、补充血容量等对症治疗。次日直肠核磁共振(平扫+增强)显示:直肠中段局部结节伴强化,提示出血可能;肠镜显示:直肠距肛门约5 cm可见一息肉样隆起,表面充血、糜烂,见钛夹;超声显示:病灶切面约34 mm×7 mm,内部似有低回声细腔,位于黏膜及黏膜下层,见图2。实验室进一步检查发现FXI:C为53%(参考范围:82%~118%),其他内源性途径凝血因子活性均在参考范围内,考虑出血可能与FXI:C降低相关。后予输注新鲜冰冻血浆4 U,患者出血症状好转,病情平稳后出院。
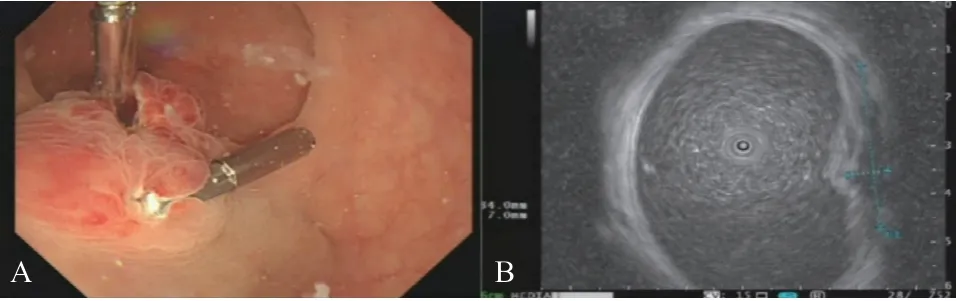
图2 患者肠镜(A)和超声(B)检查结果
2.2 患者及其家系成员实验室表型检测结果 患者及其父亲APTT延长,FXI:C和FXI:Ag降低至正常对照的一半左右;其母亲、丈夫、儿子APTT正常,家系成员的其他凝血指标均无明显异常(见表2)。
2.3 患者及其家系成员基因分析结果 患者及其父亲的FXI基因第8号外显子均存在c.841C>T杂合无义变异(p.Gln281*),其余家庭成员该位点为野生型(见表2和图3)。
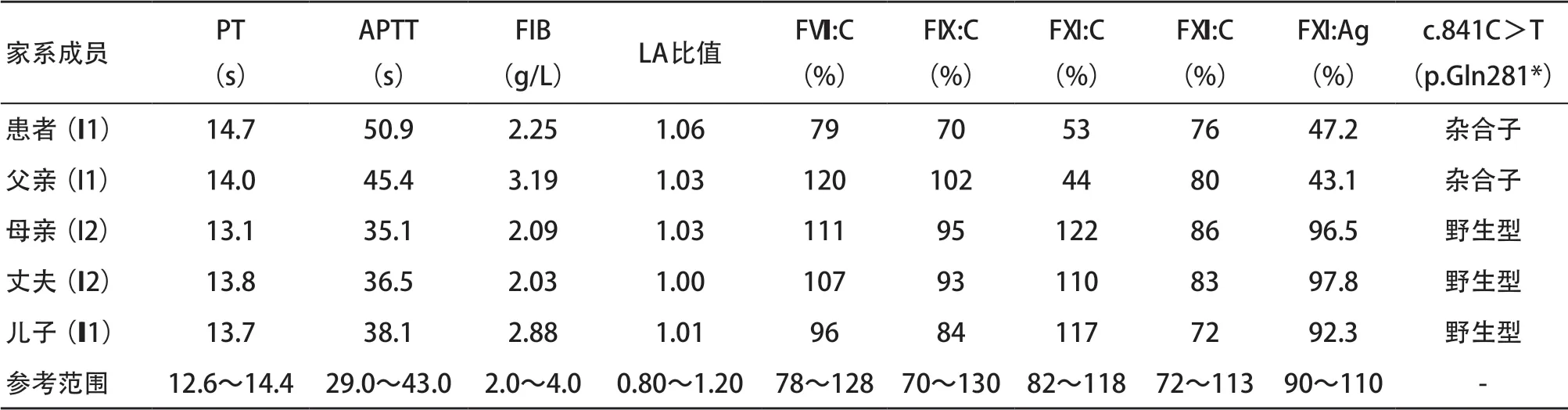
表2 患者及其家系成员主要实验表型及基因检测结果

图3 FXI基因第8外显子测序结果
2.4 致病性及蛋白模型分析结果 根据ACMG遗传变异分类标准和指南可知,无义变异导致基因产物缺失而破坏基因功能为极强的致病性证据,且查阅国内外文献,已有该变异位点致病的相关报道[8-9]。蛋白模型分析显示,发生p.Gln281*变异导致苹果样结构域(apple domains, AP)3结构不完整且AP4和丝氨酸蛋白酶域(serine protease, SP)均缺失,产生只有280个氨基酸的截短蛋白(见图4)。
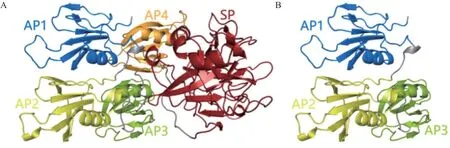
图4 FXI蛋白质模型图
3 讨论
遗传性FXI缺陷症是一种由FXI基因变异导致血浆中FXI水平降低或功能缺陷而引起的罕见出血性疾病(rare bleeding disorders, RBD),通常以常染色体隐性方式遗传,也有部分表现为常染色体显性遗传[10]。FXI基因变异杂合子FXI:C水平通常为20%~60%,纯合子或复合杂合子FXI:C水平常低于20%也被定义为严重FXI缺乏[11]。遗传性FXI缺陷症患者很少发生严重出血[12],即使是严重FXI缺乏患者自发性出血也并不常见,但在创伤、手术或产后等这些因素的共同作用下可能导致异常出血。与骨科手术或胃肠道手术相比,牙科、口咽或泌尿生殖器手术后出血的可能性更大[13]。据报道[14],部分FXI基因变异杂合子也可能有出血过多的风险。由于个体出血风险与FXI:C水平之间缺乏相关性,这对遗传性FXI缺陷症患者的治疗也提出了重大的挑战。
本研究中的患者为一名33岁女性,平素无月经过多,也无自发性出血倾向。因在当地医院行无痛胃肠镜检查时发现直肠息肉,立即予内镜下直肠息肉摘除,术前未行凝血功能筛查。术后1 d患者出现腹痛伴血便,至本院急诊就诊,查腹部CT示:直肠致密影,APTT:50.9 s,结合患者病史及CT结果考虑LGIB,予止血、补液等对症治疗后出血仍未控制。进一步检查发现该患者的FXI:C为53%,排除继发性因素及家系调查后[15],考虑为遗传性FXI缺陷症,予输新鲜冰冻血浆4 U后出血情况好转。本研究提取了患者及其家系成员的外周血DNA,进行PCR扩增及测序,发现患者及其父亲的FXI基因第8号外显子均存在c.841C>T杂合无义变异(p.Gln281*),测序结果与实验室表型相符。
FXI蛋白是由位于4号染色体(4q35)长臂端的FXI基因编码,主要在肝细胞中合成的一种丝氨酸蛋白酶原,血浆浓度约为30 nmol/L[16]。与其他的凝血因子不同,它是由两个相同亚基通过分子间二硫键(p.Cys321-p.Cys321)连接而成的同源二聚体。每个亚基由607个氨基酸组成,包括4个重复序列(也称为AP)构成的重链及催化结构域(也称为SP)构成的轻链。苹果样结构域上有多种分子的结合位点:AP1上有凝血酶结合位点;AP1、AP2上有高分子量激肽原(high-molecular-weight kininogen,HMWK)结合位点;AP3上有肝素、FIX、血小板膜糖蛋白Ib结合位点;AP4上有活化FXII的结合位点[17]。另外,FXI通过凝血酶或活化FXII裂解自身p.Arg369-p.Ile370之间的肽键而被激活,从而发挥止血功能。截至2021年4月,人类基因变异数据库(http://www.hgmd.cf.ac.uk/ac/index.php)已收录FXI基因变异280余种,其中错义/无义变异约占76%,其他变异还包括插入、缺失及剪切变异,变异分布于FXI基因的各个区域,相对集中于编码催化结构域的区域[18]。
本研究中的c.8 4 1 C >T 杂合无义变异(p.Gln281*)位于AP3结构域,SHAO等[19]的研究提出p.Gln281*可能为中国人群中遗传性FXI缺陷症的变异热点。周剑品[20]对该变异位点分析表明p.Gln281在同源物种间中度保守,为有害变异。另外,ACMG遗传变异分类标准和指南也为p.Gln281*杂合无义变异为致病变异提供了依据。蛋白模型分析显示,发生p.Gln281*变异,将导致AP3结构不完整以及AP4和SP结构消失,从而直接影响FXI与多种分子的结合并丧失本身的催化功能。此外,截短蛋白的产生使其在细胞内非常容易被降解。另有报道[21],无义变异产生的含有提前终止密码子的mRNA可被一种称之为无义介导衰变的mRNA监视系统迅速降解,使得循环中FXI减少。因此,c.841C>T杂合无义变异(p.Gln281*)是患者FXI:C水平降低的主要原因。机体内凝血过程通常分为启动阶段和维持阶段,启动阶段由血管内皮损伤释放组织因子(tissue factor,TF)激活FVII形成TF-活化FVII(activated FVII,FVIIa)-Ca2+复合物开始,然后激活FX、FIX。此时机体的组织因子途径抑制物(tissue factor pathway inhibitor, TFPI)很快将该复合物灭活,之后的凝血维持阶段主要靠活化FXI(activated FXI, FXIa)激活FIX。因此,该患者出现异常出血症状,可能与FXI缺陷导致维持阶段凝血障碍有关,具体的致病机制有待进一步研究。
综上所述,本研究通过对一例内镜下直肠息肉摘除术后异常出血患者进行病因分析,发现了一个FXI基因c.841C>T杂合无义变异,该变异不仅与患者及其家系成员FXI水平降低有关,而且可能也是该患者出现术后异常出血的主要原因。因此,建议临床医师在对患者行有创操作前,检测患者的凝血功能,判断是否存在凝血功能异常。如有异常,应当尽量明确异常原因以降低操作后患者异常出血的风险。对于排除获得性因素后仍无法明确病因的患者,可进一步检测其血浆中各凝血因子活性水平,从而为明确病因提供线索。

