miR-133a-3p靶向BMP9调控人颌骨骨髓间充质干细胞增殖、分化和凋亡的研究
郭莹叶 高建华 郭永梅 陈剑英
成骨细胞通过分泌骨基质蛋白在骨形成过程中发挥重要作用[1]。近年来,人颌骨骨髓间充质干细胞(human orofacial bone marrow mesenchyml stem cells,hOBMSCs)的成骨分化调控机制已被研究,并可能在干细胞治疗由创伤、肿瘤切除和先天性畸形等引起的大面积骨缺损的临床应用中具有重要潜力[2-3]。微小RNA(microRNA,miRNAs)是一种短链的、进化保守的非编码RNA,其通过调节靶基因表达参与多种生物学过程调控,如细胞分化、增殖和凋亡等[4]。近年研究表明多种miRNAs在BMSCs成骨分化中发挥重要作用。有研究指出miR-133a-3p可抑制绝经后骨质疏松症BMSCs成骨分化[5]。本研究通过生物信息学分析发现骨形态发生蛋白9(bone morphogenetic protein 9,BMP9)是miR-133a-3p的潜在靶基因。BMP9是最具成骨能力的BMPs之一,可诱导BMSCs向成骨细胞分化[6]。本研究拟通过揭示 miR-133a-3p靶向调控BMP9在hOBMSCs增殖、成骨分化和凋亡的作用。
1 材料与方法
1.1 实验材料
人胚肾细胞HEK-293(上海酶研生物科技有限公司);低糖DMEM培养基、胎牛血清(北京索莱宝科技有限公司);本研究所用miRNA抑制物、抑制物阴性对照、小干扰RNA、小干扰RNA阴性对照、miRNA模拟物、模拟物阴性对照、荧光素酶报告基因载体(上海生工生物公司有限公司);cDNA第一链合成试剂盒和SYBR Green Fast qPCR Mix(北京天根生化科技有限公司);兔源细胞周期素D1(CyclinD1)抗体、兔源裂解的半胱氨酸蛋白酶3(Cleaved-caspase-3)抗体、兔源Runt相关转录因子2(Runx2)抗体、鼠源骨钙蛋白(osteocalcin,OCN)抗体、兔源骨桥蛋白(osteopontin,OPN)抗体以及山羊抗兔IgG二抗、山羊抗鼠IgG二抗、兔源BMP9抗体(Abcam公司,美国);二甲基亚砜、膜联蛋白异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)试剂盒、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)(上海碧云天生物科技公司);兔源 p-Smad1/5/8及兔源 Smad1/5/8抗体(Santa Cruz公司,美国)。
1.2 实验方法
1.2.1 hOBMSCs细胞分离、培养和成骨诱导 本研究经骨碎片提供者知情同意且获得我院伦理委员会批准。hOBMSCs由无遗传及系统性疾病的下颌畸形患者接受正颌手术获得的骨碎片分离培养获得。原代细胞融合度为80%时,进行消化传代,取处于对数生长期的第5代细胞进行研究[2]。将hOBMSCs接种于96孔板,当细胞融合约90%,更换成骨诱导液,每隔1 d换液1次,诱导培养7 d。
1.2.2 实验分组和处理 实验分组如下:正常培养组(正常培养的 hOBMSCs)、成骨诱导液组(按照 1.2.1方法进行成骨诱导)、anti-miR-con组(转染anti-miR-con后进行成骨诱导)、anti-miR-133a-3p组(转染anti-miR-133a-3p后进行成骨诱导)、anti-miR-133a-3p+si-con组(共转染anti-miR-133a-3p和si-con后进行成骨诱导)、anti-miR-133a-3p+si-BMP9组(共转染anti-miR-133a-3p和si-BMP9后进行成骨诱导)。
1.2.3 RT-qPCR检测成骨分化过程中miR-133a-3p和BMP9 mRNA的表达 收集成骨诱导7 d的hOBMSCs,采用Trizol法提取hOBMSCs总RNA,以紫外分光光度计测定总RNA的纯度。按cDNA第一链合成试剂盒、SYBR Green Fast qPCR Mix说明书进行cDNA合成和荧光定量PCR扩增。引物序列如下:miR-133a-3p上游 5′-TTAAACCATTAAGCGCAGGA-3′,下游 5′-TTAAATCCTTAAGTCATCCATACA-3′;U6 上 游 5′-ACACTCCAGCTGGGTCAAAATCGTGAAGCG-3′,下 游5′-CTCAACTGGTGTCGTGGAGTCGGCAA-3′;BMP9上游 5′-GCTGCAGAACTGGGAACA-3′,下 游 5′-AACAAGCATCCCCTGGGG-3′;β-actin 上 游 5′-GAGCCTCGCCTTTGCCGATCC-3′,下 游 5′-CGATGCCGTGCTCGATGGGG-3′。分别以 U6和 β-actin为内源性参照,按照 2-ΔΔCt法计算 miR-133a-3p和 BMP9 mRNA的相对表达量。按照上述方式检测miR-133a-3p和BMP9表达对Runx2 mRNA、OCN mRNA和OPN mRNA表达的影响。Runx2上游 5′-CGGGTCTCCTTCCAGGAT-3′,下 游 5′-GGGAACTGCTGTGGCTTC-3′;OCN上 游 5′-GGTGGTGAATAGACTCCGGC-3′,下 游5′-AGCTCGTCACAATTGGGGTT-3′;OPN上游 5′-GCTATCACCTCGGCCGTTGGGG-3′,下 游 5′-CATTGCCTCCTCCCTCCCGGTG-3′。
1.2.4 双荧光素酶报告基因实验验证miR-133a-3p对BMP9的靶向作用 TargetScan在线分析显示BMP9是miR-133a-3p下游潜在性功能靶基因之一。为验证miR-133a-3p1对BMP9的靶向调控作用,将含有miR-133a-3p结合位点的野生型(WT-BMP9)以及含有miR-133a-3p结合位点突变序列的突变型(MUTBMP9)荧光素酶报告基因载体分别与miR-NC、miR-133a-3p mimics分别共转染HEK-293细胞,48 h后,严格按荧光素酶活性检测试剂盒的规定测定各组的荧光素酶活性。
1.2.5 MTT法检测细胞增殖活力 将 hOBMSCs(2×103cells/孔)接种于96孔板,利用脂质体转染试剂LipofectamineTM2000按照上述分组进行细胞转染,转染72 h时进行成骨诱导。分别于成骨诱导后0、1、3、5、7 d,MTT法测定各孔的吸光度值。
1.2.6 Western blot检测成骨分化标志蛋白和Smad通路蛋白的表达 将 hOBMSCs(1×105cells/孔)接种于6孔板,按照实验分组进行转染,转染72 h时进行成骨诱导。于成骨诱导后7 d时,收集细胞检测成骨分化标志蛋白和Smad通路蛋白的表达量:分别用RIPA裂解液及BCA法提取和测定细胞蛋白浓度。制胶、上样、转膜、封闭、一、二抗孵育、显色、采集图像,检测目标蛋白的相对表达,β-actin为内参。
1.2.7 流式细胞术检测细胞凋亡 将hOBMSCs(1×105cells/孔)接种于6孔板,按照实验分组进行转染,转染72 h时进行成骨诱导。胰酶消化后,PBS洗涤2次,离心后,收集细胞,用PBS重悬细胞并计数。取105个细胞,加入195μL的Annexin V-FITC结合液轻轻重悬细胞,加入5μL的PI轻轻混匀,室温避光孵育20 min,立即上机检测。
1.3 统计学分析
采用SPSS 20.0进行统计分析,所有实验均设置3个平行实验且重复3次,实验的计量数据,如hOBMSCs中 miR-133a-3p、BMP9 mRNA和 BMP9蛋白表达,均采用±s表示。两组间比较采用T检验,多组间均数比较采用单因素方差分析,两两均数比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 hOBMSCs成骨分化过程中 miR-133a-3p和BMP9的表达
RT-qPCR和Western blot检测hOBMSCs成骨分化过程中miR-133a-3p和BMP9的表达,结果见表 1和图1,与正常培养组比,成骨诱导液组hOBMSCs中miR-133a-3p的表达显著降低,BMP9 mRNA和BMP9蛋白的表达升高(P<0.05)。
表1 成骨诱导液诱导培养后hOBMSCs中miR-133a-3p、BMP9 mRNA和BMP9蛋白表达(±s,n=9)Tab 1 The expression of miR-133a-3p,BMP9 mRNA and BMP9 protein in osteogenic induction induced hOBMSCs(±s,n=9)
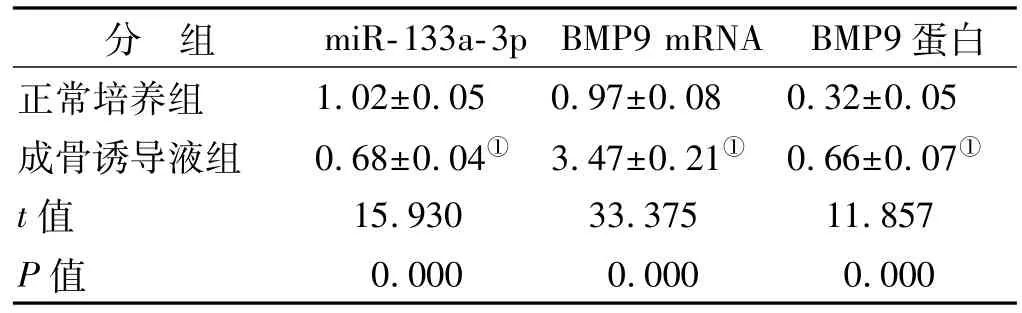
表1 成骨诱导液诱导培养后hOBMSCs中miR-133a-3p、BMP9 mRNA和BMP9蛋白表达(±s,n=9)Tab 1 The expression of miR-133a-3p,BMP9 mRNA and BMP9 protein in osteogenic induction induced hOBMSCs(±s,n=9)
注:与正常培养组比较,① P<0.05
分 组 miR-133a-3p BMP9 mRNA BMP9蛋白正常培养组 1.02±0.05 0.97±0.08 0.32±0.05成骨诱导液组 0.68±0.04① 3.47±0.21① 0.66±0.07①t值 15.930 33.375 11.857 P值 0.000 0.000 0.000

图1 Western blot检测hOBMSCs中BMP9蛋白表达Fig 1 BMP9 protein expression in hOBMSCs detected by Western blot
2.2 miR-133a-3p靶向BMP9表达
采用targetscan预测miR-133a-3p下游靶基因发现miR-133a-3p与BMP9的3'-UTR区域存在部分连续结合位点(图2A)。双荧光素酶报告基因实验显示(表2),在HEK-293细胞中,与 miR-con组比,miR-133a-3p组可显著降低WT-BMP9的荧光素酶活性(P<0.05);而miR-133a-3p组与miR-NC组比MUT-BMP9荧光素酶活性无显著变化(P>0.05);与 anti-miR-con组比,antimiR-133a-3p组可显著升高WT-BMP9的荧光素酶活性(P<0.05);而 anti-miR-133a-3p组与 anti-miR-con组比MUT-BMP94荧光素酶活性无显著变化(P>0.05)。Western blot和RT-qPCR检测显示,与miR-con组比,miR-133a-3p组HEK-293细胞BMP9 mRNA和蛋白的表达显著降低(P<0.05);与 anti-miR-con组比,antimiR-133a-3p组HEK-293细胞BMP9 mRNA和蛋白的表达显著升高(P<0.05)(表 2和图 2B)。

图2 Western blot检测HEK-293细胞中BMP9蛋白表达Fig 2 BMP9 protein expression in HEK-293 cells detected by Western blot
表2 miR-133a-3p对BMP9蛋白表达的调控作用(双荧光素酶报告实验)(±s,n=9)Tab 2 The regulation of miR-133a-3p on BMP9 protein expression(Dual luciferase report assay)(±s,n=9)
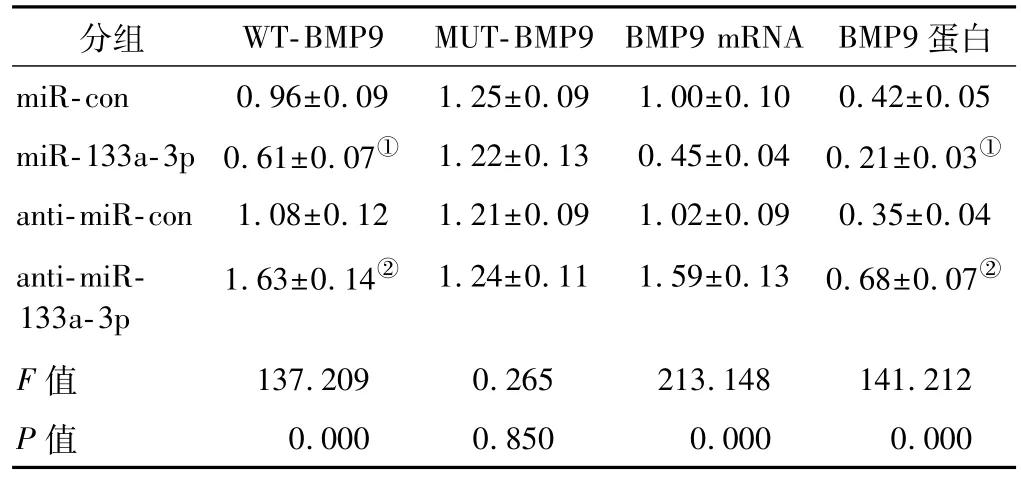
表2 miR-133a-3p对BMP9蛋白表达的调控作用(双荧光素酶报告实验)(±s,n=9)Tab 2 The regulation of miR-133a-3p on BMP9 protein expression(Dual luciferase report assay)(±s,n=9)
注:①与miR-con组比较,P<0.05;②与anti-miR-con组比较,P<0.05
分组 WT-BMP9 MUT-BMP9 BMP9 mRNA BMP9蛋白miR-con 0.96±0.09 1.25±0.09 1.00±0.10 0.42±0.05 miR-133a-3p 0.61±0.07① 1.22±0.13 0.45±0.04 0.21±0.03①anti-miR-con 1.08±0.12 1.21±0.09 1.02±0.09 0.35±0.04 anti-miR-133a-3p 1.63±0.14② 1.24±0.11 1.59±0.13 0.68±0.07②F值 137.209 0.265 213.148 141.212 P值 0.000 0.850 0.000 0.000
2.3 沉默 BMP9部分逆转干扰 miR-133a-3p对hOBMSCs的增殖促进作用
采用MTT实验检测hOBMSCs增殖,结果见图 3和表 3,与 anti-miR-con组比,诱导第 3、5、7天时hOBMSCs增殖活力显著增加(P<0.05),诱导第 7天时CyclinD1蛋白表达量显著增加(P<0.05);与 antimiR-133a-3p+si-con组比较,诱导第 3、5、7天时hOBMSCs增殖活力显著降低(P<0.05),诱导第 7天时CyclinD1蛋白表达量显著降低(P<0.05)。
表3 共转染anti-miR-133a-3p和si-BMP9对hOBMSCs增殖的影响(±s,n=9)Tab 3 The effect of co-transfection with anti-miR-133a-3p and si-BMP9 on the proliferation of hOBMSCs(±s,n=9)

表3 共转染anti-miR-133a-3p和si-BMP9对hOBMSCs增殖的影响(±s,n=9)Tab 3 The effect of co-transfection with anti-miR-133a-3p and si-BMP9 on the proliferation of hOBMSCs(±s,n=9)
注:① 与anti-miR-con组比较,P<0.05;② 与anti-miR-133a-3p+si-con组比较,P<0.05
分 组CyclinD1 0 d 1 d 3 d 5 d 7 d 7 d A490 anti-miR-con 0.27±0.02 0.31±0.03 0.39±0.03 0.57±0.04 0.74±0.05 0.59±0.05 anti-miR-133a-3p 0.26±0.03 0.33±0.02 0.58±0.04① 0.82±0.05① 1.14±0.07① 0.92±0.09 anti-miR-133a-3p+si-con 0.28±0.02 0.34±0.03 0.54±0.04 0.79±0.05 1.08±0.07 0.94±0.08 anti-miR-133a-3p+si-BMP9 0.29±0.03 0.32±0.04 0.45±0.03② 0.69±0.03② 0.82±0.06② 0.64±0.06 F值 2.308 1.579 53.580 99.640 85.962 58.646 P值 0.095 0.214 0.000 0.000 0.000 0.000

图3 Western blot检测CyclinD1蛋白表达Fig 3 CyclinD1 protein expression detected by Western blot
2.4 沉默 BMP9部分逆转干扰 miR-133a-3p对hOBMSCs的促分化作用
Western blot检测hOBMSCs分化相关蛋白表达,结果见表 4和图 4,与 anti-miR-con组比,anti-miR-133a-3p组 hOBMSCs中 BMP9、Runx2、OCN以及 OPN在mRNA和蛋白水平的表达均显著升高(P<0.05);与 anti-miR-133a-3p+si-con组比,anti-miR-133a-3p+si-BMP9组hOBMSCs中BMP9、Runx2、OCN以及OPN在mRNA和蛋白水平的表达均显著降低(P<0.05)。
表4 共转染anti-miR-133a-3p和si-BMP9对hOBMSCs中BMP9、Runx2、OCN和OPN蛋白表达的影响(±s,n=9)Tab 4 The effect of co-transfection with anti-miR-133a-3p and si-BMP9 on the expression of BMP9,Runx2,OCN and OPN protein in hOBMSCs(±s,n=9)

表4 共转染anti-miR-133a-3p和si-BMP9对hOBMSCs中BMP9、Runx2、OCN和OPN蛋白表达的影响(±s,n=9)Tab 4 The effect of co-transfection with anti-miR-133a-3p and si-BMP9 on the expression of BMP9,Runx2,OCN and OPN protein in hOBMSCs(±s,n=9)
注:① 与anti-miR-con组比较,P<0.05;② 与anti-miR-133a-3p+si-con组比较,P<0.05
分 组 BMP9 mRNA Runx2 mRNA OCN mRNA OPNmRNA BMP9蛋白 Runx2蛋白 OCN蛋白 OPN蛋白anti-miR-con 1.00±0.10 1.00±0.11 1.00±0.10 1.00±0.09 0.32±0.04 0.23±0.02 0.25±0.02 0.33±0.03 anti-miR-133a-3p 1.86±0.15① 1.52±0.14① 1.61±0.14① 1.39±0.12① 0.68±0.05① 0.42±0.02① 0.49±0.04① 0.46±0.06①anti-miR-133a-3p+si-con 1.92±0.16 1.61±0.15 1.57±0.13 1.42±0.13 0.62±0.07 0.43±0.03 0.48±0.03 0.54±0.05 anti-miR-133a-3p+si-BMP9 1.25±0.11② 1.08±0.09② 1.18±0.11② 1.10±0.09② 0.36±0.04② 0.28±0.04② 0.35±0.02② 0.36±0.04②F值 105.688 54.486 54.676 33.215 111.736 109.818 142.818 38.616 P值 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000

图 4 Western blot检测 hOBMSCs中 BMP9、Runx2、OCN和OPN蛋白表达(第7天)Fig 4 The expresion of BMP9,Runx2,OCN and OPN protein in hOBMSCs detected by Western blot(7th day)
2.5 沉默 BMP9部分逆转干扰 miR-133a-3p对hOBMSCs的凋亡抑制作用
流式细胞术和Western blot(表 5、图 5),与 antimiR-con组比,anti-miR-133a-3p组 hOBMSCs的凋亡率、Cleaved-caspase-3蛋白表达量显著降低(P<0.05);与 anti-miR-133a-3p+si-con组比较,anti-miR-133a-3p+si-BMP9组 hOBMSCs的凋亡率、Cleavedcaspase-3蛋白表达量显著升高(P<0.05)。
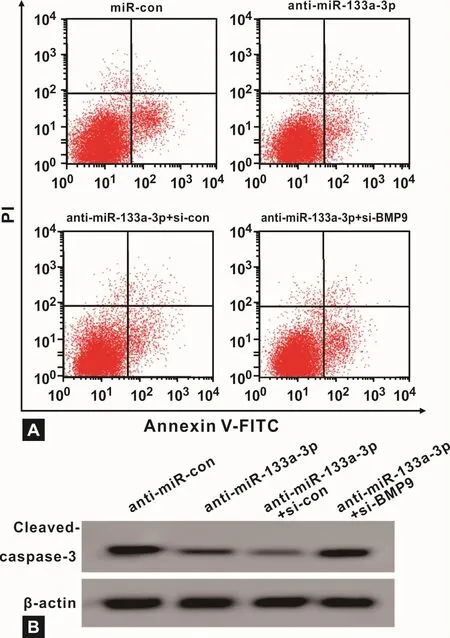
图5 沉默BMP9部分逆转干扰miR-133a-3p对hOBMSCs的凋亡抑制作用Fig 5 The inhibitory effect of interference of miR-133a-3p by silencing BMP9 partially on hOBMSCs apoptosis
表5 共转染anti-miR-133a-3p和si-BMP9对hOBMSCs凋亡的影响(±s,n=9)Tab 5 The effect of co-transfection with anti-miR-133a-3p and si-BMP9 on the apoptosis of hOBMSCs(±s,n=9)

表5 共转染anti-miR-133a-3p和si-BMP9对hOBMSCs凋亡的影响(±s,n=9)Tab 5 The effect of co-transfection with anti-miR-133a-3p and si-BMP9 on the apoptosis of hOBMSCs(±s,n=9)
注:与anti-miR-con组比较,①P<0.05;与anti-miR-133a-3p+si-con组比较,② P<0.05
分 组 细胞凋亡率(%) Cleaved-caspase-3 anti-miR-con 9.24±0.76 0.72±0.07 anti-miR-133a-3p 3.58±0.34① 0.31±0.03 anti-miR-133a-3p+si-con 3.14±0.48 0.28±0.02 anti-miR-133a-3p+si-BMP9 5.83±0.61② 0.65±0.06 F值 216.175 189.796 P值 0.000 0.000
2.6 沉默 BMP9部分逆转干扰 miR-133a-3p对hOBMSCs中Smad通路的影响
Western blot检测Smad通路相关蛋白表达,见表6和图 6,与 anti-miR-con组比,anti-miR-133a-3p组hOBMSCs中 p-Smad1/5/8蛋白的表达显著升高(P<0.05);与 anti-miR-133a-3p+si-con组比较,anti-miR-133a-3p+si-BMP9组 hOBMSCs中 p-Smad1/5/8蛋白的表达显著降低(P<0.05)。

图 6 Western blot检测 hOBMSCs中 p-Smad1/5/8和 Smad1/5/8蛋白表达Fig 6 p-Smad1/5/8 and Smad1/5/8 protein expression in hOBMSCs detected by Western blot
表6 共转染anti-miR-133a-3p和si-BMP9对hOBMSCs中p-Smad1/5/8和Smad1/5/8蛋白表达的影响(±s,n=9)Tab 6 The effect of co-transfection with anti-miR-133a-3p and si-BMP9 on the expression of p-Smad1/5/8 and Smad1/5/8 in hOBMSCs(±s,n=9)

表6 共转染anti-miR-133a-3p和si-BMP9对hOBMSCs中p-Smad1/5/8和Smad1/5/8蛋白表达的影响(±s,n=9)Tab 6 The effect of co-transfection with anti-miR-133a-3p and si-BMP9 on the expression of p-Smad1/5/8 and Smad1/5/8 in hOBMSCs(±s,n=9)
注:①与 anti-miR-con组比较,P<0.05;②与 anti-miR-133a-3p+si-con组比较,P<0.05
分 组 Smad1/5/8蛋白 p-Smad1/5/8蛋白anti-miR-con 0.66±0.08 0.29±0.02 anti-miR-133a-3p 0.68±0.05 0.62±0.07①anti-miR-133a-3p+si-con 0.64±0.06 0.61±0.06 anti-miR-133a-3p+si-BMP9 0.63±0.05 0.41±0.05②F值 1.180 81.553 P值 0.333 0.000
3 讨 论
BMSCs成骨分化研究可有效的调控骨损伤疾病的再生和修复,其在组织工程中的应用越来越受到重视[7]。研究发现miR-133a-3p的异常表达还可参与肌源性分化和骨骼肌生长的调控[8]。miR-133a-3p还调控BMSCs的成骨分化,并与BMSCs异常分化引起的人类疾病密切相关[9]。单核细胞中miR-133a表达还可作为临床绝经后骨质疏松症辅助诊断指标[10]。本研究发现在诱导hOBMSCs成骨分化过程中miR-133a-3p表达显著降低,提示miR-133a-3p表达改变可能与hOBMSCs成骨分化相关。功能分析显示,干扰miR-133a-3p表达显著增加细胞活力,抑制细胞凋亡。
Runx2是调节BMSCs形态和诱导成骨细胞分化的早期成骨标志物,OCN是BMSCs晚期成骨分化标志物,OPN通过与组织中的轻磷灰石结合在骨基质矿化中发挥作用,三者是检测BMSCs成骨功能的关键指标[11]。本研究表明,干扰miR-133a-3p表达可显著上调 Runx2、OCN、OPN蛋白表达水平,与 Zhang等[12]抑制miR-133a表达可促进BMSCs成骨分化的结论基本吻合。以上研究说明干扰miR-133a-3p可促进hOBMSCs增殖和成骨分化,抑制细胞凋亡。
BMP9被认为是最具成骨能力的BMPs之一。研究显示miR-155通过下调BMP信号通路可抑制BMP9诱导的间充质干细胞的成骨分化[13]。黄芪多糖通过下调miR-152增加BMP9表达促进骨间充质干细胞的增殖和成骨分化[14]。本研究发现在诱导hOBMSCs成骨分化过程中BMP9表达显著升高,并证实miR-133a-3p靶向负性调控BMP9表达。恢复实验显示干扰BMP9部分逆转miR-133a-3p抑制对hOBMSCs增殖、成骨分化和凋亡的影响。Smad信号通路与骨骼发育过程中BMSCs分化相关,BMPs可诱导 Smad1/5/8磷酸化,磷酸化的Smad1/5/8与Smad4结合并转运至细胞核,进而与组织特异性转录因子协同驱动成骨靶基因表达[15]。研究发现包括miRNA在内的多种因子通过激活Smad通路参与调控 BMPs成骨分化[16-17]。本研究发现干扰miR-133a-3p表达抑制hOBMSCs细胞p-Smad1/5/8蛋白表达,而干扰BMP9部分逆转miR-133a-3p抑制对 p-Smad1/5/8蛋白表达的影响,说明miR-133a-3p通过调控BMP9表达参与hOBMSCs的增殖、成骨分化和凋亡,其机制可能与调控Smad通路有关。干扰miR-133a-3p表达有望成为骨损伤相关疾病治疗的新途径。

