芥蓝BoaBKI1基因的克隆及表达分析
梁 莎,黄文莉,李香香,王依霖,张晨璐,张 芬,孙 勃
(四川农业大学园艺学院,成都 611130)
芥蓝(Brassica oleracea var.alboglabra)是十字花科芸薹属一、二年生草本植物[1],原产于中国南部[2],是我国的特色蔬菜之一,以花薹和嫩叶供食用,兼备营养价值和药用价值。芥蓝富含维生素C、类胡萝卜素、多酚和芥子油苷等多种生物活性物质,在抗氧化及抗癌等方面作用显著[3-4]。
油菜素甾醇(brassinosteroids,BRs)是一类植物激素,存在于植物大部分器官中。它们在植物的生长发育和环境适应性过程中占据着重要地位[5-6],包括促进细胞的伸长、分裂和衰老、促进维管束的分化、调节雄性育性和抗逆性以及影响光形态的建成等[7-9]。1979年,人们首次在油菜的花粉中得到纯化的油菜素甾醇,迄今为止分离出的BR类化合物已经超过70种[10]。
从发现BR开始,科研人员一直在鉴定其各种组分,并不断探索它的合成途径,在1997年成功克隆了第一个BR不敏感突变体,意味着BR信号转导通路的研究进入了新阶段[11]。此后,人们通过遗传学和生物化学等方法,探索出BR信号转导途径的一部分,并初步研究了BR对植物生长发育的调控机制。BR在细胞膜上首先被富含亮氨酸的受体激酶BRI1(brassinosteroid-insensitive 1)所感知,随后BRI1和BAK1(BRI1-associated receptor kinase 1)受体复合物被激活并启动多重激酶和磷酸酶的级联反应,导致 BES1(BRI1-EMS-suppressor 1)和 BZR1(brassinazole resistant 1)等相关转录因子的去磷酸化和活化,实现信号向下游的传递,调控目标基因表达[12]。在整个信号传导过程中,BRI1及其他多个组分的突变均会使BR信号减弱,从而导致植物生长异常,例如植株矮小、延迟开花以及雄性不育等,而增强BR信号可以促进植物生长和纤维素的生物合成[13]。
BKI1(BRI1 kinase inhibitor 1)是BR信号通路中的一种重要调节因子。在拟南芥的研究中发现,BKI1是一种受体激酶抑制剂,是缺少BR时使BRI1处于基础水平所必需的。它通过阻断BRI1与BAK1结合,阻止活性受体复合物的产生来负调节质膜上的BRI1[14]。当用BR处理后,磷酸化的BKI1能够与14-3-3蛋白作用,竞争性抑制后者与BES1的结合,促进BES1的去磷酸化,行使对BR信号转导的正调控功能。因此,BKI1在BR信号通路中起到正负调控的双重作用[5],但具体作用机制还不清楚。
蔬菜作物的生长发育和抗逆与BR途径密切相关。一直以来,关于BR的信号传导途径的研究大多是围绕于拟南芥和烟草等模式植物[15],而在芥蓝等芸薹属蔬菜中的研究还鲜有报道。本试验克隆芥蓝BoaBKI1基因的全长,并对其进行序列分析和时空表达分析,以期丰富对芥蓝油菜素甾醇研究的认知,为进一步研究芥蓝中油菜素甾醇的信号传导机制奠定一定分子基础。
1 材料和方法
1.1 试验材料
试验以白花芥蓝品种‘四季粗条’为材料。芥蓝种子浸湿于25℃培养箱放置2 d,取萌动种子材料,其余种子继续培养成植株至成熟结荚。在生长过程中,分别对其不同时期(子叶期、真叶期和成熟叶期)、成熟期不同器官(幼果、果荚、叶片、叶柄、花序、根系和花薹)、花蕾期花器官(花瓣、花萼、雄蕊、雌蕊)和盛开期花器官(花瓣、花萼、雄蕊和雌蕊)进行取样[16],每个样品取3个重复,每个重复各2 g,经液氮速冻后置于-80℃冰箱保存,用于后续试验。
1.2 试验试剂
反转录试剂盒、载体T-vector pMD19购于大连宝生物公司,Taq酶购于北京全式金生物技术股份有限公司,DNA胶回收试剂盒购于生工生物工程(上海)股份有限公司。
1.3 DNA提取
以芥蓝叶片为材料,采用CTAB法进行DNA的提取,将产物置于-20℃保存备用。
1.4 总RNA提取及cDNA合成
以芥蓝分别以芥蓝不同时期叶片、成熟期不同器官以及花蕾期和盛开期的花器官为材料,使用改良CTAB法提取对应的总RNA,1%琼脂糖凝胶电泳检测其质量。取用质量合格的总RNA参照反转录试剂盒说明书进行cDNA的合成,将产物置于-20℃保存备用。
1.5 BoaBKI1基因克隆
根据NCBI网站已公开的近源物种甘蓝、白菜等BKI1基因的序列设计引物(表1),并由生工生物工程(上海)股份有限公司合成。以DNA和cDNA分别为模板,使用全式金TranStart FastPfu Fly DNA PolymeraseTaq酶进行扩增,PCR扩增反应体系为:模板2 μL,上下游引物10 μmol/L各2 μL,10×PCR Buffer 10 μL,2.5 mmol/LdNTP 4 μL,Taq酶 1 μL,DEPC处理水29 μL。PCR反应条件:94 ℃ 2 min;94 ℃ 20 s,57 ℃ 20 s,72 ℃ 15 s,循环数40;最后72℃延伸10 min。将PCR产物进行1%琼脂糖凝胶电泳检测后,用DNA胶回收试剂盒纯化回收目的基因BoaBKI1条带。

表1 芥蓝BoaBKI1克隆和表达所用引物Table 1 Primer sequences for cloning and expression of BoaBKI1 genes in Chinese kale
连接目的基因片段至T-vector pMD19,16℃下过夜。将连接产物加入大肠杆菌感受态中,涂布于含Amp的LB固体培养基上,于37℃培养过夜。挑取培养基的单克隆菌落,于LB液体培养基扩大培养,菌液PCR后筛选阳性克隆,送至生工生物工程(上海)股份有限公司测序,对测序结果进行比对分析。
1.6 生物信息学分析
利用NCBI-ORF、ProtParam、DNAStar、SignaIP、softberry-ProtComp、TMHMM、NCBI-CDD、DNA-man和MEGA 6.0等软件,对得到的BoaBKI1基因核苷酸序列进行开放阅读框寻找[17]、计算分子量、等电点和不稳定系数,蛋白质二级结构预测,信号肽预测、亚细胞定位预测、跨膜区预测和保守结构域分析,氨基酸多重序列比对及系统进化树的构建[18]。
1.7 基因表达半定量分析
根据已克隆得出的芥蓝BoaBKI1基因序列,设计半定量引物BKI1semiRT,内参基因β-actin参考引用Yi D.X.等的引物(表1)[19]。以芥蓝不同时期、不同组织器官的cDNA为模板,进行半定量PCR分析。使用2×Easy TaqPCR SuperMix for PAGE进行扩增,扩增体系为:cDNA模板1 μL,上下游引物10 μmol/L各 1 μL,2×Easy TaqPCR SuperMix 10 μL,DEPC 处理水 7 μL。扩增条件:94 ℃ 3 min;94 ℃ 30 s,BoaBKI157 ℃ 30 s,β-actin55℃ 30 s,72 ℃ 30 s,30个循环;最后72℃延伸10 min。用1%琼脂糖凝胶电泳检测PCR产物,采用Gel-Pro软件对电泳结果进行光密度定量分析,基因表达水平用相对于β-actin基因表达量的百分数值表示,3次重复,所得数据用Microsoft Excel 2013和SPSS 18.0软件进行整理和统计分析。
2 结果与分析
2.1 芥蓝BoaBKI1基因克隆
分别以芥蓝DNA和cDNA为模板进行PCR扩增,电泳检测发现条带均约1 000 bp,与预测片段的大小相符(图1),然后分别进行PCR产物的回收、连接至载体、转化,挑取阳性克隆进行测序,两者的测序结果完全一致,测序所得序列为1 026 bp,将该基因命名为BoaBKI1,其在GenBank中的登录号为:KX426041。
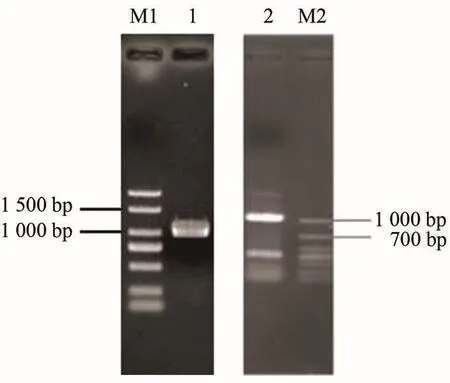
图1 BoaBKI1基因PCR扩增产物Figure 1 PCR amplification product of BoaBKI1
2.2 序列分析
利用NCBI、DNA-man软件对芥蓝BoaBKI1基因进行基因结构分析,发现该基因只有一个外显子,并无内含子。进一步通过NCBI-ORF、ExPASy软件对芥蓝BoaBKI1基因所编码的氨基酸进行理化分析,结果表明BoaBKI1由20种氨基酸共341个氨基酸残基组成,其理论分子量为37.30 kD,等电点为9.67,分子式为C1603H2586N476O534S7,不稳定指数为54.20,是不稳定蛋白。
利用DNAstar软件对芥蓝BoaBKI1蛋白二级结构进行预测分析(图2),依据Chou-Fasman法,发现BoaBKI1蛋白的α螺旋结构有8个,β折叠结构有7个,β-转角结构有31个;KarplusSchultz法预测BoaBKI1柔性结构区段有12个;KyteDoolittle法预测BoaBKI1蛋白大多数氨基酸为亲水性氨基酸。

图2 BoaBKI1蛋白二级结构预测Figure 2 Secondary structure prediction of BoaBKI1 protein
SignaIP软件预测显示,BoaBKI1蛋白不存在明显的信号肽,属于非分泌性蛋白;softberry-ProtComp软件对其进行亚细胞定位预测,结果显示BoaBKI1蛋白定位于细胞质或细胞膜。所得氨基酸序列在NCBI网站上进行保守结构域分析,没有推定的保守结构域被检测到。
使用NCBI-BLASTp程序进行芥蓝BoaBKI1氨基酸序列(图3)的同源性比对,结合DNA-man软件进行分析(图4),多重序列比对结果显示:芥蓝BKI1蛋白与甘蓝的序列一致性达到100%,与同属植物欧洲油菜、芜菁的一致性超过97%,与同为十字花科植物的拟南芥、亚麻芥和荠菜的一致性超过75%,与葡萄、菜豆、陆地棉和毛果杨等植物的一致性不低于30%。

图3 BoaBKI1基因编码区及氨基酸序列Figure 3 CDS and amino acid sequences of BoaBKI1 gene

图4 BoaBKI1与其他植物BKI1蛋白的氨基酸序列比对Figure 4 Amino acid sequence alignment of BoaBKI1 protein with other BKI1 proteins
在同源性分析的基础上,将来自33种不同植物的BKI氨基酸序列以距离矩阵法中的邻接法(neighbor-joining method)做N-J聚类分析,构建进化树(图5)。结果显示,33种植物首先分为两个大的类群,一类为大叶藻、蒺藜苜蓿、蓟和鹰嘴豆等较低等植物,另一类为其它草本及木本植物。在草、木本植物的大类群中又可以分为两类,一类为白花菜目的十字花科和白花菜科植物,另一类为除白花菜目的其他草、木本植物。白花菜目植物中,芥蓝首先与9种十字花科植物聚在一小类,其中又与同为芸薹属蔬菜的甘蓝、欧洲油菜以及芜菁的距离更近,且与甘蓝和欧洲油菜在同一分支。
2.3 BoaBKI1基因表达分析
2.3.1 BoaBKI1在不同时期的表达
芥蓝BoaBKI1基因在萌动种子期、子叶期、真叶期和成熟叶片期均有表达,并且在整个发育时期中,呈现先上升后下降的趋势,其中真叶期表达量最高,其次为子叶期和成熟叶片期,萌动种子期的表达量最低(图6)。
2.3.2 BoaBKI1在成熟期不同器官的表达
图6显示BoaBKI1基因在芥蓝不同器官中均有表达,其中在叶片、叶柄中的表达水平明显高于其他器官,在果荚中的表达量次之,在幼果、根系中的表达量较低,在花序、花薹中表达水平最低。

图6 芥蓝不同发育时期和不同器官中BoaBKI1的表达Figure 6 Expression of BoaBKI1 in different developmental stages and organs of Chinese kale
2.3.3 BoaBKI1在花器官的表达
对芥蓝花器官中BoaBKI1的表达水平进行分析后发现,BoaBKI1基因在花蕾和开放花朵的各组织中均有表达。花蕾中花瓣和雌蕊的BoaBKI1表达水平最高,其次是雄蕊,萼片中表达水平最低。开放花朵中雌蕊表达量最高,其次是雄蕊和花瓣,萼片中表达量最低。伴随花朵开放,BoaBKI1基因在各组织中表达水平均出现上调,其中雌蕊和雄蕊上调趋势最为显著(图7)。

图7 芥蓝花器官不同组织BoaBKI1的表达量Figure 7 Expression of BoaBKI1 in different tissues of flower organs in Chinese kale
3 讨论
本试验克隆获得了芥蓝油菜素甾醇相关基因BoaBKI1的cDNA序列,同源序列比对及进化树分析表明BoaBKI1与其他植物的BKI1蛋白在氨基酸序列上有较高的一致性,与同为芸薹属的甘蓝和欧洲油菜在同一分支,与苹果等木本植物在不同分支,即BKI1蛋白在同科属植物间较为保守,在亲缘关系较远的不同属植物间较不保守。据亚细胞定位预测结果显示,BoaBKI1蛋白定位于细胞质或细胞膜,这与拟南芥AtBKI1在烟草上的定位结果相同[20],由此可推测该基因可能在细胞质或细胞膜上参与BR信号途径的调控。
基因表达分析发现,BoaBKI1基因在芥蓝不同发育时期均有表达。其中,真叶期表达量最高,子叶期次之,萌动种子期的表达量最低;在芥蓝不同器官中也均有表达,其中在叶片、叶柄中的表达水平明显高于其他器官,在果荚中的表达量次之。Wang X.L.等[21]研究了AtBKI1在拟南芥幼苗中的表达情况,发现AtBKI1在两周大幼苗叶片、叶柄和茎尖中的表达量高,在根中的表达量次之,果荚中的最低,这与我们的试验结果基本一致。刘彩霞等[22]在对甘蓝型油菜BRI1的研究中发现,各时期及器官中BRI1表达情况为四叶一心时期的叶中最高,根中较低。此外,郝岭等[23]的研究进一步表明了玉米幼嫩组织中BRI1表达量高,它能促进叶片变大与叶柄伸长。在以往研究中发现,BR信号转导途径中BRI1与BKI1的密切关联,它们在植物体内的相互作用具有高度特异性,且两者在植物中的表达规律有相似之处,这显示了BRI1和BKI1在一些组织中共表达的可能性[21]。种子形成时,为提供大量营养物质促进种子成熟,植物体内的BR激素合成增加,诱导BRI1-BAK1蛋白质受体合成[22],此时,活化的BRI1将BKI1磷酸化,并使其从质膜上脱离并进入细胞质[12],致使BKI1在果荚中的表达量较低。至于萌动种子期,推测是因为种子萌发主要是BR与其他植物激素互作促进的[24],且该时期BRI1的表达量较低[22],BKI1可能与BRI1的结合并不剧烈而使得表达量较低。
BoaBKI1基因在花蕾和开放花朵的各组织中均有表达。在这两个花器官中,花蕾中花瓣BoaBKI1的表达水平最高,开放花朵中则是雌蕊,而两者中表达量最低的都是萼片。花瓣的展开是由花蕾到开放花朵转变的明显标志,为了促进花朵的开放,一些BR信号通路上的基因如BRI1的表达有所上升[25],相应的,为了使BRI1的表达量维持在一定水平[12],花瓣中BKI1表达量也会随之增加。BR是由花粉提纯而来的活性物质,可通过降低开花抑制因子的转录水平来促进花朵的开放[26],从花蕾到花朵开放,雄蕊产生花粉的速度增加,花粉的活力逐渐增强,此时的雄蕊中BR储备丰富,造成了大部分BKI1与BRI1脱离。随着花朵的逐渐开放,在雌蕊中BR含量可能会有略微增加,BRI1的表达量受到BR刺激也会有所增加,Nie S.M.等[27]发现过表达BRI1的番茄株系中花变大,花瓣和花柱均变长,花柱变长后,可能会阻碍花粉进入子房,造成结实率下降,为了避免这一现象,雌蕊中的BKI1的表达量会大幅增加[21],从而与大部分BRI1结合,使得结实率维持在一定水平。BoaBKI1在萼片中表达量最低,可能是BR信号通路主要在雄蕊、雌蕊和花瓣这几个组织中起作用,从而促进开花受精形成种子。
4 结论
本试验成功克隆了芥蓝BR信号传导途径中的受体激酶抑制剂BoaBKI1,并对其进行生物信息学分析,接着通过对BoaBKI1进行时空表达分析,发现该基因在芥蓝的不同时期、器官和组织中都有一定程度的表达,说明该基因在芥蓝的不同生长发育过程中均起到作用。所得结果为研究芥蓝BoaBKI1的功能和在BR信号传导过程中的调节机制奠定了基础。

