芹菜TCP基因家族全基因组鉴定、进化分析和表达研究
周 瑾,李 洁,李晓燕,肖丹怡,李梦瑶
(四川农业大学园艺学院,成都 611130)
芹菜(Apiu m graveolens L.)也称旱芹,是伞形科芹属重要的二年生蔬菜作物,原产于地中海沿岸地区。芹菜在我国有着悠久的种植历史,目前在南北地区广泛栽培,是中国人餐桌上最常见的佳肴之一。芹菜富含多种营养物质,例如蛋白质、碳水化合物、维生素和挥发性芳香成分;同时还具有平肝清热、健胃利血、降低血压等多种药理功效,受到越来越多消费者青睐[1-2]。但芹菜喜冷凉,不耐高温,夏季高温严重影响芹菜产量和品质,制约了芹菜的周年生产。
转录因子(transcription factor)是一类能特异结合DNA的蛋白,在高等植物各类基因的时空表达中扮演着重要的角色,能激活或抑制下游基因的表达,参与逆境胁迫和生长发育等关键生物学过程[3]。TCP家族是植物特有的一类转录因子家族,TCP的名字来源于最早鉴定的4个特征成员:玉米(Zea mays)中的TB1(Teosinte Branch 1),金鱼草(Antirrhi⁃num majus)中的 CyC(Cycloidea),以及水稻(Oryza sativa)中的PCF1和PCF2(PROLIFERATING CELL FACTORS 1 and 2),它们的首字母缩写构成了TCP的名字[4-6]。TCP转录因子含有一个保守的TCP结构域,在N端构成一个基本的螺旋-环-螺旋(BHLH)结构。该结构域对DNA结合至关重要,并参与蛋白质与蛋白质的相互作用[7-8]。根据TCP结构域的氨基酸序列相似性,将TCP基因分为两大亚族:ClassⅠ亚族(PCF或TCP-P)和ClassⅡ亚族(TCP-C)[9]。这两类蛋白之间最显著的区别是在I亚族蛋白的碱性区域相对于Ⅱ类蛋白缺失了4个氨基酸。根据氨基酸序列的差异,Ⅱ亚族蛋白又可进一步分为CIN和CYC/TB1两个亚类,尤其是在TCP结构域的碱性区域。
随着多个物种基因组测序的完成,越来越多的TCP转录因子家族相继被挖掘和鉴定。研究表明,TCP基因在植物生长发育的许多生物学过程中发挥着重要作用,包括种子萌发[10]、叶片形态发生[11]、叶片发育[12]、分枝[13]和激素信号转导[14]等途径。例如,在水稻中,OsTB1基因参与水稻[15]的侧枝发育过程;拟南芥的AtTCP5、AtTCP13、AtTCP17和AtTCP24与叶片发育相关[16]。CIN亚类的另外3个基因AtTCP5、AtTCP13和AtTCP17在促进下胚轴伸长方面起着重要作用[17]。此外,还有研究发现TCP可能参与了花青素积累,通过在山茶转录组注释结果中搜索,发现了两个TCP负调控因子在花青素合成中可能起抑制作用[18]。
TCP还受到外界环境信号的调节,在逆境胁迫中起着重要的调控作用。在茶树中,TCP19、TCP20、TCP12和TCP32在盐胁迫和低温处理后分别上调,TCP18和TCP30在低温处理后分别表达下调[19]。OsPCF5和OsPCF8能够调控水稻的耐冷性[20]。拟南芥TCP5及TCP17基因在高温下可促进光敏色素相互作用因子4(PIF4)的表达来调控对高温胁迫的抵御[21]。基于转录组测序的分析发现马鞍藤TCP家族成员在高温胁迫下差异表达,可能在植物应对极端温度中发挥关键作用[22]。
TCP家族成员参与植物生长发育及逆境胁迫应答的多个生物学进程,该家族成员的功能研究受到科研工作者的广泛关注[23]。芹菜基因组测序的完成,对挖掘TCP家族成员提供了数据基础,然而至今对芹菜TCP基因的全面挖掘及其响应逆境胁迫的研究还未有报道。本研究通过生物信息学方法对芹菜基因组数据库进行检索,筛选并鉴定了芹菜所有的TCP基因,分析了该家族成员的理化性质、基因结构、系统进化及基因表达模式,旨在为进一步研究TCP基因在芹菜生长发育及逆境胁迫中的作用提供参考。
1 材料和方法
1.1 芹菜TCP基因的筛选与鉴定
从已公布的两个芹菜基因组数据库(http://apiaceae.njau.edu.cn/celerydb[24]和http://celerydb.bio2db.com/[25])下载芹菜蛋白序列,构建本地blast数据库。从Pfam数据库(http://pfam.xfam.org/)下载TCP保守结构域种子文件(PF03634),利用HMMER软件从芹菜蛋白序列中检索TCP蛋白序列。去除冗余,将所得结果用NCBI-CDD和Pfam(http://pfam.xfam.org)进行TCP结构域的进一步确认[26]。接下来利用TargetP(http://www.cbs.dtu.dk/services/TargetP/)和WOLF PSORT(https://www.genscript.com/wolf-psort.html)对TCP进行亚细胞定位分析。利用ExPASy网站(http://web.expasy.org/protparam/)对最终确认的芹菜TCP蛋白序列进行理化性质分析等。
1.2 芹菜TCP基因家族系统进化及种间共线性分析
拟南芥的TCP蛋白序列从PlantTFDB(http://planttfdb.cbi.pku.edu.cn/)下载获取,水稻的TCP蛋白序列从TAIR(https://www.arabidopsis.org/)下载获取。使用默认设置的ClustalX(v.2.1)对所有TCP氨基酸序列进行多序列联配,通过MEGA6.06软件采用邻接法(NJ)构建了系统进化树,校验参数bootstrap重复1 000次[27]。伞形科植物的基因组序列和注释从胡萝卜数据库(https://phytozome-next.jgi.doe.gov/pz/portal.html)和香菜数据库(http://cgdb.bio2db.com/)获得。物种之间的共线性关系通过MCScanX软件进行分析,并通过TBtools软件进行可视化。
1.3 芹菜TCP基因家族染色体定位分析
从芹菜基因组数据库下载获取芹菜基因组信息,采用 MapInspect(http://mapinspect.software.informer.com)软件绘制TCP家族成员的染色体位置分布图[28]。从芹菜基因组数据库中获得所有AgTCP基因起始密码子上游1 500 bp的启动子序列,使用PlantCARE网页版软件鉴定(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)顺式作用元件。
1.4 芹菜TCP基因家族基因结构和保守基序分析
芹菜TCP基因内含子和外显子的结构分析通过比对基因序列信息与编码序列信息,登录GSDS(http://gsds.cbi.pku.edu.cn/)网页版软件进行绘制。利用在线网站MEME(http://meme-suite.org)对芹菜TCP家族成员进行motif分析[29],输出的结构域数目最大为15,参数设定保守基序(motif)大小为10~100 aa。采用ClustalX软件对TCP成员的保守结构域进行分析,使用TBtools软件可视化,在GenDOC中查看结果。
1.5 转录表达丰度分析
不同颜色的芹菜转录组测序数据下载于国家基因组科学数据中心(https://ngdc.cncb.ac.cn/),登录号为CRA001997,芹菜高温胁迫及不同组织的转录组测序数据由本课题组完成。使用FPKM值来反映AgTCP基因在不同样品中的表达丰度,基因表达热图使用Microsoft Excel作图。
1.6 RNA提取和荧光定量验证
芹菜种植于四川农业大学园艺学院实验教学基地,生长1个月后在38℃下进行高温处理,设置1个对照CK(0 h)和3个处理阶段(2、4和24 h),取健壮植株的叶片与茎段作混样,使用深圳艾伟迪生物(http://www.aivdbiotech.cn/index.php)植物总 RNA提取试剂盒提取芹菜RNA,使用北京擎科生物(https://tsingke.com.cn/)逆转录试剂盒将RNA反转获得芹菜cDNA。采用Bio-Rad Real-time PCR System和Bio-Rad CFX Manager进行实时定量PCR。根据芹菜TCP基因序列,设计荧光定量引物(表1),以反转录获得的cDNA稀释10倍作为模板,按照全式金公司(https://www.transgen.com.cn/)荧光定量试剂盒说明书配制反应体系,反应条件设定:95.0℃预变性1 min,95.0℃ 10 s,58.0℃ 15 s,39个循环,所有设定保存后运行程序,每个样品设3次重复。以芹菜AgTUB基因作为内参,相对定量计算公式采用 2-△△CT,△CT=CT(目标基因)-CT(AgTUB)。获得数据使用Microsoft Excel分析,Origin 2019作图。

表1 荧光定量中引物序列Table 1 Primer sequence s in qRT-PCR
2 结果与分析
2.1 芹菜TCP转录因子的鉴定
基于芹菜全基因组数据,总共鉴定出29个芹菜TCP基因,将其命名为AgTCP1~29(表2)。AgTCPs编码的氨基酸长度范围为129(AgTCP17)~462(AgTCP27)个氨基酸,分子量范围为15 004.08 Da(AgTCP17)至48 800.74 Da(AgTCP27),等电点的值范围为5.09至10.52。就氨基酸组成而言,芳香族氨基酸平均仅占7%,脂肪族氨基酸平均占16%,碱性氨基酸和酸性氨基酸平均分别占14%和10%。所有AgTCP蛋白的GRAVY值为负,表明它们都是亲水性的蛋白。同时,根据亚细胞定位分析发现大多数基因主要位于细胞核中。
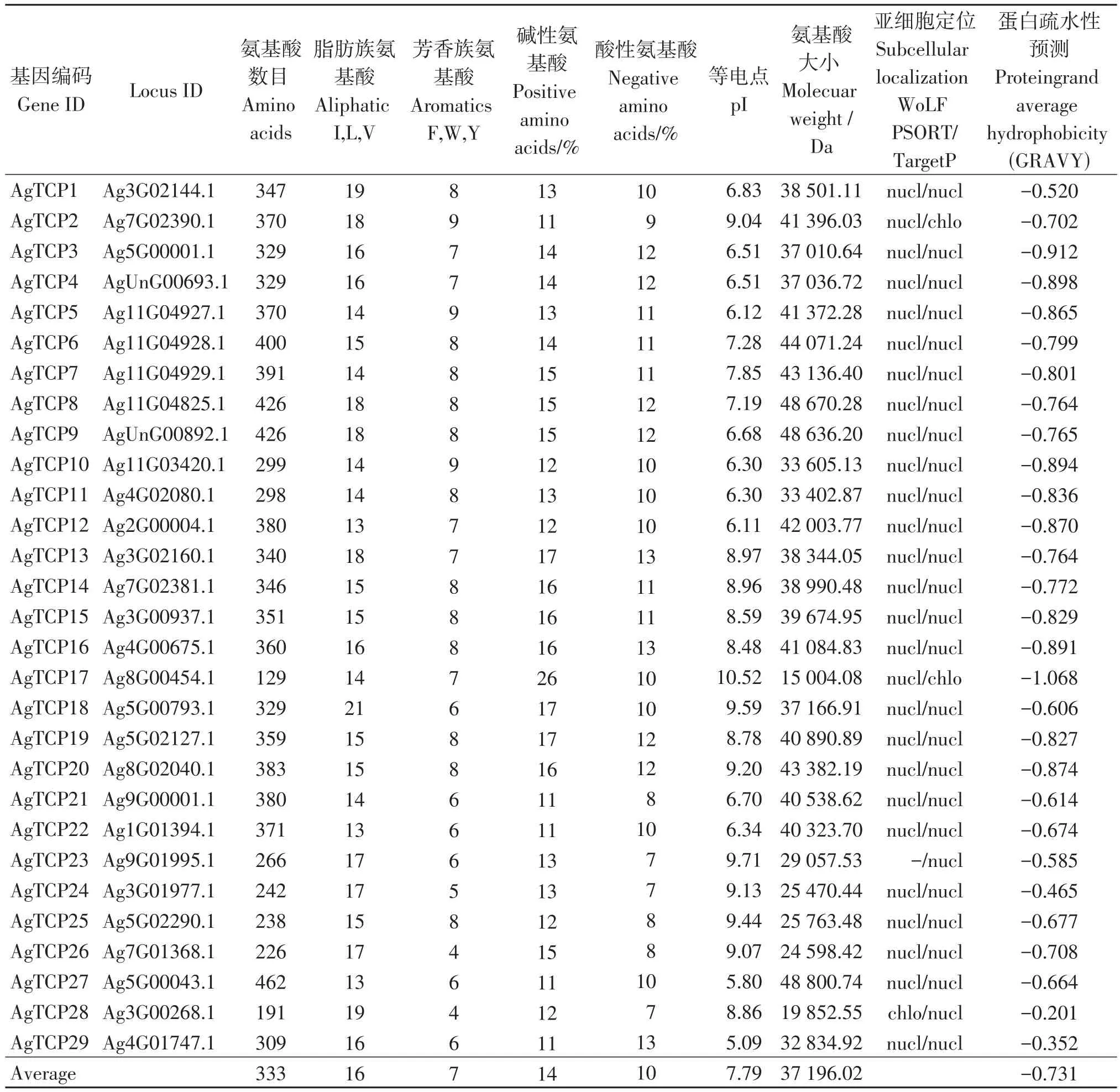
表2 芹菜TCP基因家族成员基本信息Table 2 Basic information of TCP gene family members in A.graveolens
2.2 芹菜TCP基因家族染色体定位分析
在29个芹菜TCP基因中,27个基因在9条染色体上呈现不均匀分布,其余2个基因位于未组装到染色上的重叠群上,其余染色体不含芹菜TCP基因(图1)。且在染色体03、05和11分布的基因较多,均含有5个芹菜TCP基因。除未鉴定的重叠群外,染色体01和02分别只定位到了1个基因。此外,部分TCP基因聚集在染色体上相同或者相近的区域,例如在05号染色体上AgTCP3和AgTCP27聚集在长臂,AgTCP2和AgTCP14聚集在07号染色体短臂,AgTCP5、AgTCP6和AgTCP7聚集在11号染色体长臂。
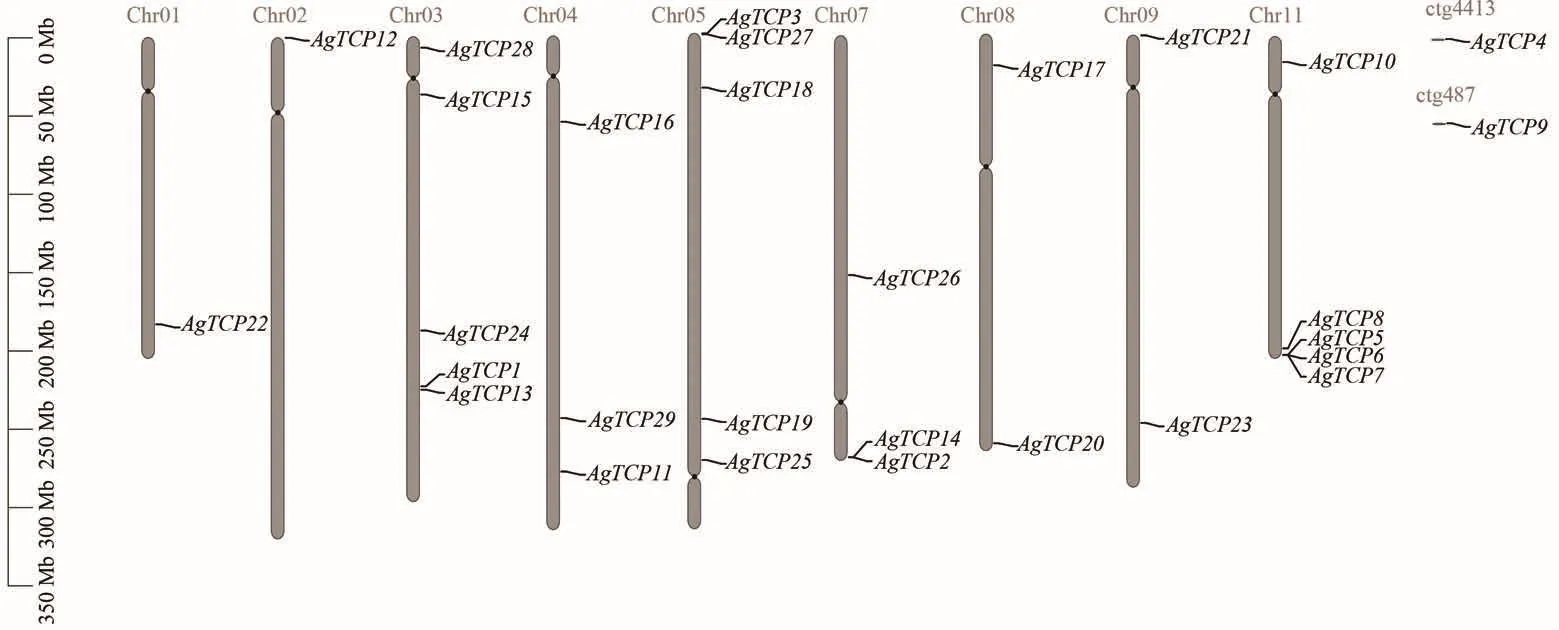
图1 芹菜TCP基因家族染色体定位Figure 1 Chromosome location of AgTCPs genes in celery
2.3 芹菜TCP基因家族系统进化树分析
为了分析芹菜TCP基因家族的进化关系,本研究选用了模式植物单子叶植物水稻和双子叶植物拟南芥与芹菜共同构建系统进化树。21个水稻TCP蛋白、24个拟南芥TCP蛋白和29个芹菜TCP蛋白在系统进化树中呈现出了明显的聚类现象。在图2中,根据基因聚类TCP基因家族可分成ClassⅠ和ClassⅡ两个亚族,其中ClassⅡ亚族还可以细分成ClassⅡ-a(CIN)和ClassⅡ-b(CYC/TB1)两个亚族。在这3个亚族中,ClassⅡ-b(CYC/TB1)亚族所含有的TCP基因数目最少,其中芹菜有8个,水稻和拟南芥仅分别有3个;TCP基因家族成员最多的是ClassⅠ(PCF),包含有芹菜9个TCP基因、水稻10个TCP基因和拟南芥13个TCP基因。而在ClassⅡ-a(CIN)亚族中,分别有12个芹菜、8个水稻和8个拟南芥TCP基因。
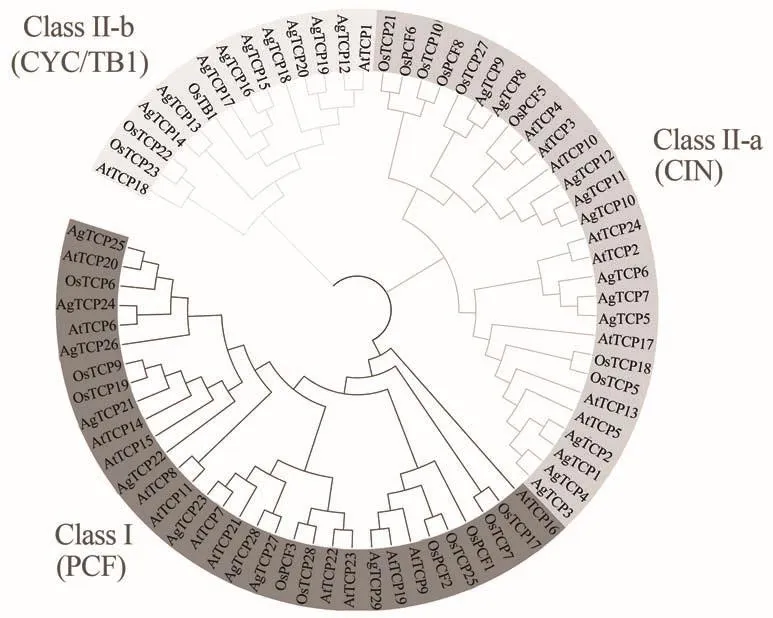
图2 芹菜、拟南芥和水稻TCP基因系统进化树Figure 2 Phylogenetic tree of TCPs in A.graveolens,Arabidopsis thaliana and O.sativa
2.4 芹菜TCP基因家族基因结构及保守基序分析
根据基因结构分析显示,芹菜的29个TCP基因家族成员全部具有编码区域(CDS),只有少数基因有内含子和非翻译区(UTR),其中内含子序列较长的是AgTCP1(图3)。同时,序列相似性更高的AgTCPs在结构上更相似,例如属于ClassⅡ(CYC/TB1)的AgTCP13~20,除AgTCP17外的其他基因编码区域长度相似,且结构也相似,因此,与其他亚家族相比,ClassⅡ-b中AgTCPs的基因结构更为保守。
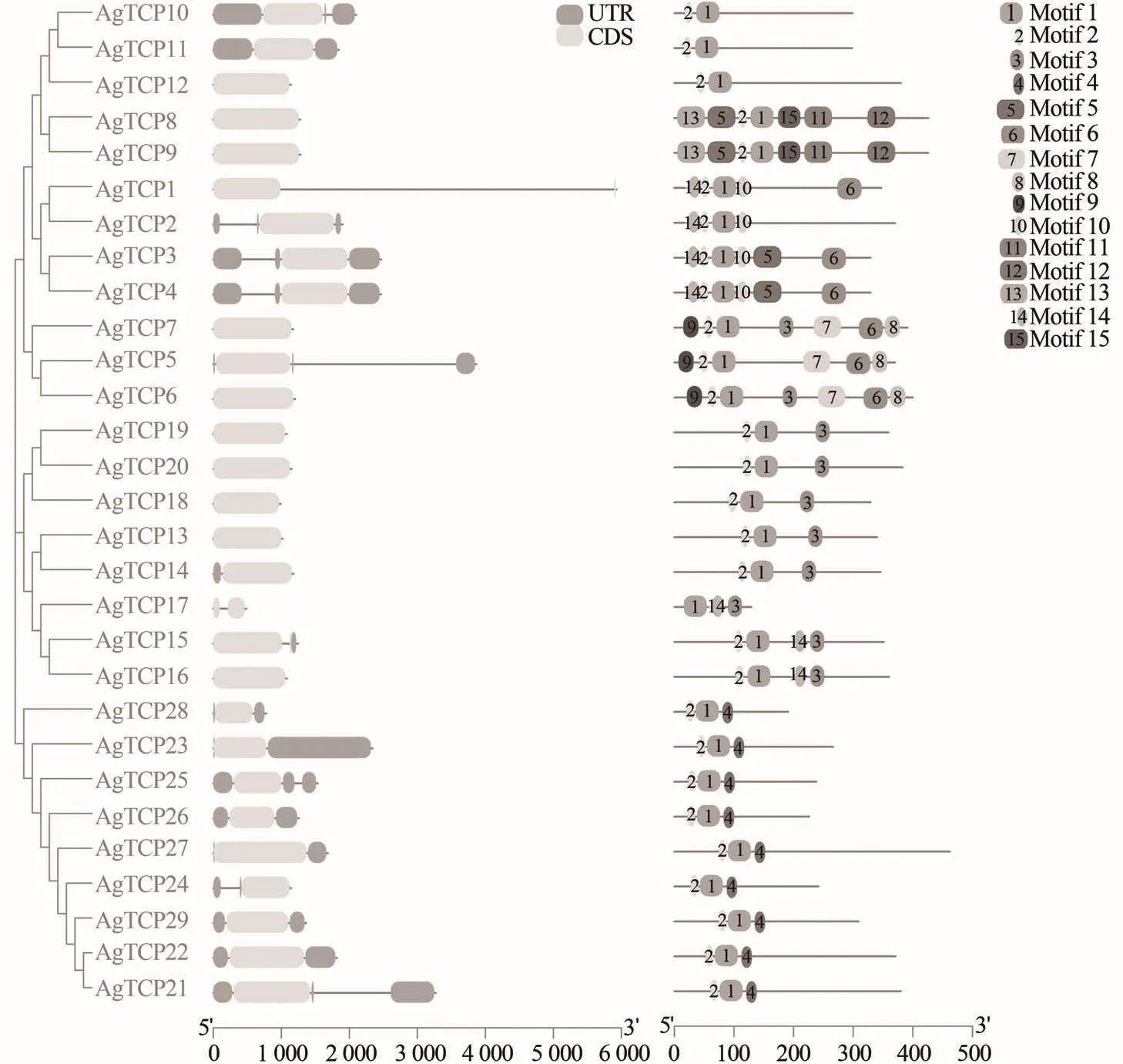
图3 芹菜TCP基因家族基因结构及保守基序Figure 3 Gene structure and conserved motifs of A.graveolens TCP gene family
此外,为了更好地了解芹菜TCP蛋白序列中保守结构,采用MEME软件分析TCP蛋白结构,鉴定了15个不同的保守基序(表3)。位于同一亚族的大部分芹菜TCP成员具有类似的保守基序,与家族系统进化树的分组情况恰相吻合,都表现出了一定的排列规律。芹菜所有TCP基因都含有该家族最基本的motif 1和motif 2。此外,ClassⅠ亚族的基因成员特异性地含有motif 4,ClassⅡ-b特异性含有motif 3。ClassⅡ-a亚组基序除了较为保守的motif 1和motif 2外,蛋白间保守结构差异较大。由此分析,不同亚族的TCP家族成员参与协调了生长发育的特定过程的原因可能是具有各自特异的保守结构。
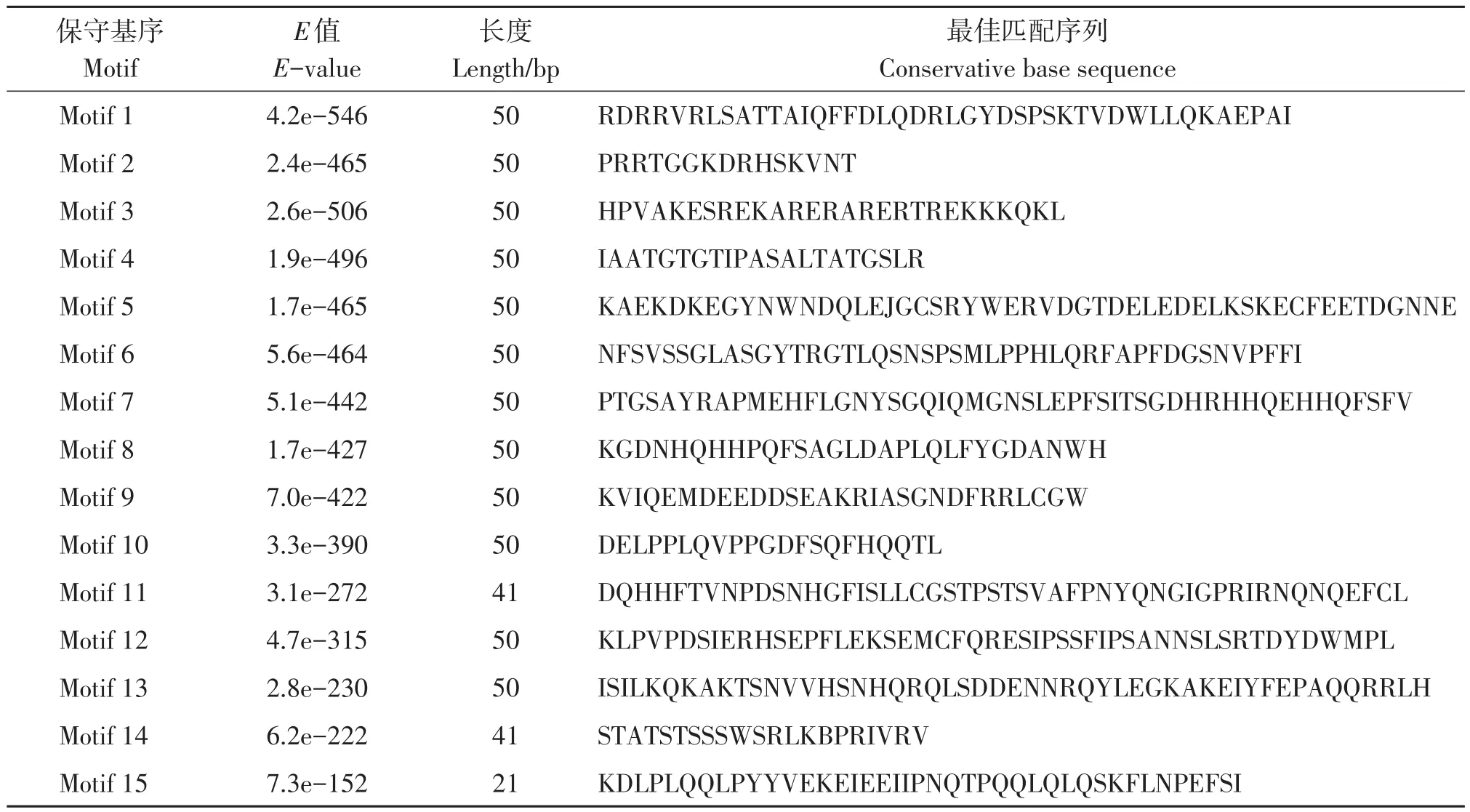
表3 AgTCPs中的保守基序和序列Table 3 Conserved motifs and sequences in AgTCPs
2.5 芹菜TCP基因家族启动子区域顺势作用元件分析
为了进一步预测AgTCPs基因的功能,使用在线软件PlantCARE分析了翻译起始位点1 500 bp上游序列(启动子区域)中的顺式调控元件。结果显示,与植物生长发育相关、胁迫反应相关、和激素反应有关的顺式作用元件在多个AgTCPs基因启动子区域被鉴定。如图4所示,分别在24个和21个AgTCPs基因的启动子区域中鉴定了与植物生长和发育过程中参与光响应的元件Box 4和G-box,同时也发现了控制植物昼夜节律的顺式作用调节元件(circadian)和与植物分生组织表达有关的顺式作用调节元件(CAT-box)。在激素相关元件中,总共12水杨酸响应元件(TCA-element)、54个ABA响应元件(ABRE)、12个赤霉素响应元件(TATC-box)和33个茉莉酸甲酯响应元件(CGTCA-motif)在AgTCPs基因中出现。大量的激素响应元件在启动子区域被鉴定表明激素在植物生长发育过程中有着尤为重要的作用。同时,还在多个芹菜TCP基因的启动子中检测到了厌氧诱导(ARE)、低温(LTR)、干旱诱导(MBS)和应激响应(STRE)等元件。
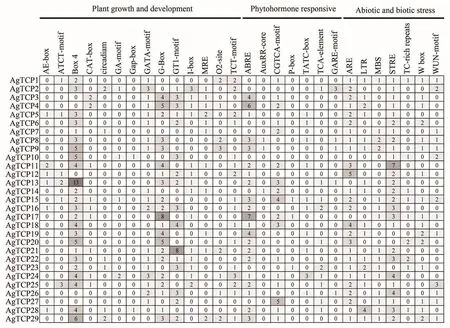
图4 芹菜TCP基因家族启动子区域顺式作用元件Figure 4 Cis-acting elements in the promoter region of AgTCPs genes in celery
2.6 伞形科作物芹菜、胡萝卜和香菜的共线性分析
通过对芹菜、胡萝卜及香菜的共线性关系进行分析(图5),胡萝卜和芹菜基因组间有35 653个共线性区域,共线基因数占总基因数的58.95%。在胡萝卜基因组中共筛选到50个TCP基因,其中,20个胡萝卜TCP基因和19个芹菜TCP基因之间共检测到27个同源基因对。芹菜和香菜基因组间有38 311个共线性区域中,共线基因数就总基因数的60.24%。在香菜基因组中共筛选到43个TCP基因,其中,21个香菜TCP基因和18个芹菜TCP基因之间共检测到31个同源基因对。同属于伞形科作物的胡萝卜、芹菜、香菜基因组具有大量的保守区域及同源基因对,充分说明了三者亲缘关系较近。
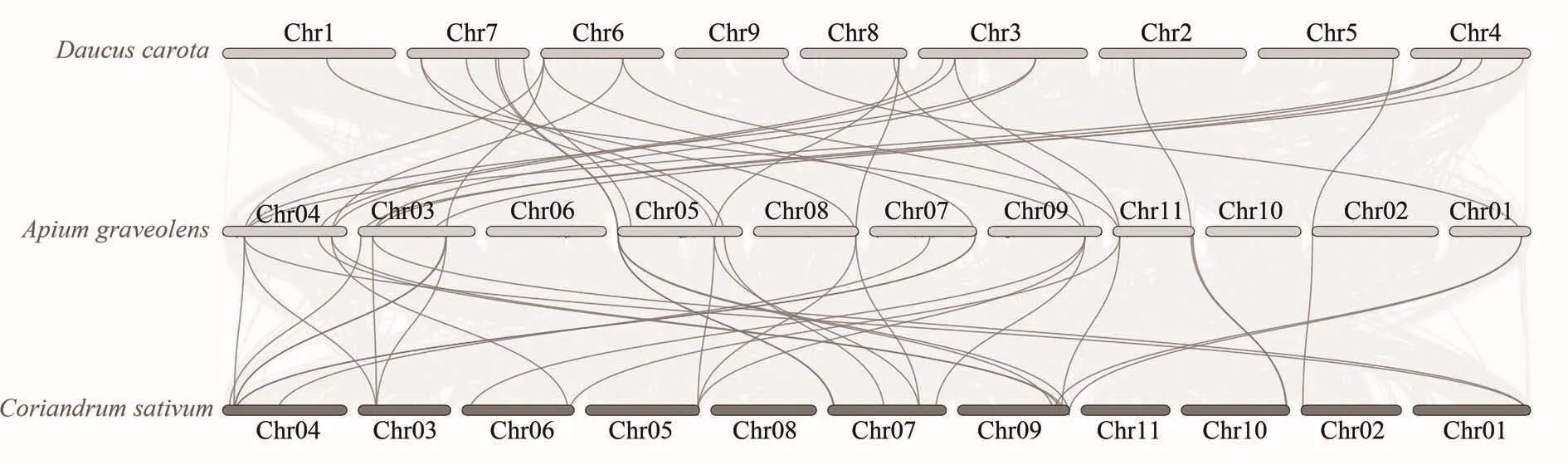
图5 伞形科作物共线性分析Figure 5 Collinearity analysis of Apiaceae plants
2.7 芹菜AgTCPs表达模式分析
为了了解TCP基因家族的表达特征,下载并分析了芹菜不同组织、不同品种和高温胁迫下的转录组表达丰度。如图6A,各个亚族内的TCP基因在不同组织内表达模式具有高度的相似性,例如,ClassⅠ亚族(AgTCP21~29)在根、叶柄和叶片3个组织中表达水平均较高,其中AgTCP23表达丰度最高,表明了ClassⅠ亚族基因与芹菜不同组织的形态建成、激素调节和胁迫反应等过程都密切相关。而ClassⅡ-b(AgTCP13~20)在3个组织中的表达水平均较低,表达水平没有太大差异。但AgTCP1~12即使来自同一亚族,不同成员的表达方式也不同,大多数基因在叶片高表达,部分基因在根部表达水平较低。
如图6B所示,ClassⅠ(AgTCP21~29)亚族在白色、绿色和红色芹菜中的表达丰度较高。虽然ClassⅡ两个亚族的表达丰度总体较低,但AgTCP6、AgTCP7和AgTCP12这3个基因的表达丰度却较高。28个AgTCPs在白色、绿色和红色芹菜3种芹菜中的表达丰度近似,而仅有AgTCP4在绿色芹菜的表达丰度较高而在白色和红色芹菜表达中较低。
如图6C所示,ClassⅡ-b亚族(AgTCP13~20)在高温处理前后的表达水平较低,多数基因的表达呈下降的趋势。而在ClassⅡ-a亚族中,AgTCPs的表达水平都较高,但在高温处理2 h后表达有所下降,其中AgTCP12的表达水平在高温处理4 h和24 h后又上调,但仍低于高温处理前。ClassⅠ中的AgTCP24~29在高温处理后表达水平明显增加,尤其表现在高温处理24 h后,表明ClassⅠ亚族可能与高温胁迫下的应答有关。
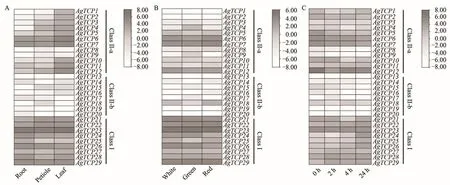
图6 AgTCPs在芹菜中的表达模式Figure 6 Different expression patterns of AgTCPs in celery
2.8 qRT-PCR验证TCP基因在高温胁迫下的表达趋势
为验证芹菜TCP家族ClassⅠ亚族成员(AgTCP21~29)基因在高温胁迫下的应答模式,采用荧光定量PCR分析了AgTCP21~29在高温胁迫状态下的表达水平。结果如图7所示,ClassⅠ亚族成员在高温处理下都有一定程度的响应。AgTCP22和AgTCP25在高温处理后,表达水平持续增加。AgTCP21、AgTCP23、AgTCP27、AgTCP28和 AgTCP29基因在处理后2 h、4 h时高表达,但随着处理时间的增加,在24 h时表达有所下调。AgTCP24和AgTCP26基因在处理后2 h表达水平波动幅度较小,在4 h和24 h时其表达量显著上升。同转录组数据比较,荧光定量验证结果与转录表达丰度表现出较好的一致性,进一步表明ClassⅠ亚族成员可能参与了高温胁迫的应答。
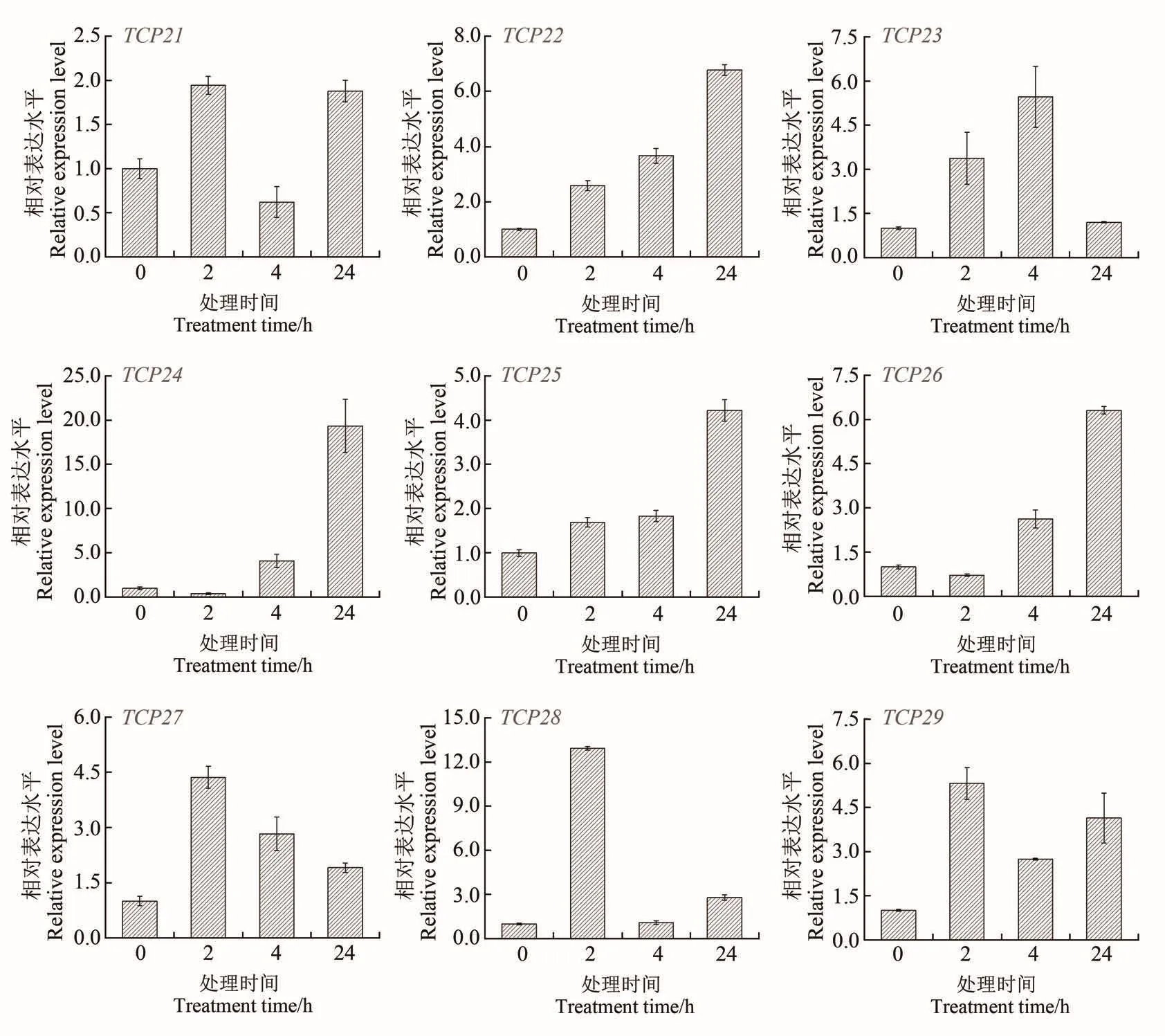
图7 芹菜TCP家族ClassⅠ亚族成员在高温胁迫下表达分析Figure 7 Relative expression levels of TCP genes of the ClassⅠin celery under heat temperature stress
3 讨论与结论
TCP基因家族是一类高等植物所特有的转录因子,具有高度保守的结构域[30]。随着高通量测序的发展,越来越多的植物完成了全基因组测序,多个物种的TCP家族成员被鉴定和分析。本研究采用生物信息学方法对芹菜TCP进行检索,共鉴定了29个芹菜TCP家族成员。植物中TCP家族成员的数量相对保守,拟南芥中共鉴定到23个[31]、水稻22个[31]、高粱20个[32]、紫花苜蓿21个[33]和桃20个[34]。
本研究中进化关系分析表明,29个芹菜TCP蛋白可分为3大亚类:ClassⅠ(PCF)、ClassⅡ-a(CIN)和 ClassⅡ-b(CYC/TB1),这与前人对TCP转录因子的研究结果相似。植物在长期的进化过程,物种间既保留了共同祖先的一些特征,每个物种也会形成自己特有的特征。芹菜在进化过程中经历了一次全基因组三倍化事件(双子叶植物共有)和两次全基因组二倍化事件,大量基因发生了扩增或收缩[24]。与拟南芥和水稻的各亚组成员数目相比,芹菜的ClassⅡ-b(CYC/TB1)亚族数目显著多于水稻和拟南芥。暗示在芹菜进化过程中可能为了适应生存环境的变化,该亚组发生了扩增,在植物适应性方面发挥了潜在作用。根据进化树分析的结果,聚类关系越是相近的基因,说明功能和结构更为相同或者相近。亚细胞定位分析推测绝大多数TCP基因位于细胞核中,可能发挥转录调控的功能。光响应的元件(如 Box 4、GT1-motif)、ABA 响应元件(ABRE)、茉莉酸甲酯响应元件(CGTCA-motif)、低温(LTR)和伤诱导(W box)等顺式作用元件在植物生长发育、植物激素反应和胁迫反应中具有重要的作用[35]。芹菜TCP成员富集了大量的顺式元件,推测AgTCPs是芹菜非常重要的一类转录调控基因,可能参与了芹菜生长发育和多种生物学过程。前人研究也发现茶树TCP启动子中也分布了大量的与逆境相关的LTR、W box等顺式作用元件[19]。小麦TCP成员启动子也富含ABRE、CGTCA-motif等激素相关的顺式作用元件[36]。在顺式作用元件分析中,光响应相关元件Box 4、G-box在ClassⅡ-b中显著富集,而GT1-motif在Class I中显著富集。与胁迫反应相关顺式元件ABRE在ClassⅡ中显著富集,Class I中则显著富集STRE元件。
系统发育和共线性分析是预测可能的遗传和进化关系以及基因家族潜在功能的基础。胡萝卜和香菜与芹菜共线的基因占据多数,且分别检测到多对同源基因对,这强烈暗示了一定程度的功能相似性。探究芹菜TCP基因的功能,对伞形科其他物种的TCP基因研究具有较好的参考性。对芹菜TCP家族成员在不同的组织、不同品种及高温胁迫中的表达模式进行分析,发现在3个基因亚族中,ClassⅠ(PCF)基因数目最多、表达范围广泛。ClassⅠ在根、叶柄和叶片3个组织中表达水平均较高,尤其是AgTCP23表达丰度最高,表明ClassⅠ亚族在芹菜不同组织形态形成有重要作用。芥菜中ClassⅠ成员在茎发育过程中显示出较高的表达量[28],葡萄中ClassⅠ成员参与了植物生长中的多个器官如花芽、叶片、茎的发育[37]。还有研究表明,拟南芥中ClassⅠ类的成员AtTCP14和AtTCP15基因能够有效延长下胚轴对生长素的反应,在植物发育中发挥重要作用[38]。对ClassⅠ亚组成员的启动子分析也发现该亚组成员含有多种参与植物发育和激素调节的顺式元件,尤其是GT1-motif、ABRE等,暗示芹菜该亚组成员在功能上与其他物种的ClassⅠ类的成员具有相似性。此外,不同颜色的芹菜品种中,ClassⅠ亚族成员(AgTCP21~29)在白色、绿色和红色芹菜中的表达丰度都很高。也有研究报道,山茶中TCP20和TCP23转录因子参与了花青素合成调控[19]。但有关TCP成员参与花青素合成调控的具体机制还需进一步探究。在高温胁迫下,相对于CK,大部分ClassⅠ成员的表达量被诱导并维持在较高的水平,这些基因可能参与了高温胁迫下的应答,而ClassⅡ-a和ClassⅡ-b在高温处理后表达量差异变化并不显著。采用qRT-PCR对该ClassⅠ成员表达量进行验证,荧光定量结果与转录组数据具有较好的一致性,进一步说明了ClassⅠ亚族成员参与了高温胁迫应答。但在拟南芥的研究中,发现的能够参与高温应答的两个基因TCP5和TCP17均属于ClassⅡ-a的成员[22]。也有其他研究发现ClassⅠ亚族成员参与非生物的逆境应答,如过表达豇豆Class I亚族成员TCP9能够显著增强转基因植株的抗旱性和耐盐性[39]。芹菜TCP基因如何参与高温调控的应答网络,还有待于进一步的研究,将对解析芹菜响应高温胁迫后进行适应性生长的机制具有重要意义。

