猕猴桃褪黑素合成相关基因AcTDC、AcT5H和AcSNAT的克隆与表达分析
吕晓雨,刘芯伶,张雪峰,梁 东,夏 惠
(四川农业大学园艺学院,成都 611130)
褪黑素(melatonin,MT),化学名称为N-乙酰-5-甲氧基色胺,是色氨酸的吲哚衍生物。褪黑素最早从奶牛的松果体中被分离,并长期被认为只存在于动物体内,直到1995年在高等植物中被发现[1]。此后褪黑素在植物中的研究热度持续升高。褪黑素作为一种生长激素,能够促进种子萌发[2]、侧根生长[3]以及提高光合作用效率[4]等。在抗逆性方面,外源褪黑素处理在高温[5]、干旱[6]、重金属[7]以及盐害[8]等非生物胁迫下对植物有积极作用,还可以调控花的开放[9]、提高果实品质[10]。随着对褪黑素的研究不断深入,其合成被发现存在着多条途径。当起始产物为色氨酸时,色氨酸通过色氨酸脱羧酶(Tryptophan decarboxylase,TDC)生成色胺,接着在色胺-5-羟化酶(Tryptophan-5-hydroxylase,T5H)的作用下羟基化生成5-羟色胺,5-羟色胺-N-乙酰转移酶(Serotonin N-acetyltransferase,SNAT)将其乙酰化生成N-乙酰-5-羟色胺,最后通过N-乙酰-5-羟色胺甲基转移酶(N-acetyl-serotonin methyltransferase,ASMT)或咖啡酸-O-甲基转移酶(Caffeic acid O-methyltransferase,COMT)甲基化生成褪黑素,而后两步顺序是可变的[11]。目前,褪黑素合成途径中的相关基因多在模式植物中被克隆,如在水稻中,抑制T5H的表达会增加褪黑素水平[12];但在番茄中,SNAT的表达下调后,褪黑素水平相应减少[13]。
猕猴桃为猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia Lindl.)多年生藤本落叶果树。我国是猕猴桃的原产地,猕猴桃种质资源极为丰富,经济栽培价值较高。《中国猕猴桃产业发展报告》数据显示,截至2019年底,我国的猕猴桃栽培面积达29万hm2,总产量达300万t,均位居世界第一。被誉为“水果之王”的猕猴桃,有丰富的糖、蛋白质、矿物质及有机物,其抗氧化性能在水果中位居前列,在抗癌、治疗心血管疾病方面也有一定疗效[14]。猕猴桃为肉质根,叶片被毛大而稠密,茎部髓质较大,对水分要求高且蒸腾作用强,不宜强光直射,目前主要用于商业种植的中华猕猴桃、美味猕猴桃和软枣猕猴桃有着较弱的耐旱性、耐涝性和抗风能力,此外在对耐盐害能力的研究中猕猴桃也表现出明显的盐害症状[15]。
此前已有研究报道,施加外源褪黑素可以提高猕猴桃在干旱[16]、高温[17]和盐胁迫[18]下的抗逆性,但具体机制尚不明晰,且猕猴桃中褪黑素合成的相关基因也未见报道。本试验克隆了猕猴桃中褪黑素合成途径的AcTDC、AcT5H和AcSNAT基因并对其进行表达分析,为深入研究褪黑素在猕猴桃抗逆性中的作用机理奠定基础。
1 材料和方法
1.1 试验材料与处理
试验材料取于‘金实1号’猕猴桃盆栽实生苗,种植于四川农业大学大棚内。‘金实1号’是四川省自然资源与科学研究院从野生猕猴桃实生后代中选育出的四倍体中华黄肉猕猴桃品种,对溃疡病有较强的抗性。于2019年1月选取‘金实1号’的饱满种子4℃层积2个月后进行4℃、12 h与25℃、12 h交替的变温催芽处理。待种子露白后播入穴盘(基质为草炭土∶椰壳∶珍珠岩=2∶2∶1),放于温度为(25±2)℃、光强为4 860 μmol/(m2/s)(12 h/12 h)的培养室中生长。待第1片真叶展开后,开始浇1/2Hoagland营养液,每周浇一次,其间补充清水。待幼苗长至6片真叶后,将其移至营养钵(20 cm×20 cm)中(基质为草炭土∶椰壳∶珍珠岩=2∶2∶1),每个营养钵植入3株幼苗,转移到室外避雨棚内常规管理。2周后待幼苗适应遮雨棚环境,选取长势一致的实生苗90盆,平均分为5组:①正常生长组(CK)、②干旱胁迫组(DCK)、③褪黑素处理组(MT+D)、④脱落酸处理组(ABA+D)、⑤褪黑素和脱落酸处理组(MT+ABA+D)进行处理,每组重复6盆,重复3次。干旱处理前,对MT+D处理、MT+ABA+D处理用100 μmol/L褪黑素溶液进行根灌,每2 d一次,共4次,每次200 mL;其他处理组根灌等量清水。第4次根灌褪黑素的次日(设为干旱处理0 d),除CK组则正常浇水外,其余组均进行干旱处理,控制浇水,保持土壤水势为-1.5 MPa左右。于干旱的第0、2、4、6、8和10天对ABA+D和MT+ABA+D处理组叶面喷施10 mL ABA溶液,浓度为25 μmol/L,其余处理组则叶面喷施等量清水。在干旱处理的第20天对各处理的猕猴桃从下往上数第4~8节位的叶片进行取样。采样后现场将样品放入液氮进行速冻,在-80℃冰箱保存。
1.2 RNA提取与cDNA第一链合成
将-80℃保存的材料剪碎到研钵中,加入液氮研磨至粉末,利用改良的CTAB法[19]进行总RNA的提取。1%琼脂糖凝胶电泳检测总RNA的完整性。核酸蛋白测定仪测定其浓度,反转录获得cDNA。
1.3 基因克隆
在猕猴桃基因组数据库(http://kiwifruitgenome.org/)检索TDC、T5H和SNAT的序列信息,使用软件Primer Premier 5.0设计基因引物(表1)。以反转录的cDNA为模板,PCR反应体系如下:1 μL cDNA、2.5 μL Buffer、2.5 μL MgCl2、0.5 μL dNTPs(10 mmol/L)、0.5 μL Taq酶、1 μL引物(10 mmol/L)和16 μL ddH2O。PCR反应条件:94℃预变性5 min;94 ℃变性45 s;退火,45 s;72 ℃延伸1 min,循环34次;72℃修复延伸10 min。PCR产物进行1%琼脂糖凝胶电泳检测,目的条带切胶回收。回收产物与克隆载体pMD19-T连接,转化到大肠杆菌感受态细胞中;挑取阳性菌落进行菌液PCR鉴定,凝胶电泳检测后选取有目标条带的菌液送成都擎科生物有限公司测序。

表1 引物序列及用途Table 1 Primer sequences and usage
1.4 克隆基因的生物信息学分析
利用Lasergene 7.1中的Editseq预测基因的开放阅读框并将其翻译为氨基酸序列;通过ProtParam对蛋白理化性质进行分析;利用Prot Scale分析蛋白亲疏水性;TMHMM Server v.2.0分析氨基酸的跨膜域结构,SignalP-4.0 Server进行信号肽预测;SOPMA和SWISS-MODEL分别预测蛋白的二级、三级结构;Cell-PLoc 2.0进行亚细胞定位预测;NCBI推测其保守结构域;用Jalview进行多重序列比对,MEGA 7.0构建进化树。
1.5 实时荧光定量PCR(qRT-PCR)分析
CTAB法分别提取‘金实1号’根、茎、叶和幼果4个组织的RNA以及不同处理后叶片的RNA,参照宝生物工程(大连)有限公司的PrimeScript™RT reagent kit with gDNA eraser反转录试剂盒获得cDNA,使用CFX96实时系统C1000热循环仪(Bio-RAD,Hercules,CA,美国)进行qRT-PCR,每个样品设3次技术重复。荧光定量PCR反应体系:TB Green 10 μL,上下游引物各0.8 μL,cDNA 1.5 μL,ddH2O 6.9 μL。扩增条件如下:95 ℃ 30 s;95 ℃ 5 s;退火30 s,循环40次;95℃ 10 s;65℃ 5 s;95℃ 0.5℃。相对表达水平使用2-ΔΔCT方法计算。反应所用引物见表1。
2 结果与分析
2.1 AcTDC、AcT5H和AcSNAT基因克隆及ORF序列分析
根据猕猴桃基因组数据库获取TDC、T5H和SNAT序列,分别命名为AcTDC(Gene ID:Acc19037),AcT5H(Gene ID:Acc32774),AcSNAT(Gene ID:Acc31246)。以叶片cDNA为模板进行RT-PCR扩增,产物在1%琼脂糖凝胶电泳分析后(图1),进行载体连接、转化和测序,AcTDC的ORF区长度为1 506 bp,编码501个氨基酸;AcT5H的ORF区长度为618 bp,编码205个氨基酸;AcSNAT的ORF区长度为579 bp,编码192个氨基酸。
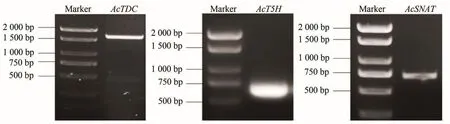
图1 AcTDC、AcT5H和AcSNAT的PCR扩增产物Figure 1 PCR products of AcTDC、AcT5H and AcSNAT
2.2 AcTDC、AcT5H和AcSNAT的蛋白生物信息学分析
ProtParamd的蛋白理化性质分析结果见表2。NCBI工具Conserved domains结果显示AcTDC可能属于AAT蛋白超级家族,AcT5H可能属于P450超级家族,AcSNAT属于GNAT超级家族。TMHMM Server v.2.0和SignalP-4.0 Server分别进行跨膜域结构分析与信号肽预测,显示3个蛋白均没有跨膜结构和信号肽,为非分泌性蛋白。利用在线网站Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行亚细胞定位预测,结果显示AcTDC、AcT5H、AcSNAT分别位于线粒体、内质网、叶绿体中。SOPMA对二级结构的预测显示,AcTDC蛋白中α螺旋(45.11%)和无规则卷曲(34.93%)为主,延伸链(14.17%)和β转角(5.79%)占比较少;AcT5H蛋白中α螺旋(38.54%)和无规则卷曲(38.05%)为主,其次为延伸链(15.61%)和β转角(7.8%);AcSNAT蛋白以无规则卷曲(36.46%)、α螺旋(33.33%)和延伸链(20.83%)为主,β转角占9.38%。

表2 AcTDC、AcT5H、AcSNAT的蛋白理化性质分析Table 2 Physical and chemical properties of AcTDC,AcT5H and AcSNAT proteins
2.3 氨基酸结构分析及系统进化树构建
将AcTDC、AcT5H和AcSNAT氨基酸序列分别通过NCBI上的Blastp进行比对后发现,AcTDC与大部分比对序列相似性在73%~80%之间,AcT5H与大多数序列相似性在65%~75%之间,AcSNAT在65%~78%之间,说明3个基因所编码的蛋白都有较高的保守性。筛选相似性较高的氨基酸序列,运用MEGA7.0构建系统进化树,其中AcTDC与桃的亲缘关系较近(图2);AcT5H与咖啡、辣椒亲缘关系较近(图3);AcSNAT与茶的亲缘关系较近(图4)。
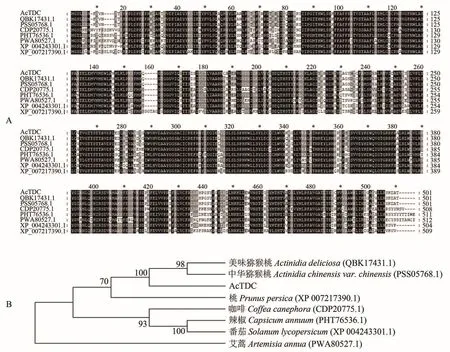
图2 AcTDC蛋白与其它植物TDC蛋白的多序列比对(A)和系统进化分析(B)Figure 2 Multiple sequence alignment(A)and phylogenetic analysis(B)of AcTDC with those other plant TDC proteins

图3 AcT5H蛋白与其它植物T5H蛋白的多序列比对(A)和系统进化分析(B)Figure 3 Multiple sequence alignment(A)and phylogenetic analysis(B)of AcT5H with those other plant T5H proteins
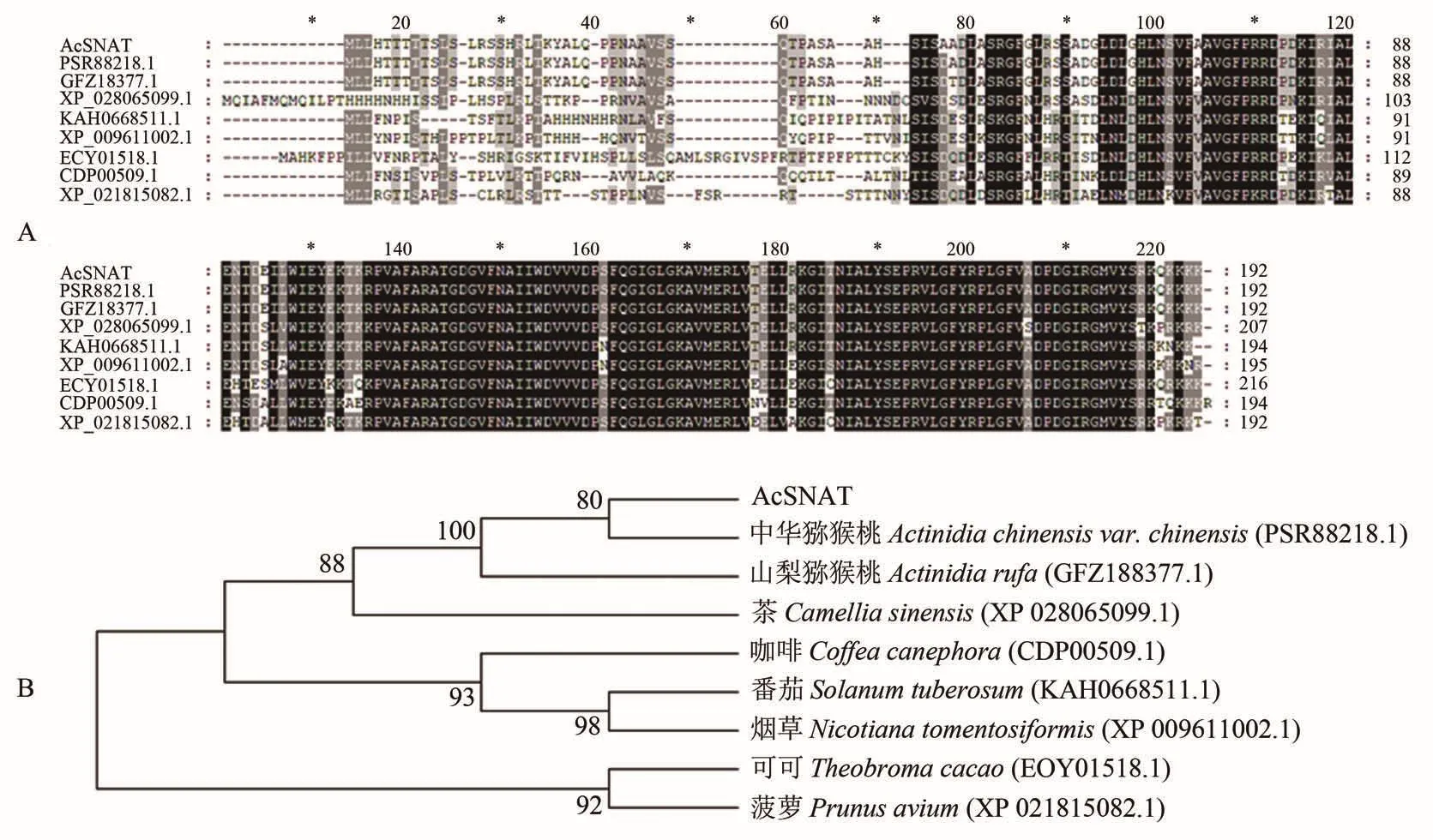
图4 AcSNAT蛋白与其它植物T5H蛋白的多序列比对(A)和系统进化分析(B)Figure 4 Multiple sequence alignment(A)and phylogenetic analysis(B)of AcSNAT with those other plant SNAT proteins
2.4 AcTDC、AcT5H和AcSNAT基因在不同部位中的表达分析
使用qRT-PCR技术检测AcTDC、AcT5H和AcS⁃NAT基因在不同部位中的表达情况,由图5可以看出AcTDC仅在果实中表达,在根、茎和叶中没有表达;AcT5H在茎、幼果中表达量相对较高,根中极少;AcSNAT在叶片中表达量极高,茎、幼果次之,根中较低。
2.5 AcTDC、AcT5H和AcSNAT在逆境胁迫下的表达分析
测定不同处理后叶片中基因的表达情况,结果显示逆境胁迫对基因表达量的影响较大。正常情况下未能检测到叶片中AcTDC的表达,处理后AcTDC在叶片中仍不表达;AcT5H在ABA+D和MT+ABA+D处理后下调显著大于MT+D处理,表明ABA对AcT5H表达的抑制作用更明显;由图6可知,AcS⁃NAT在处理后表达量相对正常叶片下调都较为显著,但各处理之间差异不显著。

图5 AcTDC(A)、AcT5H(B)和AcSNAT(C)基因在不同部位中的表达Figure 5 The expression of AcTDC(A)、AcT5H(B)and AcSNAT(C)in different parts
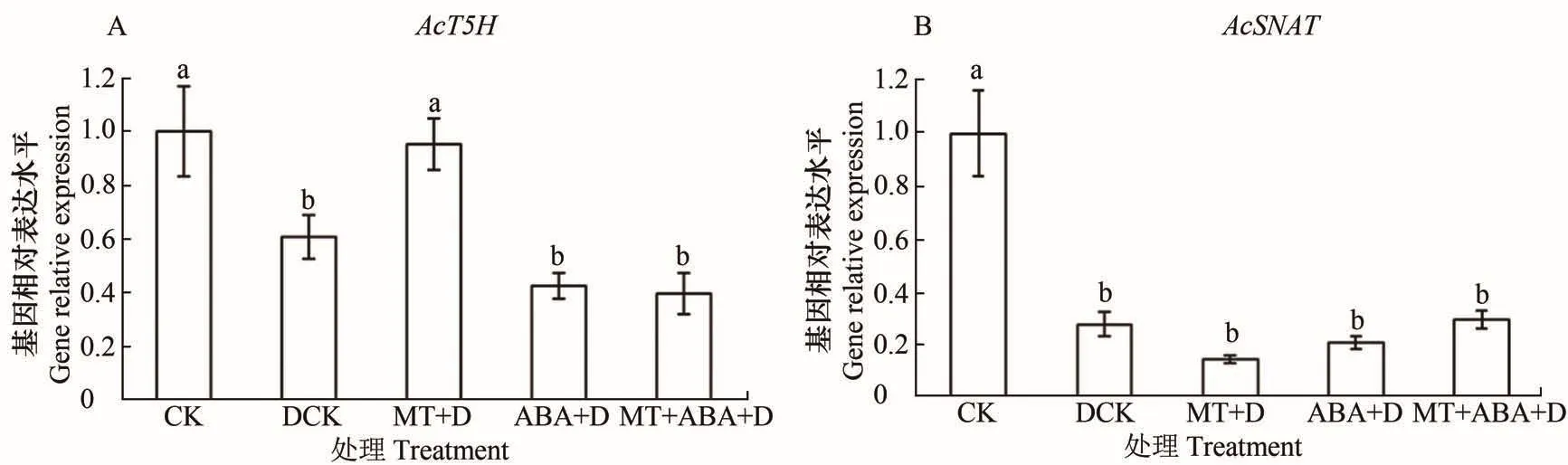
图6 AcT5H(A)和AcSNAT(B)基因在逆境胁迫下的表达Figure 6 The expression of AcT5H(A)and AcSNAT(B)in abiotic stress
3 讨论
此前研究证明,外源褪黑素预处理在高温胁迫下可提高猕猴桃抗氧化能力[17],在盐胁迫下能够缓解过氧化氢的积累,提高清除活性氧的能力[20],在干旱环境中可提高保水能力[16]。综合来看,褪黑素对提高猕猴桃抗逆性有重要作用,因此本研究克隆了参与猕猴桃中褪黑素合成的AcTDC、AcT5H以及Ac⁃SNAT基因,为后续基因功能鉴定及其转录调控奠定基础。
长春花属植物中TDC的分子量在54 000左右[21],与本试验较为一致,ORF区编码500个氨基酸[22]。在探究长春花吲哚生物碱的合成时,TDC位于细胞质[23],而AcTDC蛋白定位预测显示在线粒体中,其准确定位还有待进一步验证。qRT-PCR结果显示,AcTDC在猕猴桃根、茎和叶中不表达,但在幼果中有一定表达。研究表明,即使在诱导之后,TDC在总蛋白中仅有0.03%[21]。猕猴桃基因组数据库(http://kiwifruitgenome.org/)显示,幼果中TDC有相对高的表达量。在褪黑素合成途径中,TDC将色氨酸转化为色胺,色胺在猕猴桃鲜果重中有较高的比例,同时发现,在开花后24 d的幼果中TDC的表达量高于其他时期果实中的表达量[24]。
通过生物信息学分析,发现AcT5H蛋白有P450结构域,并在亚细胞定位预测中显示有可能在内质网中。研究表明水稻SL蛋白是一种细胞色素P450酶,有T5H活性,从而推测就是催化色胺转化为5-羟色胺的T5H,其亚细胞定位也位于内质网[25]。猕猴桃基因组数据库显示,T5H在果实中的表达量高于叶片,与试验结果相符。目前关于植物中褪黑素合成过程中T5H的相关研究较少,但已有试验证明抑制T5H表达可以增加褪黑素含量[12]。水稻中T5H在根中的活性最强,这与根中的血清素含量高有关[26],而血清素在猕猴桃幼果中含量也较为丰富[24],推测与本试验中T5H在幼果中的表达量相对较高相关联。
AcSNAT蛋白显示属于GNAT超家族,该家族可以催化乙酰基的转移,从乙酰辅酶A到一系列分子,如氨基糖苷和芳基烷基胺[27]。AcSNAT蛋白的亚细胞定位预测显示有可能在叶绿体中,Y.Byeon等[28]发现水稻SNAT在烟草叶片中表达时定位于叶绿体,而水稻SNAT2不止定位于叶绿体,在细胞质中也有表达[29],同时,番茄[13]和烟草[30]中SNAT也定位于叶绿体,并且Byeon的数据表明有多种SNAT基因参与了褪黑素的合成[29],因此猕猴桃中SNAT的定位还有待进一步探究。水稻中,嫩枝的SNAT表达量高于根系[31],拟南芥中茎、叶中SNAT表达量高于根[32],而试验结果也显示SNAT在叶中有很高的表达,这可能与其定位和功能有关。
本研究对猕猴桃褪黑素合成相关基因AcTDC、AcT5H和AcSNAT的克隆与表达初步进行了分析,但其完整途经中尚有基因未进行克隆,有关基因的功能机制及转录调控还有待进一步探究。

