广西猫杯状病毒全基因组序列测定及其遗传进化分析
丁仰保,何剑桥,刘林林,余良政,崔柏杨,周华波,韦祖樟,欧阳康,黄伟坚,陈 樱
(1.家畜传染病与分子免疫学实验室,广西大学动物科学技术学院,南宁 530004;2. 南宁市华波宠物医院,南宁 530004)
猫杯状病毒(Feline calicivirus, FCV)属于疱疹病毒属,单股正链RNA病毒,主要引起猫科动物上呼吸道疾病及口腔溃疡等主要临床症状[1-2]。FCV具有高度流行趋势,自1957年Fastier分离得到首株FCV以来,研究人员陆续从家猫[3]、老虎以及猎豹等猫科动物中成功分离得到多株FCV[4],并且还从患有腹泻症状的狗中检测到FCV[5]。由于FCV毒株的不断变异,1998年美国的Pedersen等[6]首次报道了FCV相关的致死性全身系统性疾病(Virulent systemic disease FCV, VS-FCV),除表现为上呼吸道疾病等常规临床症状外,感染猫还出现不同程度的皮肤水肿、发热、溃疡性皮炎、厌食和黄疸,死亡率高达50%;2013年,意大利的Battilani等[7]在一例免疫过FCV的死亡宠物猫中也分离得到一株VS-FCV毒株;2015年,刘永相等[8]首次发现虎VS-FCV。可见,VSFCV毒株已经在世界上许多国家和地区出现,并且早期疫苗株已经不能够提供足够的保护,这严重危害到了宠物猫等猫科动物的生命安全[9-10]。
FCV全基因组由3个开放性阅读框(open reading frame, ORF)组成,ORF1基因主要编码非结构蛋白前体,ORF2和ORF3基因分别编码结构蛋白VP1和次要结构蛋白VP2[11]。其中,ORF2基因编码的结构蛋白(VP1),按功能域划分为A、B、C、D、E和F 6个区。A区域利用蛋白酶切割功能形成成熟的结构蛋白;B、D、F区相对比较保守;C和E区变异性较大,特别是E区包含大部分的抗原线性表位和鉴别VS-FCV的特征性氨基酸突变位点,变异最为明显,也是早期疫苗免疫失败的重要原因[12]。因此,了解FCV流行病学特征及其遗传进化规律,将为今后防控FCV和筛选候选疫苗株提供一定的参考依据。
1 材料与方法
1.1 样品来源及处理 2018年3月至2019年9月,从广西地区采集疑似FCV临床症状的猫鼻拭子59份。患病猫主要为呼吸道感染,伴有发热(体温为38.5℃~40.1℃),并出现口腔溃疡、流涎和口眼鼻分泌物增多等主要临床症状。将RT-PCR鉴定为阳性的样品,在旋涡振荡1 min后,10 000×g、4℃离心4 min,弃棉签,保存在-80℃已备接毒用。
1.2 细胞和主要试剂 猫肾细胞(crandell feline kidney cells, CRFK)由中国军事科学院惠赠,本实验室保存。Primestar Mix购自TaKaRa公司;Nucleic Acid Purification Kit购自康宁公司;dNTP、RNasin酶抑制剂、M-MuLV Reverse Transcriptase(200U/L)购自宝生物(大连)有限公司采购;DNA胶回试剂盒购自天根生化科技(有限)公司;DMEM培养基以及胎牛血清购自Gibco公司。
1.3 病毒分离和透射电镜分析 将鉴定为阳性的样品进行过滤除菌,接种在长至90%左右的单层CRFK细胞,37℃培养48 h,每12 h观察是否有细胞病变(cytopathic effect, CPE),当有明显CPE时,取细胞上清液进行3轮空斑纯化,将纯化的病毒送塞维尔公司进行透射电镜分析,其余冻存在-80℃备用。
1.4 病毒RT-PCR鉴定 按照Nucleic Acid Purification Kit试剂盒说明书提取病毒总RNA。以P6引物(5'-CCCTGGGGTTAGGCGCWG-3')作为反向引物[13],并按照AMV反转录酶使用说明书进行反转录。具体体系如下:5×Buffer 2.5 μL,2.5 mmol/L dNTP mix 1 μL,P6(25 pmol/L)0.5 μL,M-MLV反转录酶0.25 μL,RNasin抑制剂0.25 μL,RNA 8 μL。42℃反转录1 h。根据Abd-Eldaim[14]设计的引物和程序,对纯化的病毒细胞上清液进行鉴定。
1.5 病毒全基因组扩增和序列拼接 根据何平等[10]先前设计的引物稍作修改,对获得的FCV毒株进行全基因组扩增,运用Lasergene DNAStar 7.1中的SeqMan软件对获得的分段基因进行序列拼接,并通过NCBI(BLAST,megablast;http://www.ncbi.nlm.nih.gov/)进行检索。扩增程序为:98℃预变性2 min;98℃变性15 s,57℃退火15 s,72℃延伸1 min 30 s~3 min不等,共30个循环;72℃延伸10 min。胶回收产物送广州华大生物技术公司进行测序。
1.6 构建遗传进化树 从GenBank上下载其他50株FCV的ORF2基因序列,运用MEGA6.0 beta软件,通过邻接法(1000个重复)构建遗传进化分析树,并分析其序列特征。
2 结果
2.1 病毒分离情况 将鉴定为阳性的29份鼻拭子样品接种单层CRFK细胞后,24 h内细胞出现皱缩、变圆,呈串珠状的典型细胞病变效应(图1A)。通过RT-PCR鉴定,结果表明,细胞上清液能成功扩增获得550 bp左右的目的片段,与预期结果相符合(图1B)。通过三轮空斑纯化,将细胞上清液浓缩进行电镜鉴定,结果显示该病毒粒子的衣壳由呈中央凹陷的杯状壳粒构成,衣壳呈正二十面体,直径为30~40 nm,符合FCV病毒粒子的特征(图1C),因此将该分离株命名为NN01-19。
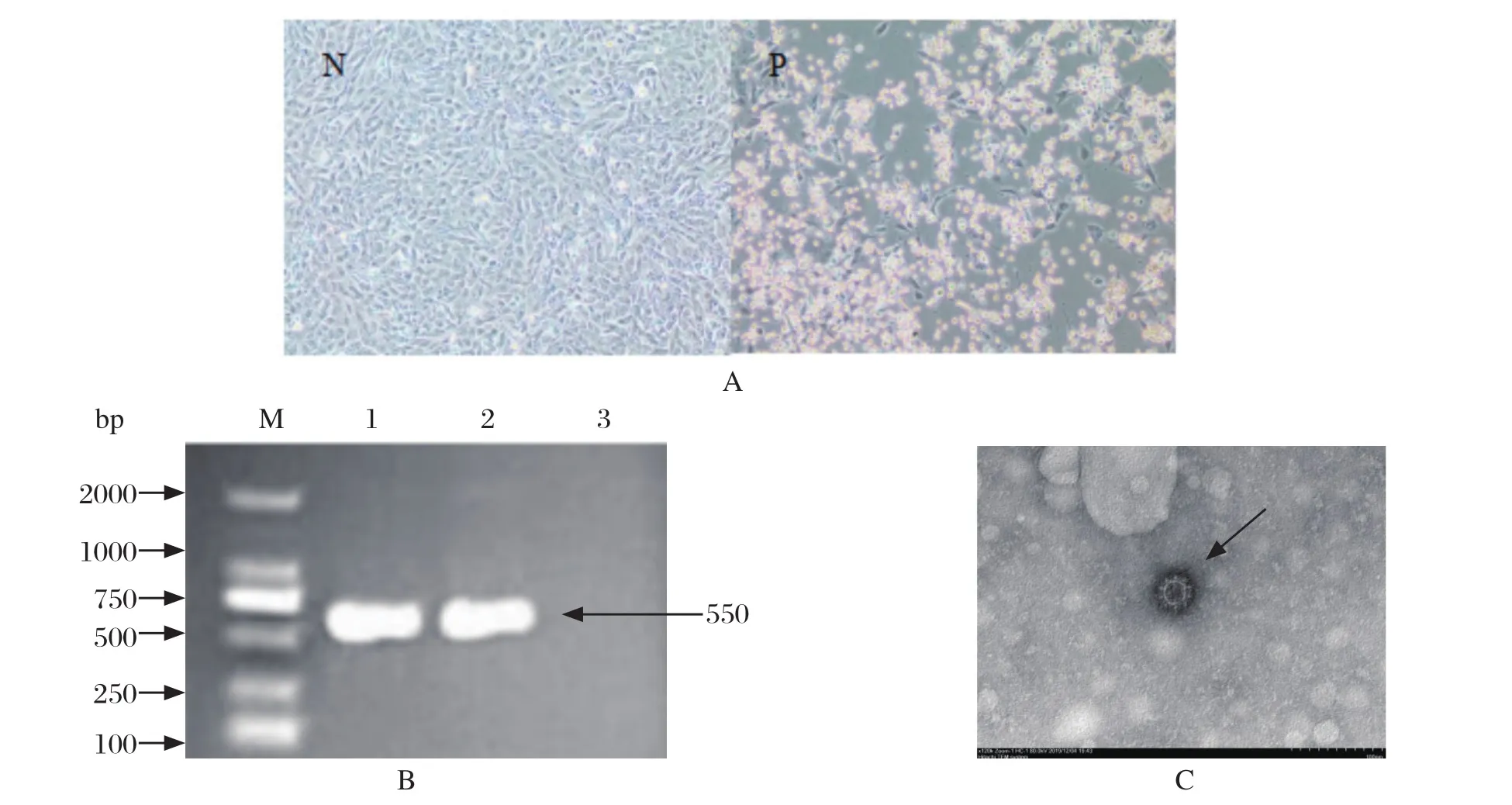
图1 NN01-19株的分离鉴定Fig.1 Isolation and identification of NN01-19 strain
2.2 病毒全基因组扩增和序列拼接 经琼脂糖凝胶电泳鉴定,结果发现扩增获得基因片段(G1片段为1332 bp,G2片段为1947 bp,G3片段为2765 bp,G4片段为2288 bp)与预期大小相符(图3)。将四个片段进行序列拼接,发现本研究获得的NN01-19分离株基因组全长7709 bp,其中,5'UTR依旧高度保守,ORF1的长度为5292 bp(20-5311 bp),ORF2为2010 bp(5314-7323 bp),ORF3为321 bp(7319-7640 bp)。ORF3起始密码子与ORF2的终止密码子有4个核苷酸重叠,与以前的研究结果一致,而且3'UTR延伸到7709个碱基。

图2 NN01-19毒株全基因组扩增图Fig.2 Amplification of complete genome of NN01-19 stain by RT-PCR
2.3 ORF2基因的遗传进化分析 将ORF2基因与国内外代表毒株进行比较分析并构建遗传进化树,结果发现NN01-19分离株与东北地区分离株FCV-JL4的核苷酸和氨基酸同源性分别高达86.8%和93.1%,与2013年分离的广西早期毒株GX01-13的同源性仅为77.9%和86.5%,并且与疫苗株的同源性也仅为76.3%~77.2%和87.0%~87.4%(表1)。遗传进化树分析可知,NN01-19与FCV-JL4以及GX01-13均属于GI株群,与FCV-JL4处于同一分支,但是与GX01-13和疫苗株遗传距离却相对较远,均不在同一个遗传进化分支上(图3A和3B)。结果表明,FCV变异程度较大,并且分布也不具有明显的地域特征。

表1 NN01-19分离株与代表株之间的同源性分析Table 1 Homology of ORF2 gene between NN01-19 and representative strains

图3 ORF2基因的核苷酸和氨基酸遗传进化树(A为核苷酸遗传进化树, B为氨基酸遗传进化树)Fig.3 Phylogenetic trees based on nucleotides and amino acids of ORF2 gene(A and B means phylogenetic tree based on nucleotides and amino acids, respectively)
2.4ORF2D和E区抗原线性表位分析 本研究以F9疫苗株为参照株,其抗原线性表位为标准,通过与广西早期分离株GX01-13的ORF2D和E区进行比较分析发现(图4),D区抗原线性表位依旧高度保守;E区的抗原线性表位则发生高度变异,与GX01-13相比,NN01-19新增了T448A、T450G、G451Q和T454S 4个抗原突变位点。

图4 ORF2 D和E区抗原线性表位分析图谱Fig.4 Linear epitope analysis of antigen in D and E regions of ORF2
2.5 VS-FCV特征性氨基酸分析 本研究以Foley J等[15]对E区分析的具有VS-FCV突变特征的氨基酸位点为依据,将分离毒株与早期分离株GX01-13和16株VS-FCV毒株VP1蛋白的部分超变区序列(426-461 aa)进行比较。结果发现,NN01-19在430、448和452位点发生突变,其中只有V430T符合VS-FCV氨基酸位点特征(图5)。

图5 VP1蛋白 部分E区的氨基酸比较图Fig.5 Comparison of amino acid sequences of partical E region in VP1 protein
3 讨论
在过去40年的时间里,FCV被看做猫的重要病原之一。由于该病毒RNA聚合酶的校正功能的缺乏,导致其基因组频繁变异,甚至在出现VSD毒株感染时,疫苗失去保护力。随着近年来对FCV的不断监测,我们发现广西地区FCV流行呈上升趋势。在对感染FCV猫进行统计分析,我们发现所有年龄阶段的猫都能感染,1-3月龄的幼猫相对较易感,感染率高达41.4%(12/29)(数据未出示)。有报道称,成年猫感染后表现更为严重,甚至致死,特别是VS毒株的出现可能改变了主要保护抗原的蛋白结构而导致免疫逃逸[16]。为深入了解FCV流行规律及其变异情况,本研究对新分离的FCV NN01-19毒株进行了遗传进化和致病性氨基酸位点的分析。
FCV毒株分为GI和GII两个株群,其中GI群以高致病性的Kaos、Air和UTCVM-NH2等国外的VSFCV毒株为主,GII株群则为经典株群,其中,大部分中国的FCV毒株均属于GII株群[17]。有趣的是,通过ORF2核苷酸和氨基酸的遗传进化分析发现,本研究分离的广西毒株NN01-19并非属于GII经典株群,而是与广西早期毒株GX01-13同属GI高致病性群体。同时,NN01-19和GX01-13虽同属一个株群,但核苷酸和氨基酸同源性却相对较低,分别仅为77.9%和86.5%,这也再一次证实了FCV随着时间推移,其基因组的变异程度较大。此外,与疫苗株相比,本研究分离的毒株仍旧与其不在同一分支,而且同源性也较低,这意味着当前疫苗的使用可能会造成猫群的免疫失败。另外,通过分析NN01-19全基因组特征,我们发现该毒株的确发生了较大变异,与早期分离株GX01-13相比,NN01-19 ORF3基因3'端的非编码区延伸到7709个碱基,这也与大多数报道的毒株均不相同(数据未显示)。2011年,Clotilde等[18]证明3'端非编码区可以与核仁素(一种普遍存在的多功能核仁穿梭磷蛋白)相互作用,广泛参与病毒的翻译和复制,这些相互作用通常有利于提高其宿主特异性和组织嗜性,该毒株3'端的变异是否具有相同的有利影响有待进一步研究。除此之外,FCV VP1蛋白变异最大的E区部分,含有病毒大多数的抗原线性表位,它可作为流行病学调查最有力的工具[19]。本研究将3轮空斑纯化的病毒分别进行E区的基因扩增,在3次扩增结果一致的情况下,对其E区进行序列分析,结果表明,与早期分离株GX01-13相比,NN01-19新增了T448A、T450G、G451Q和T454S四个抗原突变位点,同一地区不同时期的毒株在短短几年内,其抗原位点便发生了诸多变异。早期疫苗为何不能再提供足够的防护,其毒株抗原的不断变异可能在其中占据重要原因。与此同时,更严重的可导致恶性全身系统性疾病的VSFCV毒株也在免疫选择压力下开始出现和流行,全身多器官病变和高死亡率为其主要特征[20-21]。有研究发现,VS-FCV具有特征性氨基酸位点,Foley等[15]对E区具有VS-FCV突变特征的氨基酸位点进行比较分析,发现V430T、T438V、N443S、A448K、A452E、D455M 和 K458S与其致病性相关。本研究发现,相比早期分离株GX01-13毒株,NN01-19毒株发生了3个位点的突变,其中就包含致病性突变位点(V430T),该位点的改变是否会增强该毒株的致病性,仍需要进一步验证。
本研究将近期分离的毒株与早期毒株进行了对比分析,结果发现经历几年的遗传进化,FCV基因组发生了较大变异,虽然在同一个基因群,但是核苷酸同源性仅为77.9%。有趣的是,该毒株的超变区(E区)出现了3个特征性氨基酸位点的改变,其中430位点氨基酸(V430T)的突变,符合致病性氨基酸突变特点,为后期验证其致病性提供了科学依据。总之,不断加强对FCV的监测,并掌握其流行病学规律和分子特征,将为今后筛选疫苗候选毒株奠定坚实的基础。

