A型塞尼卡病毒与O型、A型、亚洲I型口蹄疫病毒多重TaqMan荧光定量RT-PCR检测方法的建立及应用
施开创,谢守玉,赵 晶,莫胜兰,刘惠心,尹彦文,司红彬,屈素洁,陆文俊,冯淑萍,粟艳琼
(1.广西动物疫病预防控制中心,南宁 530001;2.广西大学动物科学技术学院,南宁 530005)
A型塞尼卡病毒(Senecavirus A, SVA),曾用名塞尼卡谷病毒(Seneca vally virus, SVV),属于小RNA病毒科塞尼卡病毒属[1]。2007年,位于加拿大中南部的一家猪场发生原发性水疱病(porcine idiopathic vesicular disease, PIVD),病猪的鼻镜、蹄冠等部位出现水疱,并伴发高热等症状。针对口蹄疫病毒(Foot-and-mouth disease virus, FMDV)、猪水疱病病毒(Swine vesicular disease virus, SVDV)、水疱性口炎病毒(Vesicular stomatitis virus, VSV)及猪水疱疱疹病毒(Vesicular exanthema of swine virus, VESV)的病原筛查结果均为阴性,最终SVA被证实是该病的病原[2]。随后,美国、巴西、中国、哥伦比亚、泰国、越南等国家相继报道SVA感染猪群发病[3-8],在世界各国呈迅速蔓延之势。SVA的临床症状在成猪主要表现为厌食、发烧,口腔、鼻镜及蹄部出现水疱。产房仔猪,尤其是1日龄~4日龄的新生仔猪,感染后出现昏睡、皮肤充血、腹泻、神经症状及突然死亡[9-10]。SVA发病率因猪群不同生长阶段而异,断奶仔猪的发病率为0.5%~5%,育肥猪及后备猪的发病率为5%~30%,而新生仔猪的发病率可高达70%、死亡率可达15%~30%[11]。自2015年我国首次在广东省报道SVA感染猪群后,现已蔓延至湖北、黑龙江、福建及河南等多个省份[12-14],造成巨大的经济损失。由于SVA与FMDV感染猪群的临床症状、病理变化极为相似,因此临床上难以区分,需借助实验室检测才能鉴别诊断。当前,国内外已有学者建立了FMDV不同血清型以及SVA、FMDV鉴别检测的多重荧光定量RT-PCR方法。谢彩华等[15]建立了FMDV通用型和A型二重实时荧光RT-PCR检测方法,Jamal等[16]建立了O型、A型及亚洲I型FMDV多重荧光定量RT-PCR检测方法,Tam等[17]建立了O型、A型、亚洲I型、C型、SAT1型、SAT2型、SAT3型FMDV多重荧光定量RT-PCR检测方法,Wang等[18-19]建立了SVA和FMDV双重荧光RT-PCR检测方法。但是,迄今尚未见区分检测SVA与O型、A型、亚洲I型FMDV多重TaqMan荧光定量RT-PCR方法的报道。本研究针对SVA 3D基因、O型、A型及亚洲I型FMDV VP1基因,设计特异性引物和TaqMan探针,经优化各种反应条件,成功建立了同时检测并区分SVA与O型、A型、亚洲I型FMDV的多重TaqMan荧光定量RT-PCR方法,为相应病原的鉴别检测提供了特异、敏感、高效的检测方法。
1 材料与方法
1.1 病毒株与临床病料样品 SVA分离株(GD株)由扬州大学惠赠;FMDV O型疫苗株(O/Mya98/XJ/2010)、亚洲I型疫苗株(JSL株)购自中牧实业股份有限公司兰州生物药厂;A型疫苗株(AF/72株)购自中农威特生物科技股份有限公司;猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome, PRRSV)疫苗株(TJM-F92株)、猪瘟病毒(Classical swine fever virus, CSFV)疫苗株(C株)、伪狂犬病病毒(Pseudorabies virus, PRV)疫苗株(Bartha-K61株)、猪细小病毒(Porcine parvovirus, PPV)疫苗株(N株)、猪圆环病毒2型(Porcine circovirus 2, PCV2)疫苗株(SX07株)、猪圆环病毒3型(Porcine circovirus 3, PCV3)分离株(GX02-2018株)均由本实验室保存。30份疑似样品(淋巴结、水疱液、痂皮等)于2019年采自广西各地猪场临床疑似病猪。
1.2 主要试剂 Mini Plasmid Kit质粒抽提试剂盒、通用型DNA纯化回收试剂盒、E. coli DH5α感受态细胞购自天根生化科技(北京)有限公司;MiniBEST Viral RNA/DNA Extraction Kit Ver. 5.0病毒核酸提取试剂盒、PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit cDNA合成试剂盒、pMD18-T载体、EcoRⅠ内切酶及Hind Ⅲ内切酶、Premix Ex TaqTM(Probe qPCR)购自宝生物工程(大连)有限公司。
1.3 引物及TaqMan探针 根据GenBank登录的SVA(NC_011349)、O型FMDV(KR401154)、A型FMDV(KT968663)及亚洲I型FMDV(KR073010)参考毒株基因序列,针对SVA3D基因以及O型、A型、亚洲I型FMDVVP1基因,分别设计特异性引物及TaqMan探针(见表1)。引物和探针由宝生物工程(大连)有限公司合成。

表1 本研究所用引物及探针Table 1 Primers and probes used in this study
1.4 重组质粒标准品的制备 取SVA GD株、FMDV O型O/Mya98/XJ/2010株、A型AF/72株、亚洲I型JSL株病毒液200 µL,采用试剂盒提取总RNA,反转录为cDNA,分别作为模板,应用设计的4对引物进行PCR扩增。回收、纯化PCR产物,连接pMD18-T载体,转化DH5α感受态细胞,筛选阳性菌落并扩大培养,抽提质粒,进行PCR、酶切及测序鉴定。鉴定正确的重组质粒分别命名为pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1,作为阳性标准品。用紫外分光光度仪测定4种重组质粒标准品的浓度后,按照计算公式:拷贝数(copies/mL)=6.02×1023拷贝数/摩尔×(浓度)/(MW g/moL),分别将4种质粒换算为拷贝数。
1.5 反应条件的优化及标准曲线的建立 将4种重组质粒标准品pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1作为模板,应用4对特异性引物和TaqMan探针,在同一体系中进行TaqMan荧光定量PCR扩增,采用矩阵法分别对退火温度(55℃、56℃、57℃、58℃、59℃、60℃)、引物浓度(终浓度分别为0.2、0.3、0.4、0.5 pmol/µL)及探针浓度(终浓度分别为0.1、0.2、0.3、0.4、0.5 pmol/µL)进行优化,获得TaqMan荧光定量PCR最佳反应条件。将4种重组质粒标准品混合后10倍系列稀释为2.50×108copies/µL~2.50×101copies/µL,作为模板,按照优化的TaqMan荧光定量PCR条件进行扩增,绘制扩增曲线和标准曲线。
1.6 特异性试验 取SVA GD株、FMDV O/Mya98/XJ/2010株、FMDV AF/72株、FMDV JSL株、PRRSV TJM-F92株及CSFV C株病毒液,按照试剂盒说明书提取总RNA,反转录成cDNA;取PRV Bartha-K61株、PPV N株、PCV2 SX07株及PCV3 GX02-2018株病毒液,提取总DNA。将上述cDNA和DNA作为模板,以4种重组质粒标准品混合物为阳性对照、灭菌ddH2O为阴性对照,应用所建立的多重TaqMan荧光定量RT-PCR进行扩增,验证该方法的特异性。
1.7 敏感性试验 将4种重组质粒标准品pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1混合后10倍系列稀释,取终浓度为2.50×108copies/µL~2.50×100copies/µL的质粒混合物作为模板,应用所建立的TaqMan荧光定量PCR进行扩增,验证该方法的敏感性。
1.8 重复性试验 将4种重组质粒标准品pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1混合后10倍系列稀释,取3个浓度梯度(终浓度分别为2.50×107copies/µL、2.50×105copies/µL、2.50×103copies/µL)混合物作为模板,应用所建立的TaqMan荧光定量PCR进行扩增,验证该方法的重复性。组内重复性试验时,重复5次反应;组间重复性试验时,重复5次反应,间隔1周进行。
1.9 多重TaqMan荧光定量RT-PCR方法的应用 取30份临床疑似样品,用灭菌剪刀将淋巴结、痂皮等组织样品剪成小块,放入灭菌离心管中,加入适量(W/V,1∶4)pH7.2 PBS溶液,反复冻融3次。放置病料磨碎仪中研磨至糜状,12 000×g离心3 min,取200 µL上清液用于提取总RNA,反转录成cDNA,应用本研究建立的多重TaqMan荧光定量RT-PCR方法进行检测。同时,参考李秀博等[20]建立的SVA TaqMan荧光定量RT-PCR方法对SVA进行检测,按照国家标准《口蹄疫诊断技术》(GB/T 18935-2018)对O型、A型、亚洲I型FMDV进行检测,计算上述方法和标准与本研究所建立方法对SVA与O型、A型、亚洲I型FMDV检测结果的符合率。
2 结果
2.1 重组质粒标准品的制备 提取SVA以及O型、A型、亚洲I型FMDV病毒液的总RNA,反转录成cDNA后作为模板,应用特异性引物进行PCR扩增,获得SVA 3D基因(70 bp)以及O型(111 bp)、A型(64 bp)、亚洲I型(71 bp)FMDV VP1基因的目的片段,与预期结果一致。回收PCR产物、连接、转化,阳性菌落扩大培养后抽提质粒,经PCR、酶切及测序鉴定正确后,获得的重组质粒分别命名为pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1。测定其浓度并换算成拷贝数,分别为3.72×1010、2.44×1010、2.37×1010、2.60×1010copies/µL,作为质粒标准品。
2.2 多重TaqMan荧光定量RT-PCR最佳反应条件的确定 经优化后,获得多重TaqMan荧光定量RT-PCR最佳反应体系(20 µL):Premix Ex TaqTM(Probe qPCR)10 µL,SVA、A型及亚洲I型FMDV特异性上、下游引物(20 pmol/µL)各0.5 µL,探针(20 pmol/µL)各0.4 µL,O型FMDV特异性上、下游引物(20 pmol/µL)及探针(20 pmol/µL)各0.3 µL,模板2 µL, ddH2O 2.9 µL。扩增程序为:95℃预变性30 s;95℃变性5 s,58℃退火34 s,40个循环;同时收集荧光信号。阴性对照的检测结果应无特定扩增曲线,且Ct值>35.0或无,阳性对照Ct值≤35.0,且出现特定的扩增曲线,判定检测结果成立。在检测结果成立的前提下,若样品检测结果Ct值≤35.0,且出现特定的扩增曲线,判定为阳性;否则,判定为阴性。
2.3 多重TaqMan荧光定量RT-PCR标准曲线的建立 将4种重组质粒标准品pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1混合后10倍系列稀释成浓度为2.50×108~2.50×101copies/µL,作为模板,进行多重荧光定量PCR,获得多重TaqMan荧光定量RTPCR扩增曲线及标准曲线(图1)。结果显示,4条标准曲线的相关系数R2均在0.998以上。结果表明,4种质粒标准品的初始浓度与Ct值之间呈现良好的线性关系。
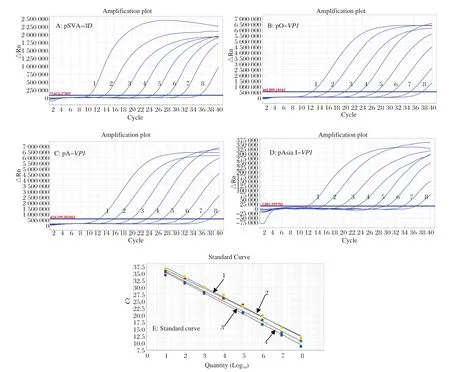
图1 多重TaqMan荧光定量RT-PCR扩增曲线(A、B、C、D)及标准曲线(E)Fig. 1 Dynamic curves (A, B, C, D) and standard curves (E) of the multiplex TaqMan real-time RT-PCR
2.4 特异性试验 以pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1 4种重组质粒标准品,SVA、FMDV(O型、A型、亚洲I型)、CSFV、PRRSV的cDNA及PRV、PPV、PCV2、PCV3的DNA为模板,进行多重TaqMan荧光定量RT-PCR扩增。结果,仅有4种重组质粒标准品、SVA、FMDV(O型、A型及亚洲I型)的cDNA出现扩增曲线,且Ct值小于35个循环,检测结果为阳性;而其他病毒检测结果均为阴性(图2)。表明该方法具有较强的特异性。

图2 多重TaqMan荧光定量RT-PCR特异性试验Fig.2 Dynamic curves of the multiplex TaqMan real-time RT-PCR for specificity analysis
2.5 敏感性试验 将4种重组质粒标准品pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1混合后10倍系列稀释,作为模板,用于多重TaqMan荧光定量RT-PCR的敏感性试验。结果显示,Ct值在35个循环以下时,pSVA-3D、pO-VP1、pA-VP1、pAsia I-VP1的检出下限分别为2.50×101、2.50×102、2.50×102、2.50×102copies/µL(图3)。表明该方法敏感性较高。
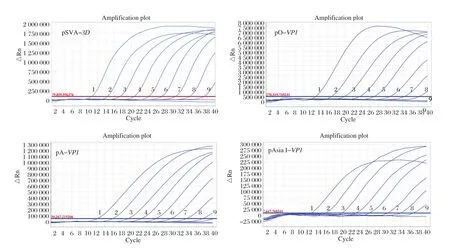
图3 多重TaqMan荧光定量RT-PCR敏感性试验Fig. 3 Dynamic curves of the multiplex TaqMan real-time RT-PCR for sensitivity analysis
2.6 重复性试验 取4种重组质粒标准品2.50×107、2.50×105、2.50×103copies/µL混合物,用于多重TaqMan荧光定量RT-PCR的重复性试验。结果,组内与组间重复性试验Ct值的变异系数均小于2%(表2)。表明该方法重复性良好。
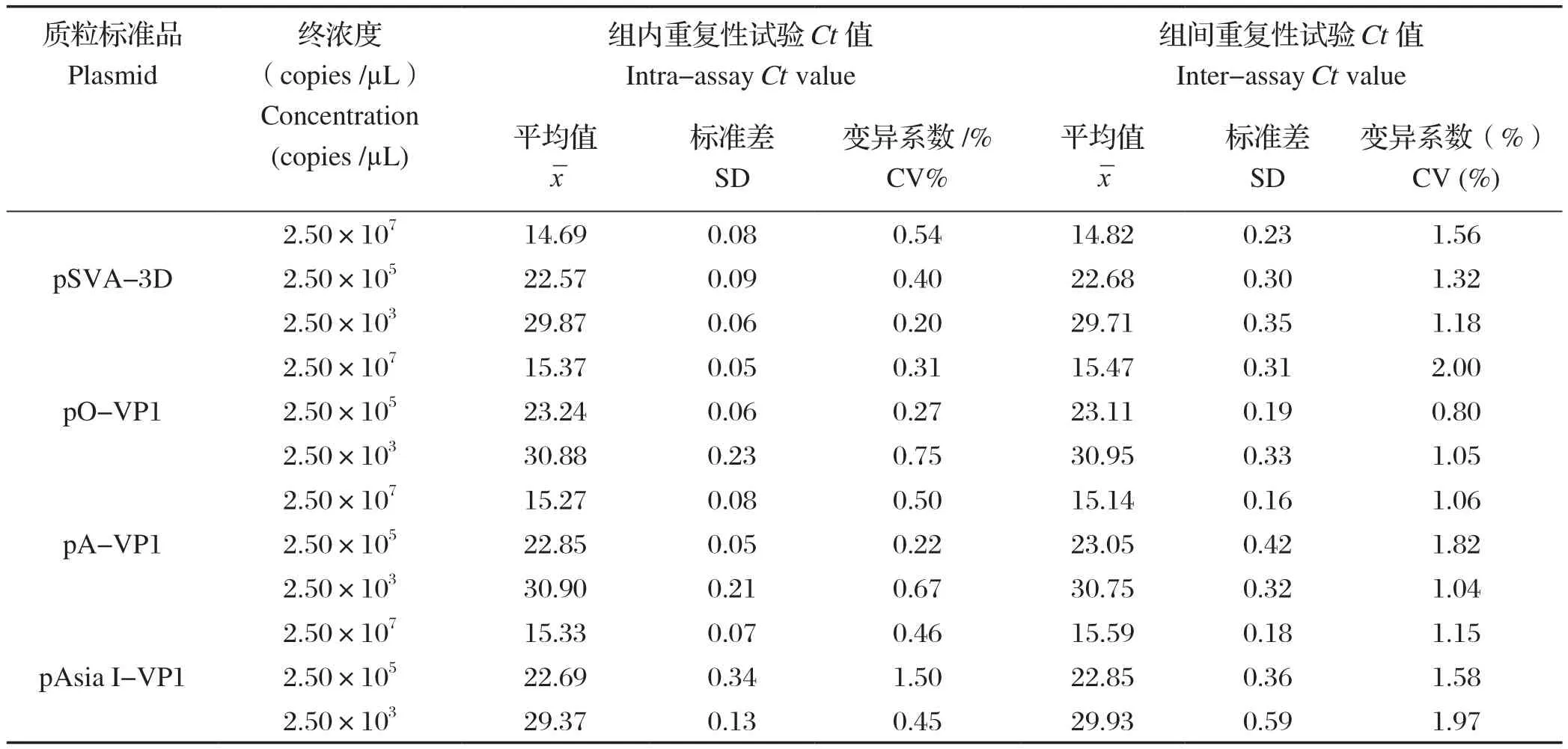
表2 多重TaqMan荧光定量RT-PCR重复性试验Table 2 Repeatability analysis of the multiplex TaqMan real-time RT-PCR
2.7 多重TaqMan荧光定量RT-PCR方法的临床应用应用所建立的多重TaqMan荧光定量RT-PCR方法,对30份临床疑似样品进行检测,结果检出SVA阳性6份,阳性率为20.0%;检出O型FMDV阳性21份,阳性率为70.0%;未检出A型、亚洲I型FMDV。同时,应用李秀博等[20]建立的SVA荧光定量RT-PCR方法进行检测,检出SVA阳性6份(20%);应用国家标准《口蹄疫诊断技术》(GB/T 18935-2018)进行检测,检出O型FMDV阳性21份(70%);与本研究所建立的方法对SVA以及O型、A型、亚洲I型FMDV检测结果的符合率为100%。
3 讨论
在我国,广东省2015年首次报道SVA感染发病猪[5],此后相继在湖北、黑龙江、福建及河南等多个省份暴发由SVA感染引起的PIVD[12-14]。至于猪FMD,目前我国猪群存在O型、A型FMD,以O型为主[21],而亚洲I型FMD也曾在我国发生。2005年5月至2018年12月我国共向OIE通报FMD疫情162次,其中O型79次,A型37次,亚洲I型46次;但亚洲I型自2011年以后国内未发生疫情、未发现监测阳性样品,2018年起亚洲I型FMD在我国免疫退出(农业农村部第2635号公告)。但是,我国周边的一些国家仍有O型、A型及亚洲I型FMD发生[22-25],随时有传入我国的风险。由于SVA和O型、A型FMDV在我国仍时有发生,而亚洲I型随时有从周边国家传入的威胁,因此对SVA和O型、A型、亚洲I型FMDV的防控丝毫不可松懈。由于SVA和FMDV所致疫病的临床症状、病理变化极为相似,难以区分,给临床诊断造成很大困难,本研究借助实验室分子诊断技术,利用荧光定量RT-PCR方法特异、灵敏、高效等优点,针对SVA与O型、A型、亚洲I型FMDV,设计特异性引物和TaqMan探针,经优化反应条件,成功建立了鉴别检测上述病原的多重荧光定量RT-PCR方法,为实验室检测提供了有效的技术方法,具有重大的现实意义。所建立的方法与FMD诊断技术的国家标准、已发表文献中的SVA检测方法[20],对临床疑似样品检测结果的符合率为100%,进一步验证了本研究所建立方法的可靠性、实用性。
应用本研究建立的方法对30份临床疑似样品进行检测,结果检出SVA阳性6份,阳性率为20%(5/30),检出O型FMDV 21份,阳性率为70%(8/30);未检出A型及亚洲I型FMDV。检测结果证实了SVA在广西猪群的存在和流行,也表明了FMDV在广西的临床流行毒株仍以O型为主。国内其他学者也对临床病猪疑似样品进行了SVA和FMDV的检测,谢彩华等[15]检测来自河南省的123份临床疑似样品,结果FMDV检出阳性率为8.13%(10/123),其中A型FMDV检出阳性率为4.88%;刘健新等[26]检测来自广东省的124份临床疑似样品,结果SVA检出阳性率为3.2%;张志等[27]对2016-2018年从多个省份采集的病料进行SVA监测,结果SVA检出阳性率分别为14.6%、21.9%及22.6%;林彦星等[19]检测来自华南地区的116份临床样品(病猪内脏、水疱液、口腔拭子、粪便样品),结果SVA检出阳性率为6.03%(7/116)、FMDV检出阳性率为12.93%(15/116)。以上结果表明,我国猪群存在不同程度的SVA和FMDV感染。而我国周边国家FMD疫情不断,仅2018年全球就有45个国家向OIE通报口蹄疫疫情,亚洲地区报告的血清型包括O型、A型及亚洲I型,以O型分布最广,其中蒙古、不丹、泰国、越南发生了O型、A型口蹄疫,尼泊尔、阿富汗和伊朗发生O型、A型及亚洲I型口蹄疫[25]。因此,必须加强SVA和O型、A型、亚洲I型FMDV的监测和流行病学调查。本研究所建立的多重实时荧光RT-PCR方法,利用同一个反应即可快速地同时鉴别SVA以及FMDV不同血清型,大大缩短了检测周期;对SVA的检出下限达到2.50×101copies/μL,对O型、A型、亚洲I型FMDV的检出下限均达到2.50×102copies/μL,在临床感染和混合感染前期病毒含量很低时,本方法也能敏感、准确地检测和区分出来,有助于感染猪的及早筛查、精准拔除。因此,本方法具有很高的临床实用价值和应用前景。
总之,本研究针对SVA 3D基因以及O型、A型、亚洲I型FMDV VP1基因序列,分别设计特异性引物和探针,经过优化反应条件,成功建立了特异性强、敏感性高、重复性好的SVA与O型、A型、亚洲I型FMDV多重荧光定量RT-PCR鉴别检测方法,为临床上SVA与O型、A型、亚洲I型FMDV的鉴别检测及流行病学调查提供了特异、敏感、高效的检测方法。
——一道江苏高考题的奥秘解读和拓展

