鸡传染性腺胃炎相关的圆圈病毒3型 SYBR GreenⅠ实时荧光定量PCR方法的建立
田 雪,于可响,胡 峰,马秀丽,刘存霞,黄 兵,吴家强,宋敏训,李玉峰
(山东省农业科学院家禽研究所 禽病诊断与免疫重点实验室,济南 250023)
鸡传染性腺胃炎主要引起病鸡体态消瘦、精神沉郁、卧地不起,腺胃肿大、腺胃乳头肿大粘连等症状[1]。在管理不善的养殖场,发病率为15%~60%,生物安全较好的鸡场发病率较低。病程10~20 d,甚至更长。发病5~8 d后达到死亡高峰,给养殖场带来较大的经济损失[2]。鸡圆圈病毒3型(Gyrovirus 3, GyV3)是一种环状单链DNA病毒,2012年首次在智利患急性肠胃炎的儿童粪便中发现[3]。2014年从雪貂粪便中检出GyV3,经基因组序列分析确定为gyroviruses A分支[4]。
2018年袁世玉等[5]使用高通量测序首次从患有传染性腺胃炎的商品肉鸡中分离到GyV3, 经基因序列分析该病毒属于指环病毒科圆圈病毒属gyrovirus的A分支。流行病学分析显示鸡传染性腺胃炎与GyV3有密切关系。本研究建立了一种能够快速特异检测该病毒的荧光定量方法,用于GyV3的快速诊断与监测,并能够对GyV3的感染进行定量分析,现报道如下。
1 材料与方法
1.1 病毒 鸡圆圈病毒(Gyrovirus 3, Gyv3)、传染性支气管炎病毒(Infectious bronchitis virus, IBV)、传染性法氏囊炎病毒(Infectious bursal disease virus, IBDV)、传染性喉气管炎病毒(Infectious laryngotracheitis virus, ILTV)、新城疫病毒(Newcastle disease virus, NDV)、禽流感病毒H9亚型(Avian influenza virus-H9, AIV-H9)、马立克氏病毒(Marek's disease virus, MDV)、禽腺病毒4型(Fowl adenovirus serotype 4, FAdV-4)、网状内皮增生症病毒(Reticuloendotheliosis virus, REV)、禽呼肠孤病毒(Avian reovirus, ARV)、鸡传染性贫血病毒(Chicken infectious anemia virus, CIAV)均由本实验室分离鉴定及保存。
1.2 试剂与仪器 BioSpin组织细胞DNA/RNA共提取试剂盒、BioSpin胶回收试剂盒购自杭州博日科技有限公司;2× Taq PCR StarMix with Loading Dye、StarPrep Plasmid Miniprep Kit购自北京康润诚业生物科技有限公司;TB Green™Premix Ex Taq™Ⅱ (Tli RNaseH Plus)、DL2000 DNA Marker、pMD18-TVector购自TaKaRa公司;Trans5α感受态细胞购自全式金生物公司;Light Cycler®96定量PCR仪购自罗氏公司;普通PCR仪、离心机购自Thermo公司;凝胶成像系统购自济南东岱科学器材有限公司;电泳仪购自北京市六一仪器厂。
1.3 引物设计与合成 从NCBI的GenBank数据库中下载现有的3条序列(GenBank登录号依次为:MG366592.1、JQ308210.1、KM348009.1),利用DNAStar软件的Megalign程序进行序列比对后,根据保守区域的序列设计引物,最后选取无引物二聚体以及非特异性产物扩增的一对引物用于建立检测鸡GyV3的荧光定量PCR方法,引物序列GyVs:5'-TCCAATAAGTTCGTCGGAGTC-3',GyVa:5'-GCAGATCGCGTCGTGAGTA-3',扩增产物片段大小为125 bp。普通PCR的引物序列为GyV-1s:5'-TGGTCGTGCGTGGAAAC-3',GyV-1a:GGTATGAATACGAGCCCTTG,扩增片段大小为336 bp。利用荧光定量PCR引物和普通PCR引物同时对样品进行扩增反应,通过测序鉴定引物的有效性。引物合成及测序均由由青岛擎科生物技术有限公司完成。
1.4 重组质粒标准品的构建 参照核酸提取试剂盒的说明书从病料中提取鸡GyV3的DNA,以提取的DNA为模板,利用所设计合成引物进行PCR扩增,扩增产物按DNA胶回收试剂盒的说明进行DNA片段的切胶回收,将回收产物克隆于pMD18-T载体中,然后转化至Trans5α感受态细胞中,挑菌PCR鉴定为阳性后,扩大培养后提取质粒并送至青岛擎科生物技术有限公司进行序列测定。
1.5 标准曲线的绘制 提取的质粒进行核酸浓度的测定,将初始拷贝数为3.076×1010copies/µL的质粒标准品进行10倍梯度稀释,以每个稀释度的质粒标准品为模板进行荧光定量PCR反应(为减少试验误差,每个浓度梯度3个平行)。反应体系(20 μL)为:SYBR Green I Universal Master Mix 10 μL;上、下游引物各1 μL、DEPC水6 μL、模板2 μL。反应条件为:95℃预变性60s;95℃变性10 s,60℃退火10s,72℃延伸10s,40个循环。以质粒标准品拷贝数的对数作为X轴,Ct值(循环阈值)作为Y轴,建立质粒拷贝浓度与循环阈值对应的定量标准曲线。
1.6 特异性试验 利用该方法对常见鸡病毒性病原IBV、IBDV、ILTV、NDV、AIV-H9、MDV、FAdV-4、REV、ARV、CIAV的DNA或cDNA进行荧光定量PCR扩增,以验证该方法的特异性。
1.7 敏感性试验 将重组质粒标准品作为模板,10倍梯度稀释(101~1010,即3.076×100~3.076×1010copies/μL),将稀释后的模板进行荧光定量PCR反应用以检测本方法的敏感性,以能检测到重组质粒标准品的最低核酸浓度为检测下限。
1.8 重复性试验 以同一批次3个不同浓度的质粒标准品为模板进行批内重复性试验,以不同批次相同浓度的质粒标准品作为模板进行批间重复性试验,每个检测重复3次,最后计算模板在不同起始浓度下荧光定量PCR反应Ct值的组内与组间变异系数,用以评价该方法的重复性。
1.9 临床样品的检测 临床样品提取核酸,并利用本研究建立的荧光定量PCR方法进行检测,同时将该方法的检测结果与普通PCR方法的结果进行对比,以确证本方法检测结果的准确性。
2 结果
2.1 引物鉴定 以GyV的阳性病料为模板,使用荧光定量PCR的引物GyVs/a和普通PCR的引物GyV-1s/a进行扩增,凝胶成像的结果见图1,扩增片段测序结果与模板序列一致。

图1 荧光定量PCR和普通PCR的引物的鉴定Fig.1 Identification of primers for fluorescent quantitative PCR and conventional PCR
2.2 重组质粒标准样品的制备 以鸡GyV3的DNA为模板构建重组质粒标准品,经PCR和测序鉴定,结果该保守区域的片段成功克隆到pMD18-T载体中(图1),质粒浓度为95 ng/μL,根据拷贝数计算公式(6.02×1023次拷贝数/摩尔)×(浓度ng/µL×10-9)/(DNA长度×660)=copies/µL,该质粒的拷贝数为3.076×1010copies/μL。

图2 重组质粒样品目的基因的 PCR 鉴定Fig.2 PCR identification of target gene cloned in plasmid
2.3 标准曲线的建立 以10倍梯度稀释的质粒标准品为模板进行实时荧光定量PCR扩增,以建立方法的标准曲线,结果显示,Ct值与质粒标准品拷贝数的对数呈现出良好的线性关系(图3),标准曲线方程为:y=-3.4351x+48.59;相关系数R2=0.99,线性关系良好,扩增效率为1.95。
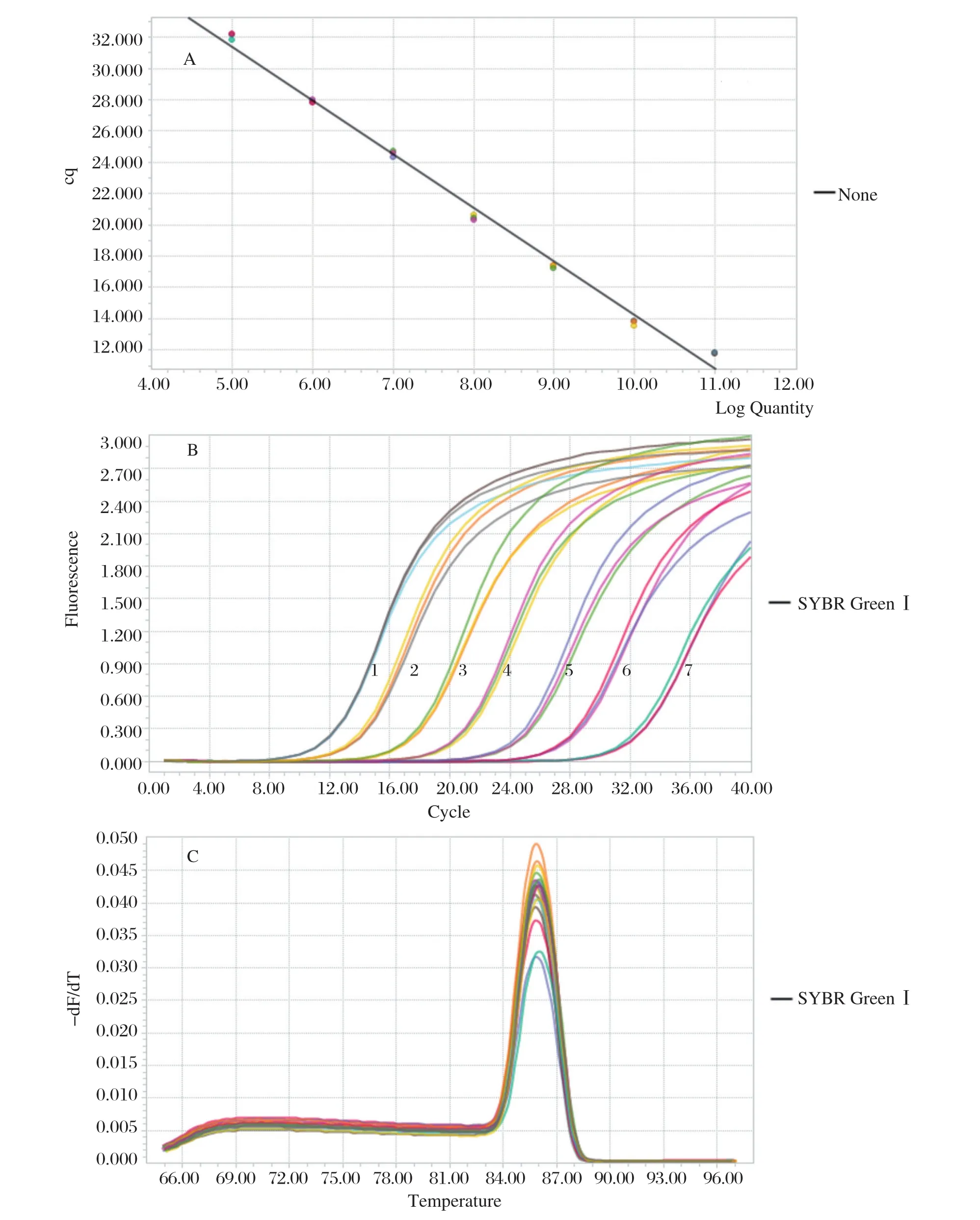
图3 检测方法标准曲线的建立Fig.3 Standard curve of the fluorescent quantitation PCR method
2.4 特异性试验 利用建立的SYBR Green Ⅰ荧光定量PCR方法对IBV、IBDV、ILTV、NDV、AIV-H9、MDV、REV、ARV、CIAV、FAdV-4的DNA(或cDNA)模板进行PCR扩增,结果显示,对这些病原核酸均未出现特异性的扩增,而仅对鸡GyV3有特异性的扩增,从而证明该方法具有很好的特异性(图4)。

图4 荧光定量PCR方法的特异性试验结果Fig.4 Specificity test results of fluorescence quantitative PCR method
2.5 敏感性试验 将浓度为3.076×1010copies/μL的质粒标准品进行10倍系列梯度稀释后分别作为模板,利用本研究建立的方法进行检测,结果显示,该方法的检测限为3.076×101copies/μL(图5A),并且引物特异性良好(图5B)。

图5 荧光定量PCR方法的敏感性试验结果Fig.5 Sensitivity test results of fluorescence quantitative PCR method
2.6 重复性试验 利用本研究建立的方法进行组内、组间重复性试验,结果显示,组内和组间变异系数均小于1.0%(表1),表明本研究建立的方法具有良好的重复性。
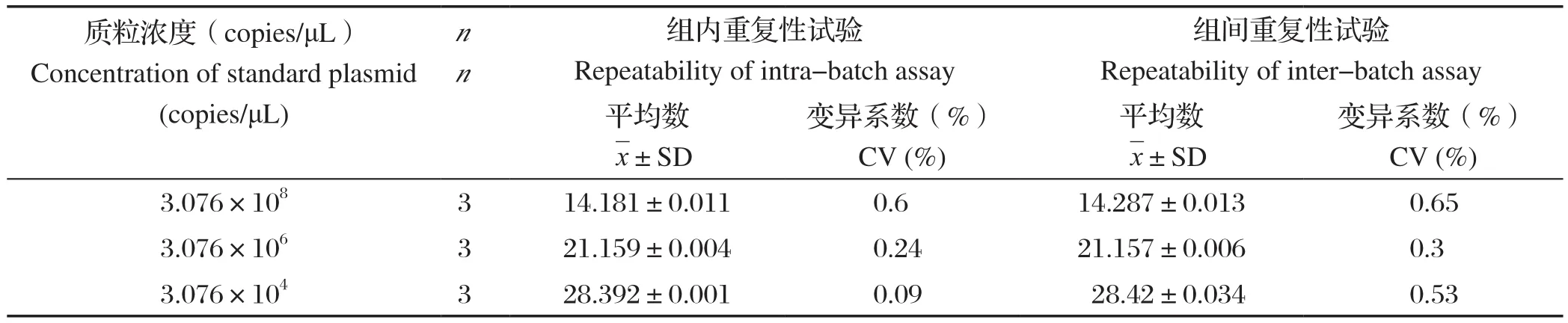
表1 荧光定量PCR方法的组内、组间重复性试验结果Table 1 Intra-assay and inter-assay reproducibility test of the fluorescent quantitation PCR method
2.7 临床样品的检测 用本试验建立的实时荧光定量PCR检测方法对57份疑似传染性腺胃炎的临床样品进行检测,检测出阳性样品7份,阳性率为12.28%。采用普通PCR的方法57份临床样品中,亦检测出7份阳性样本,符合率100%。
3 讨论
鸡传染性腺胃炎主要表现为饲料转化率降低、饲料消化不良、生长停滞或迟缓,有的鸡体重仅为正常鸡的50%或更少[6-7]。随着集约化养殖业的发展,该病严重影响了肉鸡产业的发展,已经在全球范围内造成显著的经济损失。上世纪90年代中期该病开始在我国出现,引起了禽病科研工作者的广泛关注。许金俊等[8]从腺胃肿胀、出血的病鸡体内分离到疑似冠状病毒病原,其单克隆抗体与鸡传染性支气管炎病毒有明显交叉反应;王永玲等[9]利用腺胃型传染性支气管炎病毒分离株制备的灭活疫苗对本病具有明显的预防效果。杜元钊等[10]从表现传染性腺胃炎的病鸡中分离到网状内皮增生症病毒,并用该病毒的细胞培养物成功复制出相同症状。除此之外,传染性法氏囊病毒、腺病毒、呼肠孤病毒以及小RNA病毒等[6]均曾被怀疑与传染性腺胃炎有关,但未被证实[11-13]。
Li等[14]首次从发生腺胃炎的肉鸡中分离到GyV3,流行病学调查显示该病毒与鸡传染性腺胃炎具有一定相关性[5]。目前,GyV3同鸡贫血病毒一起被归到指环病毒科(Anelloviridae)环形病毒属(Gyrovirus)[15]。该病毒与分离自急性胃肠炎儿童的GyV3具有很高的同源性,说明该病毒可能有潜在的公共卫生意义,但仍需进一步确定。
荧光定量PCR方法具有敏感性高、特异性强、简便快捷等特点,现已被广泛应用到各种疾病的检测。本研究以现有的序列为基础,设计特异性引物,建立了针对鸡GyV3的SYBR Green Ⅰ的实时荧光定量PCR检测方法,该方法重复性好,变异系数均低于1.0%,灵敏度高,检测下限可达到30.76 copies/μL。利用本方法对IBV、IBDV、ILTV、NDV、AIV-H9、MDV、FAdV-4、REV、ARV、CIAV等病毒进行检测,结合熔解曲线与动力扩增曲线综合判定,该方法对GyV3扩增的特异性良好,可应用于该病毒的诊断和流行病学监测。通过对生产中采集的疑似鸡传染性腺胃炎样品进行检测发现GyV3荧光定量PCR方法的检出率达到12.28%,这与袁世玉等[5]的报道较为一致,说明该病毒在养鸡生产中具有一定的流行性,需引起我们的重视。
——一道江苏高考题的奥秘解读和拓展

