生物源方铁锰矿吸附Cu(II)和Zn(II)的特性
罗 军 陈晓蓓 陈望琼 陈恩莲 颜聿鸿 李 丁
1. 湖南工业大学 生命科学与化学学院 湖南 株洲 412007
2. 湖南工业大学 百合种质资源创新与深加工 湖南省工程研究中心 湖南 株洲 412007
1 研究背景
采矿和冶金等工业过程中产生的酸性废水含有大量的重金属离子,例如铜和锌等重金属离子[1-2]。这些重金属离子具有较高生物毒性和不能降解的性质,引起了社会的广泛关注[3-4]。重金属的治理方法有离子交换、吸附、反渗透和化学沉淀法等[5-9]。其中,吸附法因成本低、治理效能高,已被广泛应用于去除水体中的重金属。在众多的吸附剂中,锰氧化物作为一种高活性的矿物,参与了地表中各类重金属的吸附和氧化还原反应,被视为极具应用价值的吸附剂。
在自然界中,人们已发现30多种锰氧化物矿物,常见的有水钠锰矿(δ-MnO2)、方铁锰矿(α-Mn2O3)、水锰矿(γ-MnOOH)等[10]。固态锰氧化物是由水溶态Mn(II)发生氧化而产生,自然条件下的Mn(II)氧化分为非生物(化学)氧化和生物氧化。非生物(化学)氧化过程极其缓慢,而生物介导的Mn(II)氧化速率是化学氧化速率的105倍[11]。因此,环境中大多数锰氧化物的产生被认为是由生物氧化介导产生,其中又以细菌介导的Mn(II)氧化最具代表性。近年来,关于细菌介导的Mn(II)氧化模式菌株主要有:海洋芽孢杆菌、盘状纤毛虫菌,以及恶臭假单胞菌等[12-15]。这些细菌氧化Mn(II)后的产物是水钠锰矿(δ-MnO2),其具有粒径小、结晶性弱、锰价态高、比表面积大和八面体结构中空穴多等特点,与化学合成的锰氧化物相比,具有更强的表面吸附活性[16-17]。
水钠锰矿吸附重金属离子的机制有:
1)金属离子的表面吸附,即金属离子的3个配位氧原子与Mn(II)周边的3个氧原子共享,形成三角共享复合物[18];
2)金属离子的空穴吸附,即金属离子被完整地包含在水钠锰矿的空穴中[19];
3)金属离子的边缘吸附,即金属离子的两个配位氧原子与水钠锰矿边缘的两个氧原子共享,形成双角共享复合物[20],或金属离子配位复合物与水钠锰矿边缘的两个平面共享,形成双面共享复合物[21]。
目前,关于生物源锰氧化物吸附和氧化重金属离子的研究主要集中在生物源水钠锰矿,该矿物主要由上述模式菌株氧化Mn(II)而获得。由于在不同环境下细菌氧化Mn(II)的机理不同[22],产生得到的锰氧化物的结构也可能不同。例如,B.Hosseinkhani[23]等,从海水中获得了一株革兰氏阴性Acinetobacter菌株,其Mn(II)氧化的产物是一种类似方铁锰矿的低价态Mn2O3。相对于高价态的生物源水钠锰矿(+4价),低价态的生物锰氧化物吸附重金属离子的研究仍有待丰富。
本研究利用土壤源Mn(II)氧化细菌Providenciasp. LLDRA6制备生物锰氧化物[24],纯化后通过一系列的表征技术确定其为低价态生物锰氧化物。在不同pH和离子初始浓度条件下,评价了该低价态生物锰氧化物在水溶液中吸附重金属离子的能力。在此基础上,进一步分析吸附动力学行为和吸附过程机理。
2 实验
2.1 材料与仪器
1)实验主要材料
盐酸(HCl)、氢氧化钠(NaOH)、四水合氯化锰(MnCl2· 4H2O)、苯酚(C6H5OH)、三氯甲烷(CHCl3)、甲醇(CH3OH)、次氯酸钠(NaClO)、硝 酸 钠(NaNO3)、 三 水 合 硝 酸 铜(Zn(NO3)2·3H2O)、六水合硝酸锌(Zn(NO3)2· 6H2O),实验所用试剂均为分析纯,国药集团化学试剂有限公司生产。
本研究所用菌株为湖南株洲某冶炼厂分离的普罗威登斯细菌Providenciasp. LLDRA6[23],分别保存于中国典型菌株保藏中心(序列号为2018876)和韩国典型培养物保藏中心(序列号为92091)。
LB液体培养基:酵母浸粉5 g,胰蛋白胨10 g,氯化钠(NaCl)5 g,pH为7.2~7.4,去离子水1000 mL,121 ℃下高压灭菌20 min。
2)实验主要仪器
扫描电子显微镜(scanning electron microscope,SEM),ZEISS EVO MA 10,德国卡尔·蔡司股份公司;高分辨率透射电子显微镜(high resolution transmission electron microscope,HRTEM),FEI Tecnai G2 F20,美国FEI公司;能谱分析仪(energy dispersive spectrometer,EDS),Smartedx,德国卡尔·蔡司股份公司;X射线多功能电子能谱仪(X-ray photoelectron spectroscopy,XPS),VG Multilab 2000 X,美国Thermal Electron公司;选区电子衍射仪(selected area electron diffraction,SAED),Oxford X-max 80T,英国牛津仪器集团;比表面和孔径分布分析仪,Micromeritics ASAP 2020,美国麦克公司;X射线衍射仪(X-ray diffraction,XRD),Bruker D8 Advance,德国布鲁克公司;原子吸收光谱仪,AA-7020,北京东西分析仪器有限公司。
2.2 方法
2.2.1 生物锰氧化物的制备和纯化
从-80 ℃冰箱中取菌种划线于LB固体培养基,37 ℃培养12 h后,挑取单菌落接种于液体培养基中作为种子液备用。按体积分数0.2%的接种量接入LB液体培养基做扩大培养,35 ℃、180 r/min下避光培养12 h,然后加入浓度为1 mol/L的MnCl2至终浓度为50 mmol/L,相同培养条件下培养7 d,得到菌体与生物锰氧化物的混合物。
提纯方法参照M. Villalobos等[25]的方法并加以改进,具体步骤如下:
1)将培养7 d后含菌体和锰氧化物的混合物收集于50 mL离心管中,2000 r/min,离心10 min后弃上清液,去离子水重悬沉淀;相同条件下再次离心,重复此步骤7~8次,保留管底沉淀物。
2)向沉淀物中加入苯酚后超声处理50 min,随后加入与苯酚同体积的三氯甲烷再继续超声处理20 min,最后按体积比为12:3:5加入甲醇、三氯甲烷和去离子水,再次超声处理10 min。
3)超声处理结束后离心弃上清液,用去离子水清洗沉淀物。
4) 加入HCl溶液重悬沉积物,将50 mL离心管中的悬浮液酸化至pH为3.0,室温下摇床振荡处理30 min。
5) 离心弃上清液,用去离子水清洗沉淀物,直至上清液pH至中性。
6) 加入体积分数为0.17%的NaClO,摇床震荡处理4 h。
7) 离心弃上清液,保留离心管底部褐色沉淀,用去离子水清洗沉淀;将褐色沉淀物进行冷冻干燥处理,用离心管密封好冷冻干燥的生物锰氧化物,将密封好的生物锰氧化物置于常温下备用。
2.2.2 生物锰氧化物的表征
生物锰氧化物的微观形态用扫描电子显微镜和高分辨率透射电子显微镜观察;成分用能谱分析仪分析;晶体特征用选区电子衍射仪测定;比表面积(specific surface area,SSA)用全自动比表面和孔径分布分析仪测定;能谱分析在X射线多功能电子能谱仪上进行;衍射分析在X射线衍射仪上进行。
2.2.3 单因素影响实验
吸附实验采用批量实验方式进行,重金属离子Zn(II)或Cu(II))的吸附实验在NaNO3电解质(0.1 mol/L)溶液中进行。向100 mL锥形瓶中分别加入一定体积25 mmol/L的Zn(NO3)2溶液或25 mmol/L的Cu(NO3)2溶液,并加入0.1 mol/L的NaNO3溶液至48 mL,最后加入2 mL的5 g/L生物锰氧化物悬浮液使生物锰氧化物的终质量浓度为0.2 g/L。其中被处理的重金属离子(Zn(II)或Cu(II))终浓度分别为0.2, 0.4, 0.6, 0.8, 1.0 mmol/L。将锥形瓶置于摇床中,25 ℃、180 r/min下振荡反应24 h,在反应过程中将体系pH分别调为4, 6。反应结束后10 000 r/min离心10 min,离心后保留上清液并采用0.22 μm过滤器过滤上清液,最后用原子吸收光谱仪测定上清液中重金属离子(Zn(II)或Cu(II))的浓度。
2.2.4 数据处理
生物锰氧化物的吸附性能是通过吸附容量来判断,其计算公式为

式中:qe为平衡吸附容量,mg/g;
C0为初始质量浓度,mg/L;
Ce为平衡时质量浓度,mg/L;
V为体系的体积,L;
m为吸附剂的质量,g。
3 结果与讨论
3.1 生物锰氧化物的结构与性质
将纯化后的生物锰氧化物进行SEM-EDS表征,结果如图1所示。由图1可知,生物锰氧化物由不规则的颗粒组成,颗粒大小为30~80 μm。其组成成份以Mn、C和O元素为主,还含有少量的N、P、S和Zn元素,这表明生物锰氧化物中还含有少量杂质,该现象与其他类型的生物源锰氧化物相似[26]。


图1 生物锰氧化物的扫描电镜和能谱图Fig. 1 The SEM-EDS image of biogenic manganese oxide
生物锰氧化物的XRD检测结果如图2所示。由图2可知,生物锰氧化物在2θ为32.951°、55.189°和65.806°有明显的特征峰,这3个衍射峰分别对应方铁锰矿(Mn2O3,JCPDS 41-1442)的(222)、(440)和(622)晶面,这说明该生物锰氧化物为弱晶质的方铁锰矿(Mn2O3)。

图2 生物锰氧化物和方铁锰矿标准卡片的XRD图谱Fig. 2 XRD patterns of biogenic manganese oxide and bixbyite standard card
生物锰氧化物的HRTEM-SAED结果如图3所示。由图3可知,生物锰氧化物是不规则形状的、纳米级的颗粒,颗粒大小为20~100 nm(图3a)。通过Digital micrograph软件分析,生物锰氧化物的晶格间距为0.272 nm,对应方铁锰矿的(222)晶面(图3b)。图3c中可看到3个明显的衍射环,分别对应方铁锰矿的(211)、(321)和(332)晶面。


图3 生物锰氧化物的高分辨率透射电镜和选区电子衍射图Fig. 3 HRTEM-SAED patterns of biogenic manganese oxide
生物锰氧化物的XPS图谱如图4a所示,对Mn 2p峰进行曲线拟合,拟合结果如图4b所示。由图4a可知,生物源Mn2O3的组成元素为Mn、C、O、N 和P。由图4b可知,Mn(II)和Mn(III)在生物锰氧化物中同时共存,其中Mn(III)占比高,为79.76%。
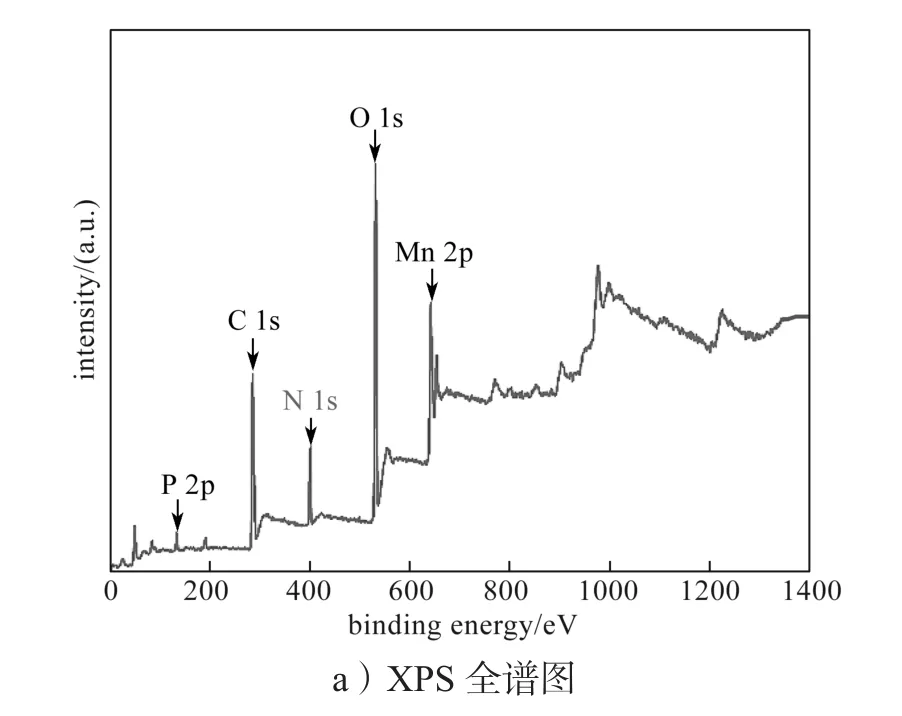
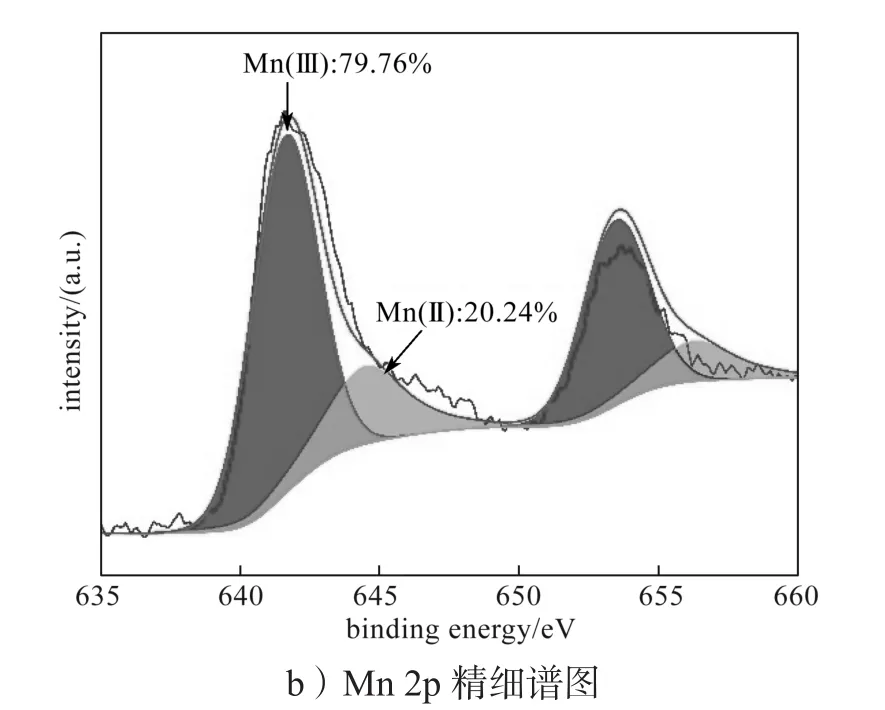
图4 生物锰氧化物的XPS图谱Fig. 4 XPS spectra of biogenic manganese oxide
生物源Mn2O3样品的N2吸附和解吸等温结果如图5a所示。


图5 生物锰氧化物的孔结构特征图Fig. 5 Pore structure characteristics of biogenic manganese oxide
由图5a可知,生物源Mn2O3样品表现出IV型等温线的特征,且显示出与H3型相似的磁滞现象。IV型等温线表明该材料具有中孔结构,孔隙宽度大于4 nm,而H3型磁滞环表明该材料由非刚性的板状颗粒聚合而成[27]。该结果表明在生物源Mn2O3中存在颗粒堆积形成的介孔结构。
采用Barrett-Joyner-Halenda方法和Brunauer-Emmet-Teller(BET)[28-29]模型计算出生物源Mn2O3的孔径和比表面积,结果如图5b和5c所示。其平均孔径为5.269 nm,比表面积为5.740 m2/g。
3.2 吸附的影响因素
3.2.1 pH对吸附的影响
生物源Mn2O3在pH为4和6条件下分别对Cu(II)和Zn(II)的吸附结果如图6所示。对比图6a与6b可知,pH的升高,生物源Mn2O3对Cu(II)和Zn(II)的吸附容量也升高,可能是由于溶液中pH的升高导致生物源Mn2O3表面聚集的负电荷量增加,使负电荷与金属阳离子之间的静电吸引增强,进一步增强了生物源Mn2O3的吸附作用。锰氧化物在pH较高的溶液中其结晶度会降低,这种状态更有利于对重金属的吸附[30]。综上所述,生物锰氧化物对2种重金属吸附反应的最适pH为6。
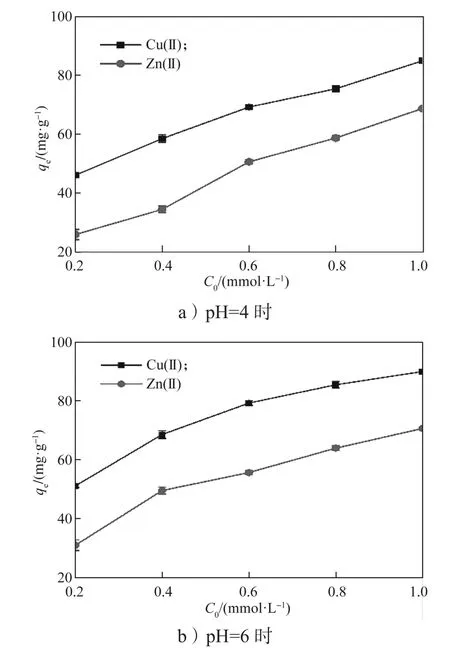
图6 不同pH下生物源Mn2O3的吸附容量与离子浓度的关系Fig. 6 Relationship between the adsorption capacity and ion concentration of biogenic Mn2O3 at different pH values
3.2.2 初始离子浓度对吸附的影响
在其它实验条件相同情况下,考察不同初始浓度(0.2, 0.4, 0.6, 0.8, 1.0 mmol/L)的 Cu(II)和 Zn(II)对生物源Mn2O3吸附效果的影响,实验结果如图6所示。由图6可知,在pH值为6,Cu(II)和Zn(II)浓度均为1 mmol/L时,吸附容量达到最大值,分别为89.899 mg/g和70.595 mg/g。随着初始金属离子浓度的增加,生物源Mn2O3对同种金属吸附容量的增加,这是由于金属离子在较高的初始浓度下,金属离子与吸附剂间相互作用的机会增加,因此吸附剂的吸附效果越明显。在同一初始浓度下,生物源Mn2O3对Cu(II)离子的吸附容量大于Zn(II)离子的,这是由于Cu(II)具有更高的电负性,较小的水化半径和较低的水化能[31]。Cu和Zn的电负性分别为1.900和1.650,电负性越高,对反离子的引力就越大。Cu(II)和Zn(II)的水化半径分别为0.419和0.430 nm,水化半径越小,静电引力越大。Cu(II)和Zn(II)的水化能分别为-2160, -2197 kJ/mol,水化能较低的金属离子更容易失去水化壳层。因此,生物源Mn2O3对Cu(II)的吸附容量大于对Zn(II)的吸附容量。
3.3 吸附行为分析
3.3.1 吸附动力学分析
为进一步了解生物源Mn2O3对废水中Cu(II)和Zn(II)的吸附机理,在pH为6,金属离子浓度均为1 mmol/L的条件下,对其反应动力学进行分析。目前常用固液吸附动力学模型有准一级动力学模型和准二级动力学模型,其方程分别为:
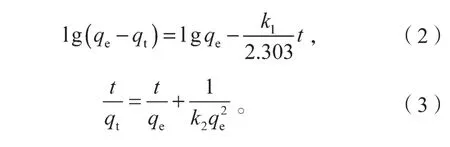
式中:qt、qe分别为经过时间t的吸附容量和平衡时刻的吸附容量,mg/g;
k1为准一级动力学模型的吸附平衡速率常数,min-1;
k2为准二级动力学模型的吸附平衡速率常数,g/(mg·min)。
生物源Mn2O3吸附Cu(II)和Zn(II)的吸附动力学结果如图7和表1所示。由图7和表1可知,在Cu(II)和Zn(II)的浓度为1 mmol/L时,Cu(II)和Zn(II)的准二级动力学的相关系数(R2)均高于准一级的相关系数,因此生物源Mn2O3对Cu(II)和Zn(II)的吸附过程更倾向于准二级动力学模型。这表明生物源Mn2O3在吸附Cu(II)和Zn(II)过程中主要受化学吸附控制。
3.3.2 等温吸附模型
等温吸附模型可体现出吸附平衡时,吸附质在溶液和吸附剂内的分布情况,最常见的等温吸附模型有两种:Langmuir模型和Freundlich模型。
Langmuir等温吸附模型由3个假设构成:1)吸附剂表面只发生单分子层吸附;2)被吸附物质能够占据的活性吸附位点可能性一致;3)吸附剂的表面是均匀的[32]。
Freundlich等温吸附模型包含的参数多用来表示吸附剂与吸附质的结合关系,是基于复杂表面吸附过程的一种假设[33]。
Langmuir等温吸附模型、Freundlich等温吸附模型的方程分别如式(4)和式(5)所示。
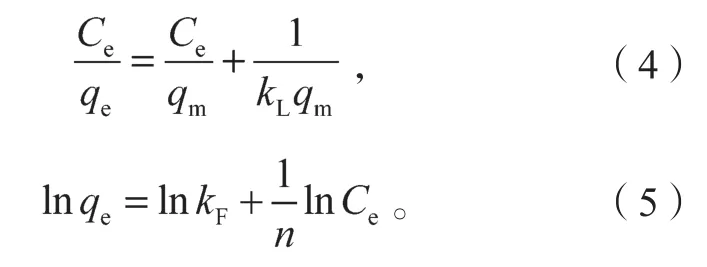
式中:qm为最大吸附容量,mg/g;
kL为Langmuir吸附平衡常数,L/mg;
kF为 Freundlich 吸附平衡常数,mg1-1/n· L1/n· g-1;
n为与温度和吸附剂有关的无量纲常数。
生物源Mn2O3吸附Cu(II)和Zn(II)的等温吸附模型结果如图8和表2所示。由图8和表2可知,Langmuir等温吸附模型(相关系数分别为R2=0.987和R2=0.998)的拟合度高于Freundlich模型(相关系数分别为R2=0.943和R2=0.979)。这表明生物源Mn2O3吸附Cu(II)和Zn(II)的过程为单分子层吸附,且吸附质之间没有相互作用。通过Langmuir模型拟合得出生物源Mn2O3吸附Cu(II)和Zn(II)的最大吸附容量分别为109.051 mg/g和88.652 mg/g,这表明所制备并纯化后的生物源Mn2O3是一种优异的吸附剂。
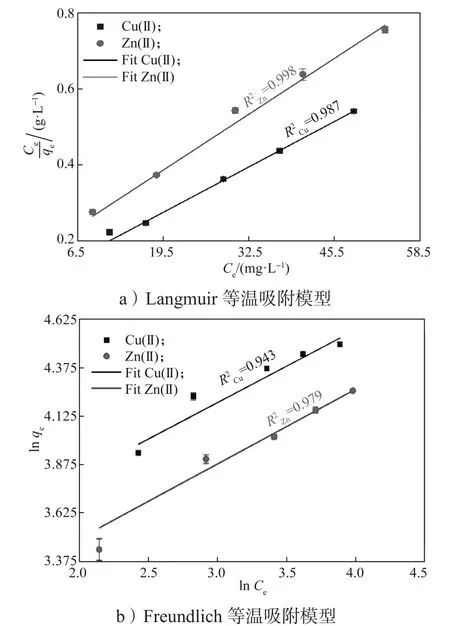
图8 生物源Mn2O3吸附Cu(II)和Zn(II)的等温吸附模型Fig. 8 Linear isotherm model of Cu(II) and Zn(II)adsorption by biogenic Mn2O3
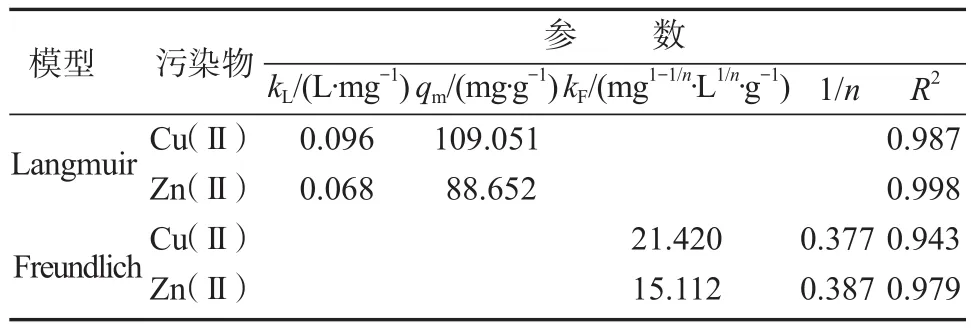
表2 生物源Mn2O3吸附Cu(II) 和Zn(II) 的等温吸附模型参数Table 2 Parameters of isotherm adsorption model for Cu(II) and Zn(II) adsorption by biogenic Mn2O3
4 结论
本文利用Providenciasp. LLDRA6制备纯化后的生物源Mn2O3为吸附剂,研究Cu(II)和Zn(II)初始浓度和溶液pH对吸附性能的影响,并根据实验结果进行动力学和等温吸附模型分析,可以得以下结论。
1)由锰氧化细菌Providenciasp. LLDRA6介导产生并纯化的生物锰氧化物是弱结晶的生物方铁锰矿(Mn2O3),且形貌为不规则颗粒状,大小为20~100 nm。SSA测定结果显示生物锰氧化物平均孔径为5.269 nm,为中孔结构,比表面积为5.740 m2/g。该生物锰氧化物主要组成元素为Mn、O,且Mn(II)和Mn(III)在锰氧化物中可共存,其中锰价态以Mn(III)为主。
2)生物源Mn2O3吸附Cu(II)和Zn(II)的最适pH为6,在1 mmol/L浓度下吸附容量可达到89.889 mg/g和70.595 mg/g。此外,生物源Mn2O3吸附Cu(II)和Zn(II)是单层吸附,吸附过程主要受化学吸附控制。
综上所述,采用生物源Mn2O3吸附废水中的Cu(II)和Zn(II),具有良好的应用前景。

