丹参酮ⅡA联合阿托伐他汀对大鼠动脉粥样硬化的治疗作用研究
叶泽森,周里岩,黄光业,薛照芸,刘培庆,陈健文
(中山大学药学院,中国广东 广州 510006)
动脉粥样硬化(atherosclerosis,AS)是心脑血管系统中最常见的疾病,由AS继发导致的重要器官缺血性损伤综合征(如心肌梗死和中风等),是威胁人类健康和导致死亡的主要原因[1]。尽管近20年来治疗手段不断改善,AS依旧有着高发病率和死亡率。虽然在许多发达国家心脑血管疾病的病死率稍有下降,但AS却在发展中国家以惊人的速度增长着[2~3]。因此,预防和治疗AS依旧是心脑血管领域一个严峻的挑战。
阿托伐他汀作为3-羟基-3-甲基戊二酰辅酶A还原酶抑制剂,能够降低胆固醇的生物合成,是目前AS的一线治疗药物之一[4]。除了降低胆固醇作用之外,阿托伐他汀已被证明具有免疫调节、改善内皮细胞功能、抗炎、抗氧化等药理作用[5]。尽管阿托伐他汀已用作治疗AS的降脂药物,但其仍存在肌病、横纹肌溶解、肝毒性等严重不良反应,一定程度上影响患者的依从性[6]。另外,在许多严重血脂异常的AS患者中,阿托伐他汀作为单药的治疗效果不佳[4]。鉴于AS的复杂病因,在一些临床试验中,阿托伐他汀通常与非他汀类降脂药物、抗高压药物、抗糖尿病药物、抗血栓药物联合治疗AS[7~10]。然而,以往的研究表明,烟酸与阿托伐他汀的联合用药对AS斑块消退的附加作用有限[11]。此外,贝特类药物的副作用与PCSK9抗体(降低血液中低密度胆固醇水平)的高成本,限制了它们与阿托伐他汀在临床上的广泛联合应用[12~13]。因此,开发新的抗AS的药物组合显得尤为重要。
丹参酮ⅡA(tanshinone ⅡA,TS ⅡA)是唇形科植物丹参中提取出的活性成分,目前临床上已用于治疗冠心病[14]。一项荟萃分析显示,丹参酮ⅡA联合西药(如阿司匹林)能更好地治疗不稳定性心绞痛[15]。近年研究表明,丹参酮ⅡA在体内外AS模型展现出抗炎、免疫调节和斑块稳定等作用[16]。血脂异常被认为是AS进展的危险因素,调节血脂是治疗AS的重要策略[17]。以往的实验结果表明,丹参酮ⅡA不影响脂质代谢,但与阿托伐他汀联用能够减少和稳定ApoE-/-小鼠AS斑块[18]。然而,考虑到ApoE蛋白的多重功能,使用AS ApoE-/-小鼠模型存在一定的局限性[19]。因此,本研究通过高脂饲料联合维生素D3建立AS大鼠模型,检测血脂等生化指标,观察组织病理学变化,研究丹参酮ⅡA联合阿托伐他汀治疗AS的协同作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF(specific pathogen free)级雄性SD大鼠(180~200 g)由广州中医药大学实验动物中心提供,动物生产合格证编号:SCXK(粤)2013-0034。实验动物购回后饲养于中山大学北校区动物实验中心SPF级环境,动物使用许可证编号:SYXK(粤)2016-0112,温度22~24℃,相对湿度50%~70%。
1.1.2 实验试剂
受试药物丹参酮ⅡA由中山大学药学院药物化学研究室古练权教授提供;阿托伐他汀钙(立普妥,LipitorTM)源自辉瑞制药有限公司(美国);0.9%氯化钠注射液源自四川科伦药业股份有限公司;维生素D3注射液购自上海通用药业股份有限公司;羧甲基纤维素钠源自天津市大茂化学试剂厂;甲醛、NaCl、NaHCO3、KCl、KH2PO4、MgSO4、CaCl2和葡萄糖源自广州化学试剂厂;OCT包埋剂购自Sakura公司(美国);防脱载玻片和苏木精-伊红染色试剂盒(H&E试剂盒)购自武汉博士德生物工程有限公司;普通饲料(小麦粉20%、生豆饼10%、玉米粉20%、标准粉36%、食盐4%、蛋壳粉5%、鸡蛋5%)和高脂饲料(普通饲料82.3%、炼猪油10%、糖5%、胆固醇2%、胆盐0.5%、丙基硫脲嘧啶0.2%)均由广东省实验动物中心按标准配方配制。
1.1.3 实验仪器
Pl303电子天平(瑞士梅特勒-托利多集团);LDZ5-2型离心机(北京医用离心机厂);CM1905型冰冻切片机(德国LEICA公司);全自动生化分析仪(日本日立高兴技术公司);IX71-F22FL/PH型倒置显微镜(日本奥林巴斯株式会社);DV500显微数码照相系统(重庆奥特光学仪器有限公司)。
1.2 实验方法
1.2.1 实验分组、造模及给药
SPF级雄性SD大鼠80只,体重180~200 g,适应性喂养1周后随机取10只作为正常对照组,腹腔注射生理盐水2 mL/kg,连续注射4 d,实验期间给予普通饲料喂养。其余70只大鼠连续4 d腹腔注射300 000 IU/(kg·d)维生素D3,实验期间给予高脂饲料喂养,并按照体重均匀分成7组:模型组、丹参酮ⅡA低剂量(7 mg/kg)组、丹参酮ⅡA中剂量(21 mg/kg)组、丹参酮ⅡA高剂量(63 mg/kg)组、阿托伐他汀(7 mg/kg)组、丹参酮ⅡA低剂量(7 mg/kg)+阿托伐他汀(7 mg/kg)组、丹参酮ⅡA中剂量(21 mg/kg)+阿托伐他汀(7 mg/kg)组,每组10只。丹参酮ⅡA和阿托伐他汀用0.5%的羧甲基纤维素钠配制成混悬液,现配现用。各用药组为预防性给药,在喂养高脂饲料的同时每天灌胃给药1次,给药体积为10 mL/(kg·d),连续16周,正常对照组和模型组给予等体积的0.5%的羧甲基纤维素钠。
1.2.2 一般情况观察
每天仔细观察各组动物的一般情况,包括:毛色、状态、活动、饮食情况。每周称量并记录大鼠体重1次。
1.2.3 血脂水平及生化指标的检测
第16周末,禁食12 h,用3%的戊巴比妥钠腹腔注射麻醉大鼠,仰卧位固定于解剖台,剪开腹部皮肤,拨开皮肤与腹腔内组织,暴露下腔静脉。自下腔静脉取血5 mL,收集于5 mL采血管(未包被抗凝剂),在室温下静置待血清析出后,2 600 r/min离心15 min分离血清,分装于1.5 mL EP管中,置于-80℃保存待测。于全自动生化分析仪上检测所得血清中总胆固醇(total cholesterol,TC)、甘油三酯(triacylglycerol,TG)、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)的浓度,并按照如下公式计算动脉硬化指数(atherosclerosis index,AI):动脉硬化指数=(总胆固醇浓度-高密度脂蛋白胆固醇浓度)/高密度脂蛋白胆固醇浓度。
1.2.4 主动脉组织病理学检查
沿胸主动脉往下,分离腹主动脉直至髂动脉分支处,小心去除血管周围的结缔组织及脂肪,用滤纸小心吸干残留血液,置于冻存管中,迅速投入液氮后转入-80℃冰箱保存。将组织进行冰冻切片,并进行苏木精-伊红(hematoxylin and eosin,HE)染色,最后在光学显微镜下镜检(400×)。采用XnView软件计算血管内膜厚度与血管厚度的比值。
1.2.5 统计分析
运用GraphPad Prism软件绘制图表,采用SPSS统计软件对实验数据进行分析处理,结果用平均值±标准误(±sx)表示。采用单因素方差分析(one-way ANOVA)进行各组间数据分析,P<0.05为差异具有显著性。
2 结果
2.1 丹参酮ⅡA联合阿托伐他汀对AS大鼠体重和一般状态的影响
造模后连续16周观察各组大鼠一般情况,结果显示:与正常对照组相比,第1~3周,模型组体重未见明显差异(P>0.05),第4周开始,模型组大鼠体重显著下降(P<0.05);观察期间,各给药组体重较模型组没有明显变化(P>0.05)(图1)。此外,正常对照组大鼠毛色光亮,行为活跃;模型组大鼠从第4周开始,毛色偏黄,行动迟缓;模型组与各给药组之间未见明显差异。

图1 各组大鼠每周体重的变化情况aP<0.05,表示在同一时间点,正常对照组与模型组相比,差异具有统计学意义。Fig.1 The changes of weekly body weight of rats in each groupameans statistically significant(P<0.05),control group vs.model group at the same time point.
2.2 丹参酮ⅡA联合阿托伐他汀对AS大鼠血脂水平及AI的影响
为了确定受试药的降脂功能,我们检测了造模16周大鼠的血脂四项,包括TC、TG、LDL-C、HDL-C。由图2可知,与模型组大鼠相比,阿托伐他汀能明显降低血清中TC、LDL-C含量(P<0.01);丹参酮ⅡA虽能轻度降低大鼠血清TC、TG和LDL-C含量,升高HDL-C含量,但差异不显著(P>0.05);联合用药组均能大幅降低血清中TC、TG、LDL-C含量(P<0.01),且效果有优于阿托伐他汀组的趋势,其中,中剂量的联合用药组降低血清中TC、TG、LDL-C的幅度最大。进一步分析各组大鼠的AI值,结果显示:造模后的大鼠AI值显著增高(P<0.01)(图3)。与模型组相比,丹参酮ⅡA低、高剂量组虽能降低AI,但未形成显著性差异(P>0.05);阿托伐他汀和联合用药组均能显著降低AI(P<0.01),且联合用药组的AI均较阿托伐他汀组低(图3)。以上信息提示,丹参酮ⅡA具有增强阿托伐他汀降低血液中TC、TG、LDL-C及AI的功能。

图2 丹参酮ⅡA联合阿托伐他汀对AS大鼠血清TC、TG、HDL-C及LDL-C的影响##:P<0.01 vs.正常对照组;*:P<0.05,**:P<0.01 vs.模型组。Fig.2 Effects of tanshinone ⅡA combined with atorvastatin on serum TC,TG,HDL-C and LDL-C concentrations in AS rats##:P<0.01,compared with control group;*:P<0.05,**:P<0.01,compared with model group.
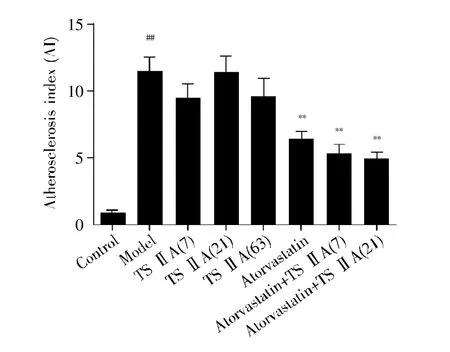
图3 丹参酮ⅡA联合阿托伐他汀对大鼠AI指数的影响##:P<0.01 vs.正常对照组;*:P<0.05,**:P<0.01 vs.模型组。Fig.3 Effects of tanshinone ⅡA combined with atorvastatin on AI in rats##:P<0.01,compared with control group;*:P<0.05,**:P<0.01,compared with model group.
2.3 丹参酮ⅡA联合阿托伐他汀对AS大鼠主动脉结构的影响
尽管血脂水平是评估AS模型是否成功的首要因素,但是最终判断还是基于病理形态和功能改变。我们通过光学显微镜检查了各组大鼠腹主动脉组织的病理形态,结果显示:正常对照组血管内膜为单层扁平状内皮细胞,完整、均匀且平坦,血管中膜平滑肌细胞排列整齐、紧密、层次清晰。与正常对照组相比,模型组明显可见内膜大面积增厚,血管壁向官腔内突出,内有泡沫细胞、坏死组织和胆固醇结晶等物质,钙化和纤维化明显,同时血管中膜平滑肌细胞增生、排列紊乱,并向血管内膜迁移,形成早期AS病变。与模型组相比,各给药组均能够显著抑制血管内膜增厚,减少血管内膜下脂质沉积,减轻血管钙化程度,减少平滑肌纤维断裂并改善其排列紊乱;其中,联合用药组内皮细胞少量缺失,血管内膜增厚不明显,血管中膜平滑肌细胞轻度增生,排列较为整齐,病理改变明显轻于其他各给药组及模型组。各组主动脉组织病理形态证实,维生素D3合并高脂饲料喂养成功建立大鼠AS模型,丹参酮ⅡA与阿托伐他汀联合用药对大鼠AS形成有明显的抑制作用,且联合用药优于单独用药。
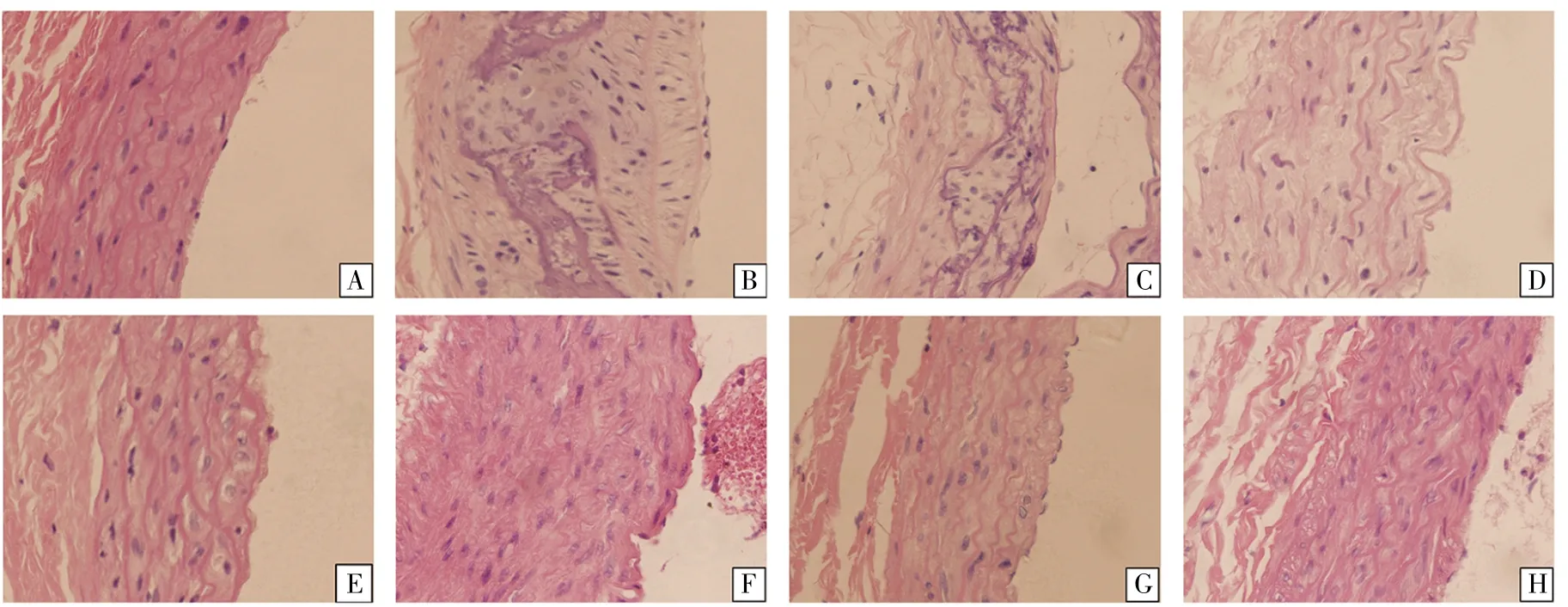
图4 各组大鼠腹主动脉病理组织学切片代表照片(HE染色,400×)A.正常对照组;B.模型组;C.丹参酮ⅡA低剂量组;D.丹参酮ⅡA中剂量组;E.丹参酮ⅡA高剂量组;F.阿托伐他汀组;G.丹参酮ⅡA低剂量+阿托伐他汀组;H.丹参酮ⅡA中剂量+阿托伐他汀组。Fig.4 Pathological sections of abdominal aorta of rats in each group(HE,400×)A.Control group;B.Model group;C.Low-dose tanshinone ⅡA group;D.Medium-dose tanshinone ⅡA group;E.High-dose tanshinone ⅡA group;F.Atorvastatin group;G.Low-dose tanshinone ⅡA+atorvastatin group;H.Medium-dose tanshinone ⅡA+atorvastatin group.
为了进一步探究受试药对AS大鼠腹主动脉的保护作用,我们计算了血管内膜厚度与血管厚度的比值。结果如图5所示,模型组血管内膜厚度与血管厚度的比值明显增大,说明模型组血管内膜增厚严重;各给药组均能降低这一比值,其中丹参酮ⅡA高剂量、阿托伐他汀及联合用药组均能显著减轻血管内膜增厚(P<0.01);两联合用药组较单用丹参酮ⅡA低、中剂量组显著降低血管内膜厚度与血管厚度的比值(P<0.01),且中剂量的联合用药组较丹参酮ⅡA高剂量及阿托伐他汀组作用更显著(P<0.01)。这提示,相比丹参酮ⅡA和阿托伐他汀单独用药,联合用药能更有效地抑制血管内膜增厚,抗AS作用更强。

图5 丹参酮ⅡA联合阿托伐他汀对AS大鼠血管内膜厚度与血管厚度比值的影响##:P<0.01 vs.正常对照组;*:P<0.05,**:P<0.01 vs.模型组。Fig.5 Effects of tanshinone ⅡA combined with atorvastatin on vascular intima thickness/vascular thickness ratio in AS rats##:P<0.01,compared with control group;*:P<0.05,**:P<0.01,compared with model group.
3 讨论
阿托伐他汀是临床上治疗AS常用的口服降脂药物。然而,阿托伐他汀导致的糖代谢异常、肝毒性以及肌肉相关副作用,限制了其临床上的广泛使用[20]。此外,阿托伐他汀作为单药治疗严重高血脂的AS患者时,并不能达到理想的降脂效果[4]。AS的发展受多种复杂机制的调节,联合治疗可能更有效。近年来,在一些临床试验中,阿托伐他汀常与其他药物联用治疗AS,其中包括:1)非他汀类的降脂药物,如贝特类、烟酸、依折麦布、PCSK9抑制剂[4];2)抗高血压药物,如培哚普利、氨氯地平[8];3)抗糖尿病药物,如吡格列酮[9];4)抗血小板药物,如阿司匹林[10]。但相关报道显示,阿托伐他汀与非他汀类药物的联合降脂疗法存在治疗不全面、潜在的副作用以及成本效益不佳等问题[11~13,21]。丹参酮ⅡA作为天然心脏保护剂,具有抗炎、抗氧化、抗血小板聚集及免疫调节等药理作用[22]。本研究发现,丹参酮ⅡA联合阿托伐他汀较单独用丹参酮ⅡA或阿托他汀能够更加有效降低TC、TG和LDL-C水平,并进一步改善AS大鼠主动脉病变。我们的研究结果支持丹参酮ⅡA联合阿托伐他汀治疗AS,这可能为心脑血管疾病的治疗提供了一种新的策略。
脂质代谢紊乱是促进AS发生与发展的重要原因,过量的胆固醇摄入导致动脉内脂质积聚和斑块形成[23]。本研究通过连续4 d腹腔注射维生素D3并配合高脂饲料喂养,建立AS大鼠模型。造模后的第4周,模型组大鼠体重显著低于正常对照组(P<0.05),而各给药组大鼠的体重较模型组无明显变化(图1)。既往的类似研究也发现,维生素D3联合高脂饲料制备的AS大鼠体重下降明显[24~25]。这可能是由于注射大剂量的钙诱导剂维生素D3对大鼠机体损伤较大,使得体重增长减缓[26]。在本研究中,造模16周的模型组大鼠血清中TC、TG和LDL-C水平明显增加(P<0.01),而丹参酮ⅡA各剂量组对这些指标无明显影响(图2),这与以往的研究[27]相一致;阿托伐他汀能够显著降低血清中TC、LDL-C水平(P<0.01)(图2),这符合阿托伐他汀抑制3-羟基-3-甲基戊二酰辅酶A还原酶的药理特性[28]。此外,本研究发现,低、中剂量的丹参酮ⅡA联合阿托伐他汀能够更有效地降低血清TC和LDL-C水平,并且明显降低血清TG水平(P<0.01)(图2),这提示丹参酮ⅡA能增强阿托伐他汀的降脂功能。AI指数是国际医学界制定的一个衡量动脉硬化程度的指标[29]。文中实验结果显示,丹参酮ⅡA单用虽未对AI产生显著影响,但与阿托伐他汀联用后能增强阿托伐他汀的作用(图3)。相关临床试验也表明,丹参酮ⅡA辅助治疗相较单独使用阿托伐他汀,能够进一步降低冠心病患者血清中超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、白介素-6(interleukin-6,IL-6)和单核细胞趋化因子-1(monocyte chemoattractant protein-1,MCP-1)等炎症标记物的水平,调节血脂水平[30~31]。
越来越多的研究表明,AS是一种复杂的慢性血管疾病,其主要病理特征为动脉内膜脂质沉积、内膜局灶性纤维化增厚和AS斑块形成[32~33]。AS病变始于血管内皮细胞的损伤,这会使血管内膜通透性升高,大量单核细胞黏附在血管内膜,并转化为巨噬细胞,进而吞噬脂蛋白形成泡沫细胞[34]。这些泡沫细胞死亡后,其脂质填充物进入坏死核心,形成脂质条纹,并且积累从血管中膜迁移过来的平滑肌细胞。平滑肌细胞通过分泌纤维物质促进斑块体积增长,同时新的单核细胞不断向损伤的血管壁迁移,并伴随着细胞增殖、细胞外基质产生和积累的脂质填充物,最终导致损伤向外膜蔓延直至临界点[35]。我们通过观察各组大鼠腹主动脉的组织病理学变化发现,模型组血管内膜严重增厚,平滑肌细胞增生、排列紊乱,血管壁形成长条斑块,钙化、纤维化严重;各给药组均能不同程度地抑制血管内膜增厚,减少血管内膜下脂质沉积,减轻血管钙化程度,减少平滑肌纤维断裂并改善其排列紊乱(图4)。进一步的血管内膜厚度与血管厚度的比值分析结果显示,中剂量的联合用药组比丹参酮ⅡA高剂量和阿托伐他汀组更明显地抑制血管内膜增生(图5),这说明,联合用药在降低用药剂量的同时,也增强了治疗效果,可谓一举两得。
当然,本研究也存在一些不足之处。尽管实验结果初步表明,丹参酮ⅡA联合阿托伐他汀在降血脂和抗AS病变方面明显优于单一用药,但丹参酮ⅡA与阿托伐他汀发挥协同作用的具体机制尚不清楚。丹参酮ⅡA的抗氧化和抗炎作用可能是其治疗AS的潜在机制之一。Li等[36]通过细胞共培养模型发现,丹参酮ⅡA能够降低AS相关炎症细胞因子,这与其抑制核因子活化B细胞κ轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cell,NF-κB)信号通路密切相关。Yang等[37]在肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)诱导大鼠内皮祖细胞的研究中发现,丹参酮ⅡA可抑制NF-κB信号通路传导,降低黏附因子的表达。Chen等[38]研究表明,丹参酮ⅡA可通过抑制Toll样受体4(Toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MyD88)/NF-κB信号通路,发挥抗炎和调节免疫反应的作用,以减轻ApoE-/-小鼠斑块病变。另有研究报道,在AS大鼠、兔及ApoE-/-缺陷小鼠中,丹参酮ⅡA可降低脂质过氧化物水平,并通过多个靶点,如细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、NF-κB、过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor gamma,PPARγ)和 microRNA,抑制AS[39]。泡沫细胞的形成是AS病变的初始和关键步骤[40]。Liu等[41]发现,丹参酮ⅡA通过激活抗氧化信号通路核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1),抑制巨噬细胞对脂质的摄取,减少泡沫细胞的形成。我们下一步计划在体内外AS模型中,深入探讨丹参酮ⅡA与阿托伐他汀在激活抗氧化通路Nrf2/HO-1和抑制NF-κB介导的炎症通路中的协同作用。此外,丹参酮ⅡA与阿托伐他汀联用的最佳剂量尚未明确,我们仍需后续的药代动力学实验来确定最佳联用剂量。
总的来说,本研究证明丹参酮ⅡA联合阿托伐他汀具有更强的降脂作用,能够减缓AS的发生与发展。本研究为未来临床上使用丹参酮ⅡA联合阿托伐他汀治疗AS提供了理论基础,但是这种联合疗法改善AS的确切机制未知,需要进一步的研究来揭示其分子机制。