黄芩素对慢性高尿酸小鼠模型心肾功能的影响研究
杨 阳,严采馨,林翠婷,黄清华,张乐琦,郑 强,吴 婷,庞建新*
(1.南方医科大学附属佛山市妇幼保健院,中国广东 佛山 528000;2.南方医科大学药学院,中国广东 广州 510515)
高尿酸血症(hyperuricemia,HUA)是由嘌呤代谢和肾小管重吸收失衡引发的机体尿酸(uric acid,UA)过度积聚[1]。长期HUA是诱发多种并发症以及导致原有疾病恶化的重要因素。临床研究显示,HUA是心肌肥厚发生的风险因素[2]。在合并心脏疾病的风险中,血尿酸水平与心衰的发病风险及死亡结局显著相关[3]。大量文献显示,HUA与慢性肾脏疾病(chronic kidney disease,CKD)的发生与发展密切相关[4~6],而在本就患有CKD的患者中,HUA是导致全因死亡的独立危险因素[7]。《中国高尿酸血症与痛风诊疗指南(2019)》明确指出,降尿酸治疗仍然是HUA的首要处理方案[8]。当前,我国降尿酸药物主要包括以抑制嘌呤代谢为主的别嘌醇(allopurinol,AP)和非布司他,以及以抑制机体对尿酸重吸收为主的苯溴马隆,药物品种供选择性极其有限。而基于当前指南、专家共识以及临床研究数据,在合并其他系统疾病时,可供选择的降尿酸药物范围进一步缩小。
近期,我们发现一种天然产物黄芩素(baicalein,BAL)具有良好的降尿酸效果,其体内效果与经典降尿酸药物AP相似,其作用机理主要是通过抑制尿酸转运相关的尿酸转运体1(urate transporter 1,URAT1)和葡萄糖转运体9(glucose transporter 9,GLUT9)的表达与活性,从而抑制肾小管对尿酸的重吸收,继而起到降尿酸作用[9]。BAL是从双子叶唇形科植物黄芩的干燥根部中提取分离出来的一种黄酮类化合物。在以往的研究中,其由于出色的抗炎、抗氧化能力,被报道在心血管疾病、糖脂代谢紊乱、神经系统疾病中具有良好的调节和保护作用[10~12]。而作为一种有潜力的降尿酸药物,BAL对HUA相关并发症的影响尚未评估。本文使用昆明小鼠,利用氧嗪酸钾联合次黄嘌呤建立连续8周的HUA模型,观察BAL对心脏以及肾脏并发症的影响,以为后期BAL在HUA合并心肾疾病的研究及应用提供有效信息。
1 材料与方法
1.1 实验材料
昆明小鼠,雄性,4~5周龄,体重(20±2)g,购自南方医科大学实验动物管理中心,动物生产许可证号:SCXK(粤)2021-0041,饲养条件:(23±2)℃、相对湿度50%~80%、每天12 h日光灯照射。本研究已通过南方医科大学实验动物伦理委员会批准。氧嗪酸钾(纯度≥98%)、BAL(纯度≥98%)购自上海阿拉丁生化科技股份有限公司;次黄嘌呤(纯度99%)购自上海麦克林生化科技有限公司;AP(纯度98%)购自美国Sigma公司;多聚甲醛固定液(paraformaldehyde,PFA)购自武汉赛维尔生物科技有限公司;尿酸测试试剂盒购自美国BioAssay Systems公司。
1.2 药物配置
所有造模试剂和干预药物均使用0.5%羧甲基纤维素钠(sodium carboxymethyl cellulose,CMCNa)作为溶剂配置。氧嗪酸钾母液的配置浓度为35 mg/mL,次黄嘌呤母液的配置浓度为45 mg/mL,BAL母液的配置浓度为5 mg/mL,AP母液的配置浓度为0.5 mg/mL。所有造模试剂和干预药物在给药前需要超声以使药物均匀分散在溶剂中。
1.3 动物实验和分组
24只昆明小鼠随机分为4组:空白组(Blank)、HUA 模型组(HUA)、BAL 干预组(BAL)、AP 干预组(AP)。每日上午9:00进行药物干预以及造模,药物干预在造模前1 h进行。BAL组给予50 mg/kg BAL灌胃,AP组给予5 mg/kg AP灌胃,空白组和HUA组给予等体积CMC-Na溶剂。造模过程中,除空白对照组外,所有动物给予350 mg/kg氧嗪酸钾腹腔注射以及450 mg/kg次黄嘌呤灌胃,空白组给予等体积CMC-Na溶剂。连续8周后进行多普勒超声,分析心脏功能,随后使用颈椎脱臼的方法处死小鼠,取血液和相关组织进行后续分析。
1.4 心脏多普勒超声分析
所有小鼠于8周给药周期结束后行多普勒超声检查。超声前,小鼠禁食不禁水8 h,使用剃毛刀剔除前胸鼠毛,提前10 min腹腔注射45 mg/kg戊巴比妥麻醉小鼠。在短轴模式下测量舒张期和收缩期的左心室前壁厚度(left ventricular anterior wall,LVAW)、左心室后壁厚度(left ventricular posterior wall,LVPW)以及左心室内径(left ventricular internal diameter,LVID)。
1.5 血浆分离及尿酸浓度测定
所有小鼠于处死前从眼眶后静脉丛采血,血液采集至1.5 mL肝素钠预浸润过的离心管中,使用3 000g离心力于4℃离心10 min,分离上清。上清液中的尿酸浓度使用尿酸测试试剂盒测定。根据试剂盒说明书,使用96孔板,样品孔中每孔加入2 μL的血清样品以及200 μL的混合测试液,对照孔中加入2 μL空白溶液、10 mg/dL的尿酸标准溶液以及200 μL的混合测试液,使用外标法对尿酸浓度进行计算。
1.6 组织固定及病理分析
小鼠处死后,分离心脏和肾脏组织,称重后迅速转移至预先装有4%PFA的离心管中,固定48 h后进行石蜡包埋。将包埋组织切成4 μm厚的薄片进行苏木精-伊红(hematoxylin-eosin,HE)染色和马松(Masson)染色,使用蔡司显微镜明场成像模式下拍摄成像。
1.7 统计学处理
所有柱状图采用GraphPad Prism 8.0绘制,数据结果表示为平均值±标准差(±s)。多组间比较采用单因素方差分析,P≤0.05为差异具有统计学意义。与空白组相比的显著性分析结果使用#表示,#:P≤0.05;##:P≤0.01;###:P≤0.001。与模型组相比的显著性分析结果使用*表示,*:P≤0.05;**:P≤0.01;***:P≤0.001。ns:P>0.05,无显著性差异。
2 结果
2.1 BAL降低HUA小鼠的尿酸水平
在之前的研究中,我们虽然发现BAL具有一定的降尿酸作用,但是其长期降尿酸效果并未考察。在本实验中,我们在连续干预及造模后,分别检测第2周短期和第8周长期用药后血浆中的尿酸浓度,结果表明,在第2周时,BAL表现出良好的降尿酸效果,与HUA组呈现出显著性差异,与阳性药物AP的趋势一致(图1A);在第8周时,BAL组依然呈现出降尿酸作用,其作用趋势亦与AP一致,但由于长期实验的个体性差异,其与HUA组无显著性差别(图1B)。这说明BAL在短期和长期使用过程中均具有降尿酸作用。
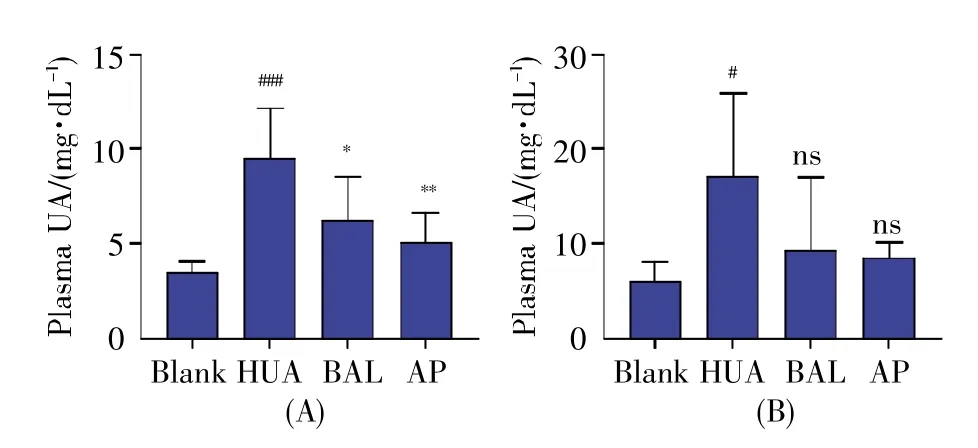
图1 BAL对血浆尿酸浓度的影响(A)造模及给药干预2周末时的血浆尿酸浓度;(B)造模及给药干预8周末时的血浆尿酸浓度。Fig.1 The influence of BAL on the concentration of plasma uric acid(A)The plasma uric acid concentration after 2-week modeling and pharmacological intervention;(B)The plasma uric acid concentration after 8-week modeling and pharmacological intervention.
2.2 BAL改善HUA造成的小鼠心功能下降
HUA是心肌肥厚、心衰发生和不良结局的重要危险因素。在8周干预及造模结束时,我们使用多普勒超声对左心室进行检测(图2A)。统计学结果表明,BAL能够显著性改善HUA诱导的舒张期左室前壁增厚(图2B),对收缩期左室前壁增厚轻微改善但无显著性意义(图2C),减少舒张期左室后壁厚度(图2D),对收缩期左室后壁厚度无显著性影响(图2E),改善由室壁增厚引起的舒张期左心室内径减少(图2F),对收缩期左心室内径几乎无影响(图2G)。BAL对心功能的作用与阳性药物AP一致。这说明,BAL可以改善长期HUA引起的舒张期心室壁增厚,从而改善心功能。

图2 BAL对多普勒心超参数的影响(A)M超代表图像;(B)舒张期左室前壁厚度;(C)收缩期左室前壁厚度;(D)舒张期左室后壁厚度;(E)收缩期左室后壁厚度;(F)舒张期左室内径;(G)收缩期左室内径。Fig.2 The influence of BAL on Doppler echocardiographic parameters(A)The representative M-mode images;(B)LVAW in diastolic stage;(C)LVAW in systolic stage;(D)LVPW in diastolic stage;(E)LVPW in systolic stage;(F)LVID in diastolic stage;(G)LVID in systolic stage.
2.3 BAL改善HUA造成的小鼠心肌病理改变
为了进一步验证BAL对HUA小鼠心脏的影响,对各组处死后的小鼠心脏进行病理染色并拍照。HE染色结果显示,相对于空白组,HUA模型组小鼠心肌细胞肥大且排列紊乱,细胞核深染(图3A)。Masson染色结果显示,相对于空白组,HUA模型组小鼠存在明显的间质纤维化现象(图3B)。而BAL干预可以明显改善以上病理改变,其改善作用与阳性药物AP一致。这说明BAL可以改善长期HUA引起的心肌病理改变。

图3 BAL对HUA诱导心肌病理的改善(A)HE染色;(B)Masson染色。标尺=20 μm。Fig.3 The ameliorative effect of BAL on HUA induced myocardial histopathological changes(A)HE staining;(B)Masson staining.Scale bar=20 μm.
2.4 BAL无法改善HUA引起的小鼠肾功能变化
慢性肾病是HUA最常见的并发症,我们在处死小鼠后以肾体比初步评估了BAL对HUA下肾脏的影响。结果显示,BAL无法改善HUA诱导的肾体比升高,甚至有略微升高的趋势,这与阳性药物AP的趋势相反(图4A)。我们进一步检测了血清中肌酐和尿素的水平,结果显示,各组肌酐水平变化不明显(图4B);在血清尿素的改变上,由于个体差异过大,整体无显著性意义,但阳性药物AP显示出降低尿素的趋势,BAL的这种趋势不明显(图4C)。这说明BAL可能对长期HUA引起的肾脏损伤无效。

图4 BAL对HUA下肾功能的影响(A)肾体比;(B)血清肌酐水平;(C)血清尿素水平。Fig.4 The influence of BAL on renal function(A)The ratio of kidney mass(KW)to body weight(BW);(B)The serum creatinine levels;(C)The serum urea levels.
2.5 BAL无法改善HUA引起的小鼠肾脏病理变化
在进一步的研究中,我们采用HE染色对小鼠肾脏进行了病理学观察。结果显示,相对于空白组,HUA模型组中肾小球出现基膜增厚,而BAL处理组并未缓解这一现象,阳性药物AP处理组改善了这一现象(图5A)。在肾小管中,空白组和AP组均显示出良好的管型和排列,而HUA和BAL组则表现为色泽发白、肾小管扩张、颗粒状变性,并出现蛋白管型和红细胞管型(图5B)。这进一步说明,BAL对长期HUA引起的肾脏损伤无效。
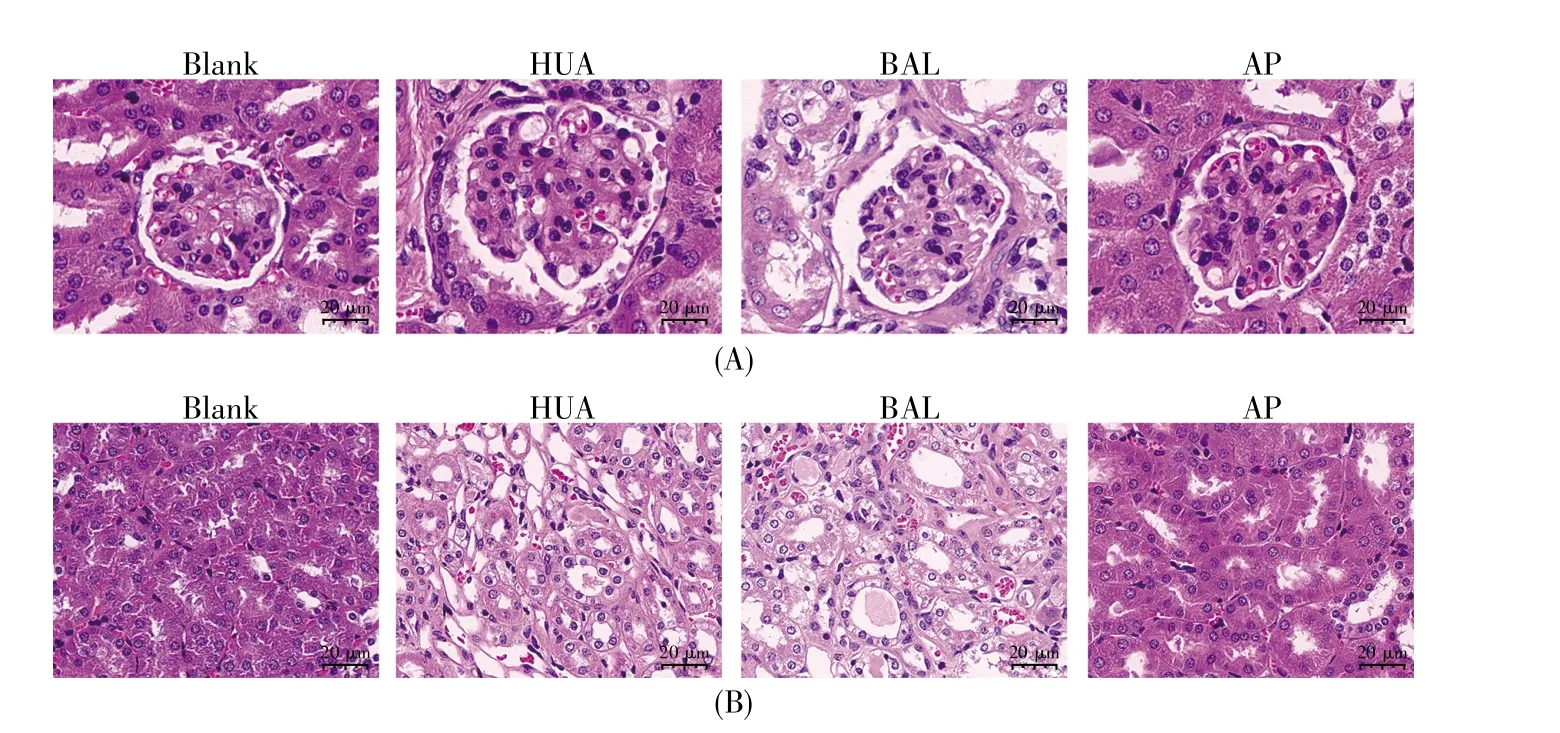
图5 BAL对HUA下肾脏病理的影响(A)肾小球HE染色;(B)肾小管HE染色。标尺=20 μm。Fig.5 The influence of BAL on kidney histopathological changes(A)HE staining of glomeruli;(B)HE staining of renal tubules.Scale bar=20 μm.
3 讨论
随着生活水平的提高,我国HUA的发病率在不同人群中呈现出逐年升高的趋势[13~15]。大量HUA患者本身合并有其他器质性疾病,且HUA本身亦可导致多种并发症的发生及恶化。因此,临床选择降尿酸药物需同时兼顾其对并发症的影响。心脏和肾脏疾病是HUA的常见并发症。临床数据显示,血清尿酸每增加1 mg/dL,心衰发生率增加19%,同时,心衰患者死亡率增加4%[3];肾功能损伤风险增加7%至11%[16]。我国常用降尿酸药物的种类极其有限,包括黄嘌呤氧化酶抑制剂AP、非布司他以及尿酸转运体抑制剂苯溴马隆。而且,《中国高尿酸血症与痛风诊疗指南(2019)》明确说明,上述药物在合并一些并发症时是限制使用的,如AP禁用于CKD 5期;非布司他慎用于合并心脑血管疾病的老年人;苯溴马隆禁用于肾结石患者,慎用于合并慢性肝病患者[8]。故对于本就合并心脏或肾脏疾病的患者,降尿酸药物的可供选择性进一步降低。我们前期通过对传统中药的挖掘发现,BAL具有体内降尿酸的效果[9]。本研究以昆明小鼠为研究对象,使用氧嗪酸钾和次黄嘌呤联合造模构建长期慢性HUA模型,进一步考察了长期使用BAL对心脏和肾脏的影响。
2021年发表于Cardiology Journal的专家共识指出,仅推荐AP为HUA合并心血管疾病的一线降尿酸治疗药物[17],这与当前临床试验中非布司他的心血管毒性的争议性[18~19],以及苯溴马隆在治疗HUA合并心衰患者中血流动力学改善效果不佳[20]相关。2018年发表在The New England Journal of Medicine的大型随机对照研究表明,相对于AP,使用非布司他降尿酸的全因死亡及心血管死亡率均显著上升[18],而2021年发表于Lancet的研究结果并不支持这一结论,其指出非布司他心血管不良事件的发生不劣于AP[19]。在一项包含82例HUA合并慢性心衰患者的研究中,苯溴马隆虽然可以显著性降低血清尿酸水平,但并未改善HUA合并慢性心衰患者的脑钠肽、左室射血分数以及心肌室壁厚度[20]。在我们的研究中,BAL能够有效改善心功能,减轻重构导致的左室壁肥厚现象,其作用效果与阳性药物AP相当,这为HUA合并心脏疾病的降尿酸策略提供了新的选择。
心肌细胞内的尿酸来源于黄嘌呤氧化酶(xanthine oxidase,XO)介导的嘌呤代谢以及细胞膜上转运体介导的胞外向胞质内转运。我们前期研究表明,BAL可以降低XO活性,以及下调尿酸转运体URAT1、GLUT9的基因和蛋白质表达水平[9]。研究显示,尿酸对心肌细胞的损伤机制主要基于活性氧(reactive oxygen species,ROS)相关的胰岛素抵抗以及内质网应激[21~22]。而BAL作为黄酮类化合物,具有良好的抗氧化作用。在异丙肾上腺素以及脂多糖引起的心肌肥厚中,BAL通过改善炎症减少ROS诱导的氧化应激,从而改善心肌状态[12,23]。我们前期的研究结果显示,BAL可以有效改善HUA诱导的心肌炎症因子聚集,以及间质纤维化现象,其作用机制可能归因于4点:降尿酸作用[9];抑制XO从而减少胞内尿酸生成[24];下调URAT1和GLUT9从而降低胞外尿酸的摄取[9];抗氧化作用从而减少ROS生成[12]。
CKD是HUA最常见的并发症。肾脏负责约70%尿酸的排泄,大量尿酸通过肾小管重吸收至体内继续循环[25]。流行病学数据显示,在无HUA的情况下,男性CKD的患病率为3.1%,女性为3.6%,而在HUA的情况下,男性CKD的患病率为9.5%,女性为19.6%[26]。肾小管内尿酸过量引起的上皮细胞炎性反应和氧化应激,以及尿酸结晶,是HUA导致肾脏损伤的病理基础[27~28]。本研究显示,BAL可以加重HUA诱导的肾脏损伤,与单纯的XO抑制剂AP形成鲜明对比。我们前期研究显示,BAL可以抑制肾脏中尿酸转运体水平的上升,降低血尿酸的同时升高尿液中尿酸的浓度[9]。这说明BAL降尿酸的作用机制在于减少肾小管对尿酸的重吸收,而肾小管内长期高浓度的尿酸刺激正是CKD发生以及发展的重要因素。具有类似尿酸转运体抑制功能的药物苯溴马隆,在临床实际应用中曾被报道可促进尿酸性结石形成,从而导致急性肾损伤[29];另一个未在中国上市的尿酸转运体抑制剂lesinurad,也被报道在临床中可以导致肾脏相关不良事件的发生[30]。以往研究提示,在使用尿酸转运体抑制剂时,合并碳酸氢钠等制剂碱化尿液可以通过减少尿酸结晶形成改善肾损伤[29,31],这一方法亦可借鉴于未来BAL的使用。
综上所述,BAL作为降尿酸药物长期使用时,对尿酸引起的心肌损伤及心室重构现象是有改善作用的,但是会加重HUA诱导的肾脏损伤,在未来合并相应并发症的药物研究和应用中应予以注意。