稳定表达ABCG2细胞模型的建立及其在筛选ABCG2抑制剂中的应用
郑凤欣,赵泽安,林雪曼,吴 婷 ,庞建新
(南方医科大学药学院,中国广东 广州 510515)
高尿酸血症(hyperuricemia,HUA)是继高血压、高血糖、高血脂之后的人类又一代谢性疾病[1],其发病率呈逐年递增的趋势。高尿酸血症的主要病因是体内尿酸生成过多或排泄不足而导致的体内血液尿酸水平增高,严重者会引发痛风。人体血液中的尿酸有大约70%经尿液排泄,30%经粪便排泄。尿酸转运体在维持人体尿酸平衡中发挥着重要作用,主要包括重吸收转运体尿酸盐阴离子转运体 1(urate anion transporter 1,URAT1)[2]、葡萄糖转运体 9(glucose transporter 9,GLUT9)[3]、有机阴离子转运体4(organic anion transporter,OAT4)[4],以及尿酸外排转运体OAT1/3[5]、ATP结合盒转运蛋白2(ATP binding cassette subfamily G member 2,ABCG2)[6]等。
ABCG2是ABC转运蛋白超家族的成员,其最早被称为乳腺癌耐药蛋白4(breast cancer resistance protein 4,BCRP4)[7],在乳腺癌细胞[8]中首次被发现。该蛋白质被认为是乳腺癌细胞获得多药耐药(multidrug resistance,MDR)的原因[9]。研究发现,ABCG2不仅在癌组织中表达,如肝癌、肺癌等[10],在许多正常组织(如小肠和肾)中也高度表达[11]。此外,有研究报道,ABCG2也是维持体内尿酸稳态的重要转运体[6],负责将尿酸经肾脏与肠道排出体外[12~14]。
目前,降尿酸药物的开发主要以选择性抑制URAT1[15]为主,但由于各转运体之间同源性较高且结构高度相似,URAT1抑制剂难免会对外排转运体如ABCG2、OAT1/3产生抑制作用。因此,评价化合物对各尿酸转运体的选择性至关重要。对于尿酸外排转运体而言,直接通过细胞进行14C-尿酸摄取实验是很难的。例如:评价化合物对OAT1/3的抑制活性时,常采用3H-PAH[16]或荧光底物6-CFL[17]进行吸收摄取实验,但考虑到尿酸与其他底物的结合位点可能不同,评价结果很难真实反映化合物抑制转运体转运尿酸的能力。
我们课题组之前已经建立了成熟的URAT1[18]、GLUT9[19]及OAT1[20]抑制剂筛选体系,出于对降尿酸药物选择性全面评价的考虑,ABCG2抑制剂的筛选体系的构建也极为重要。本研究采用制备囊泡的方法建立ABCG2抑制剂的体外筛选模型。囊泡转运实验是一种成熟的体外方法,用于定量评估ABC转运蛋白的功能[21]。囊泡作为一个单独的细胞结构,可在ATP存在的情况下发挥转运功能。过表达ABCG2的细胞膜囊泡进行14C-尿酸摄取的具体过程为:嵌在膜外的ABCG2接触ATP后可进行尿酸转运,而囊泡内侧ABCG2由于不接触ATP无法转运尿酸,这解决了ABCG2转运尿酸的方向问题,该方法可直接评价抑制剂对ABCG2转运尿酸能力的影响。
本文在其他已报道的ABCG2筛选模型[22~23]上加以改进,避免了繁琐的破碎、分离、提取步骤(图1)。我们在制备囊泡过程中采用柱式离心法提取膜蛋白及细胞器:细胞高速通过Z字形离心管柱时细胞膜会破裂释放出核,由此滤去细胞核,得到不含有核膜和核蛋白污染的膜蛋白,再经超高速离心得到膜囊泡。本方法通过固定起始样品量、离心力和离心时间,就能得到一致性较好的结果,制备过程在2 h内即可完成。此外,在囊泡摄取14C-尿酸实验中,采用0.45 μm超滤管快速离心回收囊泡,相比于传统滤纸收集的方式[22],时间短且操作误差更小。

图1 ABCG2囊泡制备(A)及抑制剂筛选(B)流程Fig.1 Procedures of ABCG2 membrane vesicle preparation(A)and inhibitor screening(B)
本研究所构建的体外筛选模型,为ABCG2抑制剂的筛选提供了有力工具,对降尿酸药物选择性评价具有重要意义。此外,我们利用该模型评价了部分URAT1抑制剂的ABCG2抑制能力,发现RDEA3170具有潜在ABCG2抑制作用,为RDEA3170在临床上的应用提示了新的机会与风险。
1 材料与方法
1.1 实验材料
HEK293细胞(本实验室保存);表达载体pc-DNA3.1(+)(长沙优泽生物科技有限公司);ABCG2的cDNA序列(NCBI数据库编号:NM_001257386.2,上海生工生物工程股份有限公司合成);大肠杆菌DH5α(北京全式金生物技术有限公司);质粒提取试剂盒、胶回收试剂盒(Omega公司,美国);RNA提取试剂盒(成都福际生物科技有限公司);BCA蛋白质定量试剂盒、羊抗兔IgG二抗(杭州弗德生物科技有限公司);ABCG2一抗(杭州华安生物技术有限公司);GAPDH一抗(SAB公司,美国);血清/DM-EM高糖基础培养基(C11995500BT)、胰蛋白酶(Gibco公司,美国);转染试剂Lipofectamine 3000(Invitrogen公司,美国);ATP、AMP(北京酷来博科技有限公司);维立诺雷(RDEA3170,纯度>98%,北京华威锐科化工有限公司,结构式如图2所示);苯溴马隆、丙磺舒、别嘌醇(纯度>98%,美国Sigma公司,结构式如图2所示);14C-尿酸(ARC公司,美国)。

图2 降尿酸药物苯溴马隆、丙磺舒、别嘌醇及维立诺雷的结构式Fig.2 Chemical structures of urate lowering drugs benzbromarone,probenecid,allopurinol and verinurad
Z型离心柱(北京英文特生物技术有限公司);0.45 μm超滤管(Millipore公司,美国);小型离心机5415D(Eppendorf公司,德国);超高速离心机(A-vanti JXN-26,美国贝克曼公司);高通量实时荧光定量PCR仪(LC480,美国罗氏公司);液体闪烁计数仪(MicroBeta 2450 Microplate Counter,美国PerkinElmer公司)。
1.2 细胞培养
HEK293细胞在37℃、5% CO2饱和湿度下,使用含DMEM高糖培养基、10%胎牛血清(fetal bovine serum,FBS)和青霉素-链霉素双抗的培养液进行培养。
1.3 pcDNA3.1(+)-ABCG2载体构建
从NCBI数据库检索出ABCG2的cDNA序列,用Primer软件设计引物序列:正向,5′-GGCCCTCTAGACTCGAGGCCACCATGTCTTCCAGTAATGTCG-3′;反向,5′-TGTTATTTCTTAAAAAATATTCTAAAAGCTTAAG-3′。在ABCG2序列的两端引入XhoⅠ和HindⅢ两个限制性酶切位点,以cDNA为模板扩增ABCG2的全长编码序列(全长1 965 bp)。PCR扩增程序:95℃预变性;94℃变性30 s、58℃退火 30 s、72℃延伸3 min,共进行35次循环;末次循环后在72℃延伸补全10 min,得到扩增产物(现用或-20℃保存)。用Omega胶回收试剂盒回收纯化的PCR产物。
将上一步回收的PCR产物与pcDNA3.1(+)空载体用XhoⅠ和HindⅢ在37℃双酶切12 h,将线性化的载体与ABCG2目的片段用T4连接酶按如下连接体系于4℃连接过夜(12 h)后提取质粒:2 μL T4 DNA ligase buffer、1 μL T4 DNA 连接酶、2 μL纯化的PCR扩增产物和8.5 μL的pcD-NA3.1(+)载体,用 6.5 μL 去离子水补齐至 20 μL。
取100 ng上一步的连接产物至冰上溶解的50 μL DH5α感受态中孵育30 min,随后放在水浴锅中42℃热激45 s,立即置于冰上孵育2 min后,加入500 μL无抗LB培养基,在摇床上以200 r/min的速度培养1 h。将菌液涂在含有氨苄青霉素的LB固体培养基上37℃过夜培养,次日挑取单克隆摇菌并提取质粒测序,得到最终质粒pcDNA3.1(+)-ABCG2。取5 μL构建好的pcDNA-3.1(+)-ABCG2质粒,用XhoⅠ和HindⅢ双酶切后进行电泳鉴定。电泳条件:80 V、50 mA,约40 min后停止电泳,用凝胶成像仪观察结果。
1.4 HEK293-ABCG2稳转株构建
将HEK293细胞传至6孔板,待细胞密度汇合到70%~80%,按照每孔2 500 ng将pcDNA3.1(+)-ABCG2质粒使用脂质体Lipofectamine 3000瞬转到细胞中,设置1组空白对照组(转染空载质粒组,HEK293-mock)。转染24 h后,将细胞消化重悬,按照1∶8传代至12孔板,待汇合度为50%~70%时,在培养基中加入终质量浓度为600 μg/mL的G418抗生素进行筛选(血清体积浓度为10%),每隔2 d换液。7~10 d后,加大血清体积浓度至20%,继续筛选14 d。将细胞消化并计数,采用有限稀释法挑选单克隆细胞进行扩增培养。具体操作:将细胞稀释为每毫升50~60个,于96孔培养板中每孔加0.1 mL(每孔5~6个细胞);剩余细胞悬液作倍比稀释,直至每孔含1~2个细胞;待细胞贴壁后,降低G418质量浓度至300 μg/mL(20%FBS),继续培养扩增;待细胞长满后消化接种到24孔板,G418增加到600 μg/mL;待细胞数足够多后,FBS降为10%,继续扩大培养至细胞密度为90%。采用实时荧光定量PCR(qRT-PCR)及Western-blot方法对稳转株进行鉴定。
1.5 ABCG2囊泡的制备
将HEK293-ABCG2稳转株接种到10 cm细胞培养皿中,待其长满后加入磷酸缓冲盐溶液(phosphate buffer saline,PBS)吹悬,3 000g离心1 min,收集细胞沉淀,用TS缓冲液(10 mmol/L Tris-Hepes,250 mmol/L蔗糖,pH=7.4)溶解,将细胞加入到Z型离心管,16 000g离心30 s,弃去离心管柱,振荡涡旋10 s重悬细胞。用小型离心机以700g离心1 min(沉淀是完整的细胞核)。将上清转移到新的1.5 mL离心管中,4℃下以16 000g离心30 min,弃去上清(上清为胞浆组份),保存沉淀(沉淀为总膜蛋白组份,包括细胞器和质膜)。TS缓冲液重悬后,用低温超高速离心机在4℃条件下以100 000g离心60 min,再用25号针管反复吹吸30~50次。制备好的囊泡存放在-80℃备用。
1.6 ABCG2摄取14C-尿酸实验
为了验证过表达ABCG2囊泡的14C-尿酸摄取功能,向过表达及未过表达ABCG2的囊泡中分别加入ATP或AMP孵育15 min,随后加入20 μmol/L的14C-尿酸分别摄取 5 min、10 min、15 min、20 min、30 min,拟合ABCG2摄取14C-尿酸的时效曲线。向囊泡中加入 5 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L的14C-尿酸吸收15 min,拟合ABCG2摄取14C-尿酸的量效曲线。
为了评价化合物对ABCG2摄取14C-尿酸的抑制能力,将14C-尿酸加入50 μL膜囊泡混合物中(终浓度为20 μmol/L)。给药组加入不同浓度抑制剂(空白组与模型组不加抑制剂),在37℃下孵育30 min,使抑制剂与ABCG2完全结合。再加入终浓度为4 mmol/L的ATP(空白组加入AMP作为背景对照,模型组与给药组加入ATP)开始反应,15 min后立即加入200 μL的冰冷DPBS缓冲液停止反应。将溶液加入0.45 μm超滤管,立即以3 000g快速离心20 s,重复两次(离心洗掉囊泡外尿酸溶液)。将沉淀取出后放入离心管内,加入200 μL 0.1 mol/L NaOH,使囊泡溶解,释放囊泡内尿酸,此时的尿酸即为ABCG2摄取的尿酸。加入0.5 mL闪烁剂后涡旋振荡,使闪烁液与同位素充分混匀,随后转移到24孔板内,用液体闪烁计数仪(PerkinElmer,Boston,MA)测定每分钟的放射值CPM,并计算化合物抑制率。抑制率(%)=[1-(给药组CPM-空白组CPM)/(模型组CPM-空白组)]×100%。
1.7 qRT-PCR法检测mRNA表达
将HEK293-ABCG2细胞及HEK293-mock细胞接种到6孔板中,待细胞长满后采用RNA提取试剂盒按照说明提取细胞总RNA。用SuperScript Ⅲ逆转录酶(Invitrogen,美国)反转录1 μg RNA,以10 μL的体系合成cDNA模板。以βactin为内参,将cDNA稀释5倍后用于定量PCR,结果采用2-ΔΔCt法进行计算。本研究使用的qRTPCR引物序列见表1。
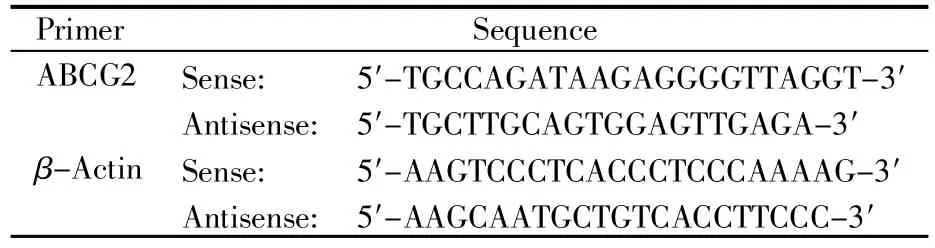
表1 实时荧光定量PCR引物序列Table 1 Primers used for real-time quantitative PCR analysis
1.8 Western-blot检测ABCG2蛋白表达
将HEK293-ABCG2细胞及HEK293-mock细胞接种到6 cm细胞培养皿中,待细胞长满后吸弃培养基,加入120 μL RIPA裂解液冰上裂解30 min,期间涡旋振荡数次,13 000g离心后取上清。取20 μL上清,用BCA蛋白质定量试剂盒定量,加入5×上样缓冲液,在95℃下金属浴5 min制得蛋白质样品。
按每孔20 μg取前述蛋白质样品进行电泳(浓缩胶浓度为5%,分离胶浓度为10%;电压条件为浓缩胶:80 V、20 min,分离胶:120 V、80 min)。电泳完毕后将凝胶中的蛋白质采用湿转法转移至0.45 μm的PVDF膜上,转膜条件为100 V、80 min。用5%脱脂牛奶封闭1 h,加入相应的一抗(ABCG2一抗稀释比例1∶1 000,GAPDH一抗稀释比例1∶1 000),在4℃孵育过夜;次日用含有0.1%吐温20的TBST缓冲液洗膜3次(每次10 min),随后室温孵育羊抗兔酶标二抗(稀释比例1∶5 000)1 h;用TBST洗膜6次(每次5 min)后,加入化学发光液在曝光机下曝光,采用Image J软件进行定量分析。
1.9 统计分析
2 结果
2.1 重组质粒的鉴定
pcDNA3.1(+)与ABCG2连接后的重组质粒图谱见图3A,在酶切位点XhoⅠ和HindⅢ中间插入了目的基因ABCG2的序列。重组质粒经XhoⅠ和HindⅢ双酶切后进行琼脂糖凝胶电泳,电泳结果如图3B所示,目的基因ABCG2与载体pcDNA3.1(+)的大小分别为1 965 bp和5 428 bp左右。测序所得的序列与预期一致,说明重组质粒构建成功。

图3 质粒pcDNA3.1(+)-ABCG2图谱(A)及其酶切后的电泳图(B)Fig.3 The pcDNA3.1(+)-ABCG2 map(A)and its electrophoretogram after enzyme digestion(B)
2.2 稳转株的表达鉴定
qRT-PCR结果表明,熔解曲线为单峰曲线,说明引物特异性好。图4A显示,ABCG2稳转株mRNA的含量与HEK293-mock细胞相比,提高了1 717.5倍,这从mRNA水平证明ABCG2稳转株过表达。Western-blot结果表明,ABCG2稳转株的蛋白质表达水平为HEK293-mock细胞的2.64倍(图4B)。

图4 HEK293-ABCG2细胞和HEK293-mock细胞中ABCG2的mRNA(A)及蛋白质(B)表达水平(***:P<0.001,n=3)Fig.4 Relative mRNA(A)and protein(B)expression levels of HEK293-ABCG2 and HEK293-mock cells(***:P<0.001,n=3)
2.3 ABCG2囊泡对14C-尿酸的摄取能力
由于ABCG2为尿酸外排转运体,普通细胞无法进行摄取实验,为了验证稳转株中ABCG2的功能,我们将细胞制备成膜囊泡进行14C-尿酸摄取实验。结果显示,加入AMP时,HEK293-ABCG2制备的囊泡的尿酸吸收能力较弱,与HEK293-mock细胞组相当;而在ATP存在的情况下,含有ABCG2的囊泡转运尿酸的能力显著强于未过表达ABCG2的囊泡,且呈时间依赖性和浓度依赖性(图5)。值得注意的是,未过表达ABCG2的囊泡对尿酸的转运也呈一定的剂量依赖性,这是因为HEK293-mock细胞中也含有少量ABCG2以及其他尿酸转运体。

图5 ABCG2囊泡转运14C-尿酸的时效(A)与量效(B)曲线(n=3)Fig.5 The time-effect curve(A)and dose-response curve(B)of14C-uric acid transport by ABCG2 vesicles(n=3)
2.4 降尿酸药物对ABCG2转运体的抑制作用
根据时效量效曲线结果,我们选择20 μmol/L的14C-尿酸吸收15 min,考察降尿酸药物苯溴马隆、丙磺舒、别嘌醇及处于临床研究中的RDEA-3170对ABCG2转运体的抑制作用。结果显示,丙磺舒、别嘌醇在50 μmol/L的浓度下几乎不抑制ABCG2,而苯溴马隆在5 μmol/L浓度下对ABCG2的抑制率为77.85%,RDEA3170在5 μmol/L时的抑制率为58.12%(图6)。梯度浓度实验显示,苯溴马隆抑制ABCG2的IC50值为(3.45±1.09)μmol/L,与文献报道[22]相当;RDEA3170抑制ABCG2的IC50值为(9.90±2.11)μmol/L(图7)。上述结果表明,苯溴马隆、RDEA3170具有较强的ABCG2抑制能力。

图6 苯溴马隆、RDEA3170、别嘌醇、丙磺舒对ABCG2的体外抑制活性(n=3)**:P<0.01 vs.空白组;#:P<0.05,###:P<0.001 vs.模型组(只加尿酸组)。Fig.6 Inhibitory effects of benzbromarone,RDEA3170,allopurinol and probenecid on ABCG2 in vitro(n=3)**:P<0.01,compared with the control group;#:P<0.05,###:P<0.001,compared with the model group treated with uric acid alone.

图7 苯溴马隆(A)与RDEA3170(B)体外抑制ABCG2的IC50值Fig.7 IC50values of benzbromarone(A)and RDEA3170(B)against ABCG2-mediated urate transport in vitro
3 讨论
随着人们生活水平的不断进步,高尿酸血症的发病率也在不断增加。然而,已有的治疗高尿酸血症的药物却少之又少。而且,目前上市的降尿酸药物如苯溴马隆、丙磺舒、别嘌醇等均有不同程度的副作用及毒性,如:苯溴马隆具有肝毒性[24],别嘌醇具有胃肠道反应[25]等,这些药物处于被淘汰的边缘[26]。现阶段,选择性针对URAT1设计的抑制剂有望成为下一代降尿酸药物,但是药物对尿酸外排转运体如ABCG2、OAT1/3的作用会抵消URAT1的降尿酸作用,此外也会带来严重的毒性及不良反应。研究报道,高尿酸血症合并慢性肾病的患者使用苯溴马隆会增加其患尿毒症的风险,原因是苯溴马隆抑制ABCG2,影响有毒物质的排泄[27],如硫酸吲哚酚(indoxyl sulfate,IS)。同时,苯溴马隆的ABCG2抑制作用也可能导致联合用药时不良药物相互作用的发生[28]。这提示,开发选择性URAT1抑制剂,必须要评价其对ABCG2的抑制能力。
目前,ABCG2抑制剂的体外筛选系统主要分为基于膜及基于细胞的筛选系统。基于膜的系统主要包括囊泡法,该方法利用囊泡可以进行同位素标记的底物如尿酸、雌激素酮(estrone sulfate,ES)及ATP的检测[29]。此外,也有报道将ABCG2重组在人工制备的脂质体上,但该方法成本较高,不易制备[29]。基于细胞的筛选系统是以ABCG2为药物转运体,通过检测化疗药物的耐药性[30]及迁移能力[31],间接评价ABCG2的转运能力,但是该类方法不够直观,只能间接评价化合物对ABCG2的抑制能力。研究降尿酸化合物的ABCG2抑制能力,制备膜囊泡摄取同位素标记的尿酸是最直接最有效的方法。本文中,我们对报道过的囊泡制备方法[32~33]加以改进,分离出过表达ABCG2的膜囊泡,成功构建了体外筛选模型。该模型能用于评价化合物抑制ABCG2的能力,相比于其他方法,简化了囊泡制备及最后的收集步骤,具有时间短、重现性好的优点。
研究发现,临床常用降尿酸药物苯溴马隆、丙磺舒选择性低,对多种尿酸转运体均有抑制作用,包括ABCG2[26]。别嘌醇为黄嘌呤氧化酶抑制剂,主要通过抑制尿酸生成发挥降尿酸作用,其对尿酸转运体的功能没有影响[34]。因此,本文选择苯溴马隆、丙磺舒为阳性对照药物,别嘌醇为阴性对照药物。RDEA3170是阿斯利康公司目前正在推进的重磅降尿酸治疗药物,现已进入Ⅱ期临床试验[35],其体外选择性抑制URAT1的IC50低至0.025 μmol/L[36],在临床上展现出了较好的安全性与药效[37],但是其对ABCG2是否有抑制作用仍无报道。本文结果显示,RDEA3170也有较强的ABCG2抑制作用。虽然本文发现,RDEA3170对ABCG2的抑制能力弱于其对URAT1的抑制活性,但是也提示了RDEA3170的降尿酸效果可能会由于ABCG2的抑制作用被部分抵消,或者可能由于抑制ABCG2而在药物-药物相互作用中发挥作用。
已有研究报道,高尿酸血症与癌症的发生、发展、复发、转移及预后有关[38],血清尿酸水平升高可以增加恶性肿瘤发病率和死亡率[39]。可见,控制高尿酸血症对于肿瘤患者十分重要。ABCG2是多种抗肿瘤药物耐药性产生的主要原因。因此,抑制ABCG2可减少抗肿瘤药物的排出,达到药效增强的效果。ABCG2也参与调控多种药物的药代动力学过程,如舒尼替尼[40]、伊立替康[41]、吉非替尼[42]等,影响它们的疗效。因此,寻找ABCG2抑制剂能更好地增强类似抗肿瘤药物的效果[43]。有趣的是,本文检测的多个降尿酸药物,包括苯溴马隆、丙磺舒与RDEA3170,都具有一定的ABCG2抑制作用,提示高尿酸血症合并癌症的患者可以服用上述降尿酸药物,但同时也警示我们,上述药物与其他药物合用时会引起药物-药物相互作用,增加其他药物的血药浓度,因此要随时监测患者血药浓度,防止药物浓度过高而引起不良反应。
综上所述,本研究对发现ABCG2抑制剂提供了有力的工具,为高尿酸血症合并肿瘤的患者提供了用药参考。