黄瓜胚状体高频再生体系的建立及优化
刘 娜,薛婉钰,陈盼盼,张婷婷,李 娟,陈书霞
(西北农林科技大学 园艺学院/陕西省蔬菜工程技术研究中心,陕西 杨凌 712100)
黄瓜是葫芦科最主要的蔬菜作物之一[1],在世界范围内广泛栽培。黄瓜营养丰富,清香可口,深受消费者喜爱,在蔬菜的周年供应上占有重要地位[2-3]。联合国粮农组织(FAO)的统计资料显示,我国黄瓜生产面积2019年底达125.83万hm2,总产量约7 034万t,以设施栽培为主要生产方式。随着设施黄瓜栽培的快速发展和栽培面积的扩大,高温适宜、湿度较高的环境条件使各种病害的发生越发严重[4-5],尤其随着设施种植年限的增长,病原菌抗药性逐渐增加[6],导致设施黄瓜病害有逐年加重的趋势[5,7]。防治黄瓜病害、提高黄瓜产量及品质,已成为现阶段黄瓜研究的首要问题[8],培育抗病品种是解决该问题的有效途径之一,但黄瓜的遗传基础狭窄[9],常规育种年限长、效率低,因此对其进行遗传转化研究就显得极为重要。
黄瓜离体再生培养可选用的外植体种类有子叶节、子叶、下胚轴、未授粉子房和成熟胚等[10-14],一般可以通过器官再生和胚状体再生两种途径进行[10,15]。器官再生途径在进行进一步的遗传转化研究时,常存在转化率低、嵌合体多、假阳性率高等问题[16-17],限制了相关研究的进一步开展。胚状体再生途径因再生频率高、体系稳定及接受外源基因的能力强等特点而广受关注,且该途径获得的植株遗传稳定性好[11,18-19]。在可选的外植体中,子叶节因易获得且能产生胚状体而成为众多研究者首选的研究材料[10,20],但受到基因型、激素等因素的影响胚状体再生的频率不同[10,12-13,21-24]。因此,有必要进一步对不同的基因型、激素浓度以及处理时长等因素进行研究,探索建立高频稳定的胚状体再生途径和方式。
本研究对黄瓜基因型、苗态、子叶切割方式、激素和无菌苗培养条件进行探索,研究这些因素对黄瓜胚状体诱导率的影响,以期筛选适宜于体细胞胚发生的培养条件,为完善黄瓜胚状体再生途径、进一步建立黄瓜优良的遗传转化受体系统奠定基础。
1 材料与方法
1.1 试验材料
8份不同基因型黄瓜自交系材料Q24、Q16、9930、No.26、Gy14、No.14、S63和16F7-2-8,均由西北农林科技大学园艺学院蔬菜生理与生物技术课题组保存,其中Q24、Q16、9930、No.26、S63及16F7-2-8属于华北生态型,Gy14属于加工腌渍型,No.14属于和欧洲温室型。
1.2 试验方法
1.2.1 无菌苗的培养 挑选约150粒饱满无损伤的黄瓜种子放入干净的培养瓶中,使用氯气消毒1~2 h后取出,用灭菌蒸馏水浸泡2~3 h,放入超净工作台,用体积分数为3%的NaClO消毒15 min,继而用体积分数为75%的酒精消毒60~90 s,无菌水晃动清洗3~4次后置于无菌滤纸上,待其表面水分全部晾干后,接种到MS培养基上,标注品种及处理日期,置于培养室中培养无菌苗。培养条件为:温度22 ℃,光照强度2 000 lx,光照时间16 h/d,空气湿度80%~90%。
1.2.2 愈伤组织及胚状体的诱导 无菌苗生长至种皮脱落、子叶未展开状态时,从子叶远轴端切除1/2,保留约1 mm的下胚轴,再将两子叶纵向剖开,除去生长点,即得子叶节外植体。将子叶节外植体接种至含1.5 mg/L 2,4-D的愈伤组织诱导培养基上,每瓶接种6个外植体,每个材料接种15瓶,培养20~25 d后,将产生的愈伤组织与外植体分离,分别接种于MS培养基上,每瓶接种6块,置于培养室中培养,培养条件同1.2.1节,20~30 d后观察愈伤组织的出胚情况。
1.3 黄瓜胚状体诱导影响因素试验
1.3.1 黄瓜基因型 将不同基因型的黄瓜种子按1.2.1节方法培养无菌苗,再按照1.2.2节方法诱导胚状体的发生,最后观察愈伤组织状态及胚状体产生情况。
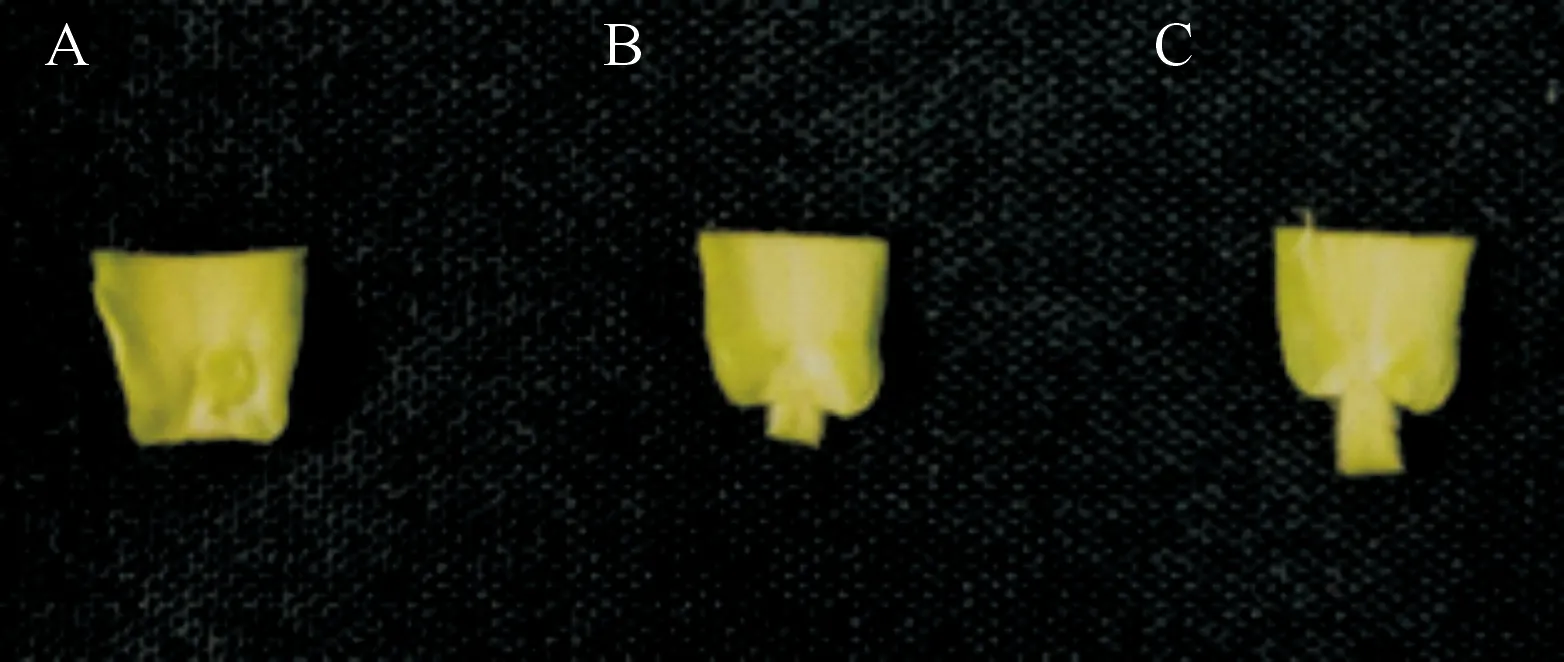
1.3.2 无菌苗苗态 无菌苗的苗态按照子叶展开程度划分为3级:子叶未展开,呈抱合状态(图1-A);子叶即将展开,呈半抱合状态(图1-B);子叶展开,2片子叶呈分离状态(图1-C)。本试验以Gy14和9930为材料,子叶节切割方式为从子叶远轴端切除1/2,保留约1 mm的下胚轴,再将两子叶纵向剖开,除去生长点。将不同状态的子叶节切割好后分别置于含1.5 mg/L 2,4-D的愈伤组织诱导培养基上,培养20~25 d后,将产生的愈伤组织与外植体分离,分别放置于MS培养基上进行培养,诱导胚状体的发生,统计胚状体诱导率及成苗率。所有培养阶段的温度均为22 ℃,光照强度2 000 lx,光照时间16 h/d,空气湿度80%~90%。

A.子叶未展开,呈抱合状态;B.子叶即将展开,呈半抱合状态;C.子叶展开,两子叶呈分离状态A.Cotyledons clasped;B.Cotyledons about to unfold and semi-closed;C.Cotyledons unfolded and separated图1 黄瓜无菌苗的3种苗态Fig.1 Three seedling states of cucumber sterile seedlings
1.3.3 子叶切割方式 子叶切割方式为从子叶远轴端切除1/2,然后按保留下胚轴的长短分为3个处理:不保留下胚轴、保留约1 mm下胚轴和保留约2 mm下胚轴,具体切割方式如图2所示。将切割好的子叶节置于含1.5 mg/L 2,4-D的愈伤组织诱导培养基上,培养20~25 d后,将产生的愈伤组织与外植体分离,分别放置于MS培养基上进行培养,诱导胚状体的发生,统计胚状体诱导率及成苗率。培养条件同1.3.2节。
A.切除1/2 子叶,不保留下胚轴;B.切除1/2 子叶,保留约1 mm下胚轴;C.切除1/2 子叶,保留约2 mm下胚轴A.Removing 1/2 cotyledon and leaving hypocotyl unreserved;B.Removing 1/2 cotyledon and hypocotyl reserved for 1 mm;C.Removing 1/2 cotyledon and hypocotyl reserved for about 2 mm图2 黄瓜子叶的3种切割方式Fig.2 Three cutting ways of cucumber cotyledons
1.3.4 无菌苗培养阶段光暗处理方式 在无菌苗培养阶段设置光、暗2种培养方式,光培养条件为光照强度2 000 lx,光照时间16 h/d;暗培养不照光。2种处理的其他培养条件一致,温度均为22 ℃,空气湿度均为80%~90%。将培养好的不同苗龄(2,3 d)无菌苗按1.2.2节方法进行愈伤组织及胚状体的诱导,统计胚状体诱导率及成苗率。愈伤组织诱导及胚状体诱导阶段的培养条件同1.3.2节。
1.3.5 2,4-D质量浓度 在魏文霞等[10]试验方法的基础上,设置2,4-D的质量浓度梯度分别为0.75,1.00,1.50,2.00 mg/L。按照1.3.2节的方法切割子叶节形成子叶节外植体,将其分别接种至含上述不同质量浓度2,4-D的愈伤组织诱导培养基上,培养20~25 d后,将产生的愈伤组织与外植体分离,分别放置于MS培养基上进行培养,诱导胚状体的发生,统计胚状体诱导率及成苗率。培养条件同1.3.2节。
1.3.6 胚性愈伤的诱导时长 将1.2.2节得到的子叶节放置在附加有1.0 mg/L 2,4-D的诱导培养基上诱导愈伤,设置诱导时间分别为20,30和60 d,将产生的愈伤组织与外植体分离,分别放置于MS培养基上进行培养,诱导胚状体的发生,统计胚状体诱导率及成苗率。培养条件同1.3.2节。
1.4 9930和Gy14体细胞胚的观察
将9930和Gy14产生的胚状体置于体视荧光显微镜(徕卡MZ10F,德国)下,观察胚状体发生各个时期的形态并拍照。
1.5 植株再生与驯化移栽
用镊子将9930和Gy14愈伤组织上肉眼可见的胚状体小心挑下或轻轻拨下,接种至MS培养基上进行培养。待植株生长至肉眼可见其生长点时逐渐打开瓶口,进行驯化,最后移栽至基质中,统计成苗率。
1.6 数据调查与统计分析
胚状体诱导率及成苗率的计算方法如下:胚状体诱导率=产生胚状体的愈伤块数/总愈伤块数×100%,成苗率=所得正常植株个数/胚状体个数×100%。
试验数据采用Excel 2010进行处理及制图。
2 结果与分析
2.1 基因型对黄瓜愈伤组织和胚状体诱导的影响
如图3所示,所有基因型黄瓜的子叶节在1.5 mg/L 2,4-D诱导下均可产生愈伤组织,但愈伤组织的形态有所不同,有些种质材料的子叶节诱导的愈伤组织发绿、质感坚硬,在后续的培养过程中愈伤组织表面逐渐变白,如No.26(图3-D)、Q24(图3-G)、16F7-2-8(图3-C)等,这样的愈伤组织转移到胚状体诱导培养基上后,形成的胚状体很少(图4-A)。而部分种质材料诱导的愈伤组织发白,质地松软,用镊子触碰易散开,如9930(图3-B)和Gy14(图3-E),这样的愈伤组织转移到胚状体诱导培养基上后,容易诱导出较明显的胚状体(图4-B,C)。

A.No.14;B.9930;C.16F7-2-8;D.No.26;E.Gy14;F.Q16;G.Q24;H.S63图3 不同基因型黄瓜子叶节在愈伤组织诱导培养基上的培养结果 Fig.3 Culture results of different genotypes of cucumber cotyledon nodes on callus induction medium

A.16F7-2-8;B.Gy14;C.Gy14愈伤组织的局部放大A.16F7-2-8;B.Gy14;C.Local magnification of Gy14 callus图4 不同基因型黄瓜的愈伤组织在胚状体诱导培养基上的生长状态Fig.4 Growth of callus from different cucumber genotypes cultured on embryo induction medium
2.2 无菌苗苗态对黄瓜胚状体诱导的影响
为了解无菌苗不同苗态对胚状体诱导率的影响,以Gy14和9930为试验材料,分别对其3种不同的苗态进行了胚状体诱导试验。由表1可知,Gy14子叶在未展开状态下的胚状体诱导率为39.3%,较子叶即将展开和子叶展开状态下的胚状体诱导率(6.7%和12.1%)高;成苗率为50.0%,也较子叶即将展开和子叶展开状态下的成苗率(26.5%和28.6%)高。9930子叶未展开、子叶即将展开和子叶展开状态下的胚状体诱导率分别为38.7%,23.4%和20.8%,成苗率分别为4.2%,3.7%和9.1%,子叶未展开状态下的胚状体诱导率约是子叶即将展开状态下的1.65倍,约是子叶展开状态下的1.86倍。由此可见,Gy14和9930均以子叶未展开时较为幼嫩的状态适宜胚状体的诱导。由于Gy14的胚状体诱导率和成苗率较9930高,因此后续试验均以Gy14作为胚状体再生体系优化的研究对象。

表1 无菌苗苗态对黄瓜胚状体诱导率和成苗率的影响Table 1 Effects of sterile seedling states on cucumber induction rate of embryoid and seedling formation rate
2.3 子叶切割方式对黄瓜胚状体诱导的影响
由表2可知,子叶节下端不保留下胚轴的处理胚状体诱导率为68.9%,成苗率为61.3%;子叶节下端保留约1 mm下胚轴的处理与不保留下胚轴的处理相比,胚状体诱导率和成苗率相对较高,分别为85.2%和69.5%;子叶节下端保留约2 mm下胚轴的切割方式胚状体诱导率和成苗率均最低,分别为40.0%和50.0%。

表2 子叶切割方式对黄瓜胚状体诱导率和成苗率的影响Table 2 Effects of cutting ways of cotyledon on cucumber induction rate of embryoid and seedling formation rate
2.4 无菌苗培养阶段光暗处理对黄瓜胚状体诱导的影响
将消毒后的黄瓜种子置于不同光暗条件下促使其萌发,同时选取不同苗龄(2,3 d)的材料作对比,其胚状体诱导结果如表3所示。由表3可知,无菌苗培养阶段的光暗处理对于后期胚状体诱导率的影响无明显规律,苗龄2 d的外植体在光照条件下胚状体诱导率和成苗率较黑暗条件下高,分别为58.7%和87.3%;而苗龄3 d的外植体在黑暗条件下的胚状体诱导率和成苗率较高,分别为39.5%和31.0%。
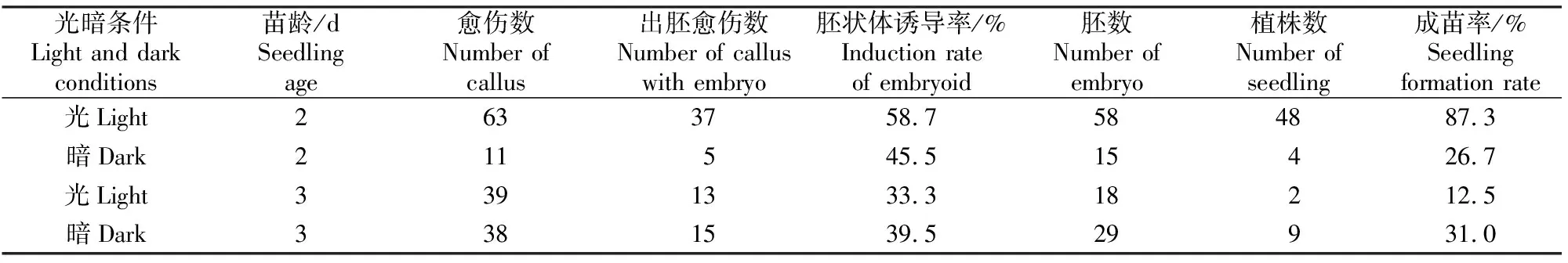
表3 无菌苗培养阶段光暗条件对黄瓜胚状体诱导率和成苗率的影响Table 3 Effects of light and dark treatment of sterile seedlings on cucumber induction rate of embryoid and seedling formation rate
2.5 2,4-D质量浓度对黄瓜胚状体诱导的影响
由表4可知,愈伤组织诱导过程中所用激素的质量浓度是影响胚状体诱导和再生的关键因素。适宜于Gy14子叶节诱导胚状体的2,4-D质量浓度为1.00 mg/L,此条件下的胚状体诱导率为31.7%,约是2,4-D质量浓度为2.00 mg/L时胚状体诱导率的3倍。降低或升高2,4-D的质量浓度都会使胚状体诱导率有所下降,如2,4-D质量浓度为0.75 mg/L时,胚状体诱导率为23.1%。适宜于Gy14子叶节诱导所得胚状体再生为正常植株的2,4-D质量浓度为0.75 mg/L,此条件下的成苗率为66.7%,约是2,4-D质量浓度为1.00 mg/L时的2倍。
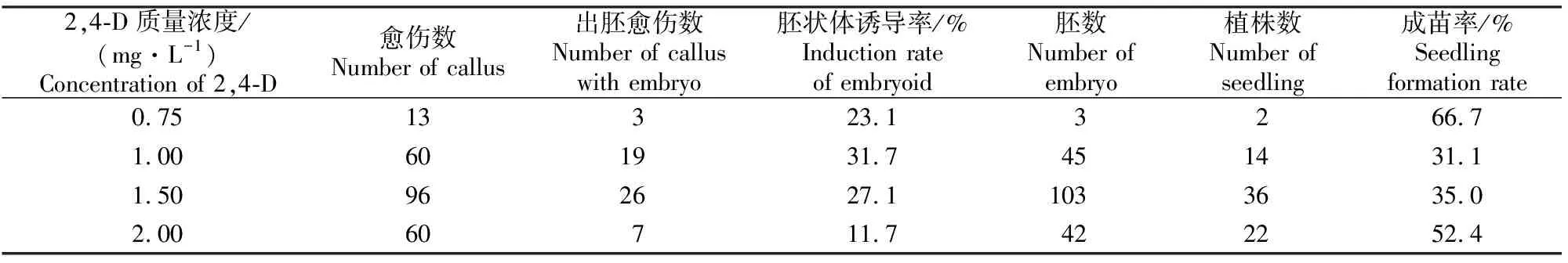
表4 2,4-D质量浓度对黄瓜胚状体诱导率和成苗率的影响Table 4 Effects of 2,4-D concentration on cucumber induction rate of embryoid and seedling formation rate
2.6 愈伤组织诱导时长对黄瓜胚状体诱导的影响
由表5可知,在愈伤组织诱导阶段,不同诱导时长对后期胚状体的诱导有一定影响。在含1.0 mg/L 2,4-D的培养基中诱导30 d的愈伤组织,胚状体诱导率和成苗率相对较高,分别为39.6%和65.6%;诱导时长为20 d时,胚状体诱导率为39.5%,与诱导时长为30 d时的差异不大;诱导60 d的愈伤组织胚状体诱导能力出现了一定程度的下降,诱导率仅为18.3%。
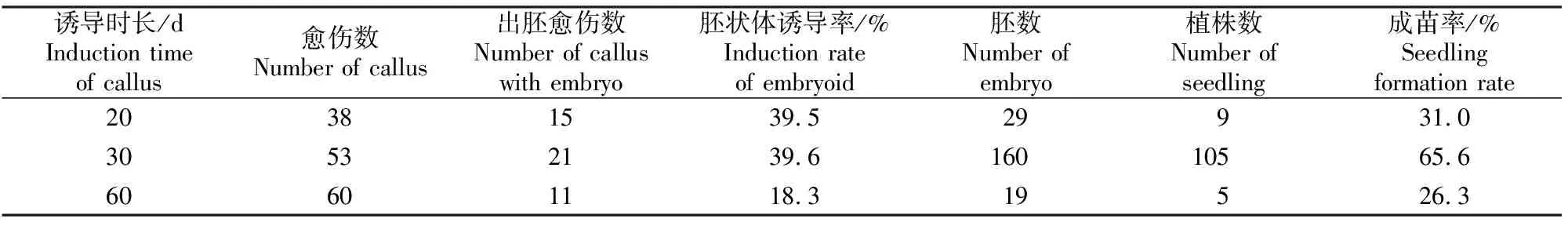
表5 愈伤组织诱导时长对黄瓜胚状体诱导率和成苗率的影响Table 5 Effects of induction time of callus on cucumber induction rate of embryoid and seedling formation rate
2.7 黄瓜胚状体的观察
如图5所示,9930和Gy14的胚状体发育都经历了球形胚、心形胚、鱼雷形胚和子叶形胚4个阶段;将得到的完整胚状体从愈伤上挑下,置于MS培养基上后,可逐渐发育成为完整的植株。
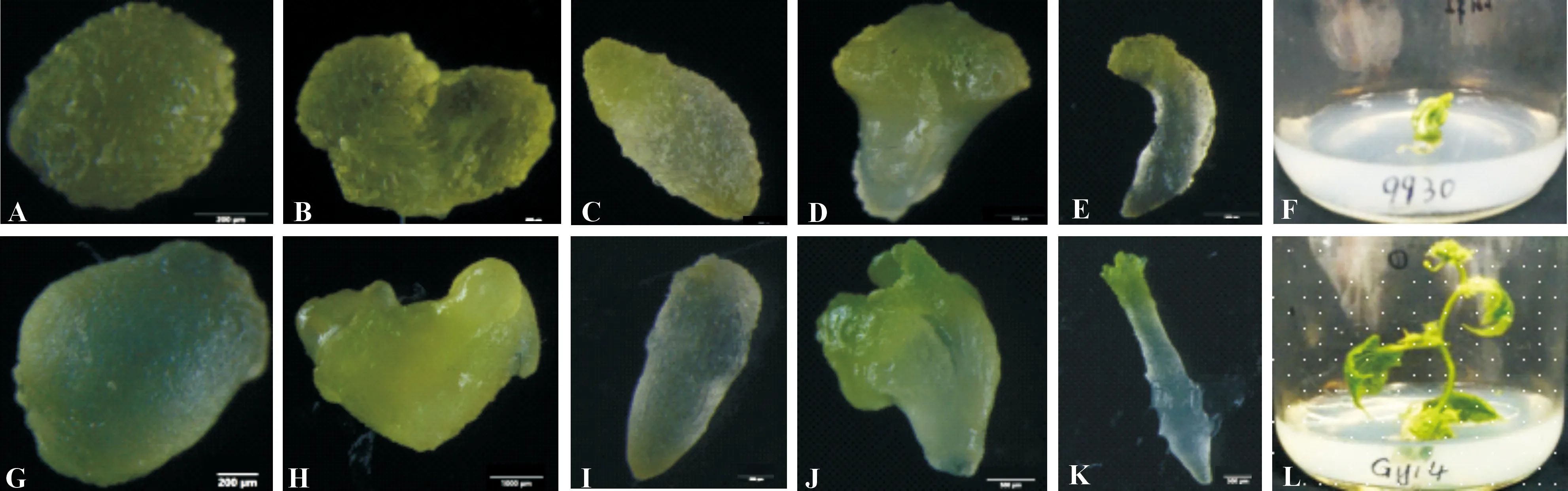
A.9930球形胚;B.9930心形胚;C.9930鱼雷形胚;D,E.9930子叶形胚;F.9930小植株;G.Gy14球形胚;H.Gy14心形胚;I.Gy14鱼雷形胚;J,K.Gy14子叶形胚;L.Gy14小植株A.Globular embryo of 9930;B.Heart-shape embryo of 9930;C.The torpedo shaped embryo of 9930;D,E.Cotyledinous stage embryo of 9930;F.Plantlets of 9930;G.Globular embryo of Gy14;H.Heart-shape embryo of Gy14;I.The torpedo shaped embryo of Gy14;J,K.Cotyledinous stage embryo of Gy14;L.Plantlets of Gy14图5 不同发育时期的黄瓜胚状体及其萌发而成的小植株Fig.5 Cucumber embryoids at different development stages and their germinated plantlets
3 讨 论
3.1 植物胚状体发生的影响因素
植物胚状体的萌发是一个相对复杂的过程,受到多种因素的影响,如基因型、外植体状态、培养条件、激素浓度等[10,20,23,25-26],其中基因型是影响胚状体发生的一项至关重要的因素,黄瓜的组织培养具有较强的基因型特异性。多项研究均表明,不同的基因型材料具有不同的胚状体诱导率,且差异显著[10,20,27]。唐莉等[28]认为,基因型影响胚状体再生的可能原因有以下两种:一是不同基因型材料的胚状体再生频率不同;二是不同基因型材料胚状体再生的最适刺激条件不同,从而导致胚状体再生频率不同。因此,根据不同的基因型探索不同的诱导条件,对于快速高效实现体细胞胚的再生具有重要的实践意义。本试验探索了8种基因型材料的出胚能力,发现Gy14是这些材料中较为适宜用于胚状体萌发的黄瓜种质。另外,本试验还发现,即使是同一种质,同一处理条件下的胚状体诱导率也会有较大差异,推测其可能原因是不同批次的种子饱满度、生活力等有所不同,萌发所得无菌苗的活力存在一定差异,进而影响了胚状体再生。
目前,有关无菌苗苗龄对胚状体再生影响的研究鲜有报道,但在器官再生途径的研究中,多以1~4 d作为黄瓜最佳苗龄,也有选择5~7 d的[15,29-30]。另有研究发现,试验过程中可能会由于黄瓜种子活力或浸种方式的不同,导致种子的萌发速率有较大差异,最终影响到无菌苗达到最佳再生状态所需的时间[31],因此以幼苗的生理学状态即苗态(生理苗龄)作为判断外植体状态的主要依据可能更为准确。本试验发现,Gy14和9930子叶未展开状态下的外植体其胚状体诱导率较子叶即将展开状态下的胚状体诱导率高,表明子叶处于较为幼嫩的状态时有利于胚状体的诱导。
愈伤组织诱导阶段所用外源激素的种类及其质量浓度对胚状体的诱导发生具有关键性作用,但不同研究者使用的激素种类和质量浓度却不完全相同[32-34]。目前的研究多选用2,4-D作为诱导胚状体再生的外源激素,如冯琴等[20]以黄瓜种质9101为试验材料,发现在添加2.0 mg/L 2,4-D的MS培养基上诱导愈伤,有利于胚状体的再生。魏文霞等[10]以黄瓜种质14-1为试验材料,发现在愈伤组织诱导阶段添加1.5 mg/L 2,4-D对胚状体的诱导效果最好。也有研究者将2,4-D与其他激素进行组合,用于胚状体的诱导,如张蕾琛等[35]研究表明,南瓜未授粉子房在MS+4.00 mg/L 2,4-D+1.00 mg/L 6-BA+0.25 mg/L NAA的条件下培养,其胚状体诱导率最高。本试验基于前人研究结果,选用2,4-D作为诱导胚状体再生的外源激素,并设置不同的质量浓度和处理时长,结果发现适宜于黄瓜种质Gy14胚状体诱导的2,4-D质量浓度为1.00 mg/L,相应的最适处理时长为30 d;适宜于Gy14胚状体诱导后再生为植株的2,4-D质量浓度为0.75 mg/L,此时的成苗率为66.7%,约是2,4-D质量浓度为1.00 mg/L时的2倍。因此,愈伤组织诱导培养基中添加多大质量浓度的2,4-D才能获得最佳的胚状体诱导率和成苗率,仍需进一步的研究。
3.2 植物胚状体发生数量的统计方法
目前,在胚状体数量统计及胚状体诱导率计算时,不同的学者采用了不同的方法,常用的统计方式有2种,其一是统计产生胚状体的外植体数目,计算产生胚状体的外植体数目与总外植体数目的比值[10,20,36-37]。基二是统计产生的胚状体数目,计算产生的胚状体数目与总外植体数目的比值[38-39],本试验发现,胚状体的发生是一个复杂而逐渐变化的过程,部分胚状体呈细小簇状,在观察统计的时候,对于这些尚未成形的微小胚状体可能无法用肉眼分辨其具体数目,因此选择用第一种方式计算不同处理的胚状体诱导率,但这种统计方式也不十分准确,无法甄别愈伤组织上单个或成簇出现的胚状体。因此,如何更加准确地计算外植体的胚状体诱导率,判断胚状体再生体系的高效性,仍需进一步研究。
4 结 论
适宜于黄瓜胚状体再生的材料为Gy14。适宜于Gy14胚状体再生的条件为:在子叶未展开、仍呈抱合状态、较为幼嫩时作为外植体进行诱导,此时胚状体诱导率最高,可达66.7%;子叶节切割时,保留约1 mm下胚轴处理的胚状体诱导率最高,可达85.2%,其成苗率可达69.5%;无菌苗培养过程中进行16 h/d光照处理或全天暗处理,对于胚状体诱导率的影响无明显规律;适宜于Gy14胚状体萌发的2,4-D质量浓度为1.00 mg/L,此时的胚状体诱导率为31.7%;胚状体诱导阶段的适宜培养时间为30 d,此条件下诱导率为39.6%,与培养时间为20 d的诱导率十分相近,但成苗率大约是培养20 d时的2倍。这些条件的确定,为后期建立合适的黄瓜再生体系奠定了基础。

