TRIM8基因在小鼠组织和早期胚胎中的表达及其功能初探
马增友,秦 歌,郑浩懿,卢郑坤,张文昌,彭 辉
(福建农林大学 动物科学学院,福建 福州,350002)
三联基序(tripartite motif,TRIM)家族成员是一类结构保守的蛋白,都具有TRIM结构域,该结构域主要包含一个卷曲的区域、一个B-Box型的锌指和一个含3个锌离子结合位点的环形指状区域。TRIM蛋白家族进化速度较快,在人类上已发现80多个家族成员[1]。TRIM家族成员具有不同的生物学功能,参与细胞分化、细胞凋亡、抗病毒免疫、细胞周期调控、细胞信号通路调控和癌症发生发展等多种生物学过程[2-4]。TRIM8作为TRIM家族中的一员,主要参与调控细胞生长、抗病毒、介导机体炎症和免疫反应等[5-7]。此外,TRIM8还具有抑制和促进癌细胞生长的双向作用[8]。最新研究表明,TRIM8与KIF11/EG5有丝分裂纺锤体组装调节因子和KIFC1有丝分裂细胞骨架重组主要调节因子相互作用,在有丝分裂过程中始终定位在纺锤体上,并在中心体分离过程中发挥作用,从而控制有丝分裂进程并影响染色体稳定性[9]。
TRIM8参与Nanog的调控、纺锤体的形成以及染色体的稳定[9],说明其不仅在细胞分裂过程中发挥重要作用,还可能参与细胞分化的调节。本课题组前期研究发现,TRIM8基因在小鼠受精卵中大量表达,提示其可能在小鼠早期胚胎发育过程中发挥一定作用。本试验通过RT-PCR、RT-qPCR、免疫印迹、免疫组化和免疫荧光等多种方法,研究了TRIM8基因和蛋白在小鼠各组织及早期胚胎中的表达及定位情况,并采用RNA干扰方法研究了TRIM8沉默对小鼠早期胚胎发育的影响,旨在为探索TRIM8基因在小鼠早期胚胎中的功能提供依据。
1 材料与方法
1.1 材 料
1.1.1 试验动物 雄性和雌性ICR小白鼠,均来源于福建省吴氏实验动物中心,饲养过程中小鼠自由采食并保持室内洁净,环境温度(25±1) ℃,光照14 h/d。
1.1.2 主要试剂 孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(hCG),均购自宁波第二激素厂;CellAmpTMWhole Transcriptome Amplification Kit (Real Time)Ver.2、PrimeScriptTMOne Step RT-PCR Kit Ver.2和TB Green®Premix Ex TaqTMⅡ (Tli RNaseH Plus),购自Takara公司;琼脂糖,购自Biowest公司;Opti-MEM®Ⅰ液,购自Invitrogen公司;Negative Control siRNA(货号AM4635),购自Ambion 公司;TRIM8 esiRNA(货号EMU050771-20UG),购自Sigma公司;TRIM8多克隆抗体(兔源,货号PA5-41641),购自Thermo Fisher公司;TRIM8单克隆抗体(鼠源,货号sc-398878),购自Santa Cruz公司;Western blot相关试剂,购自碧云天生物技术有限公司;其他试剂均购自Sigma公司。
1.2 TRIM8在小鼠组织中的表达情况
1.2.1 组织的采集 将6周龄的雌鼠和雄鼠通过脱颈法处死,快速解剖并取心、肝、脾、肺、肾、胃、肠、肌肉、子宫、卵巢和睾丸,在预冷的PBS中清洗2次,备用。
1.2.2 基因水平表达 取上述11种组织,通过Trizol试剂提取组织RNA,在260 nm处测定RNA吸光度(OD260),根据吸光度与浓度的线性关系,计算RNA质量浓度。调整各组织RNA的质量浓度为300 ng/μL,放入-80 ℃冰箱存储备用。
以次黄嘌呤磷酸核糖基转移酶Ⅰ(Hprt1)基因为内参基因,采用普通RT-PCR检测TRIM8基因在小鼠不同组织中的表达情况。针对TRIM8基因和Hprt1内参基因CDS区,利用Primer 5.0软件设计引物,交由生工生物工程(上海)股份有限公司合成,引物序列见表1。RT-PCR反应体系和条件参见PrimeScriptTMOne Step RT-PCR Kit Ver.2试剂盒说明书。PCR产物用2%的琼脂糖凝胶电泳检测。
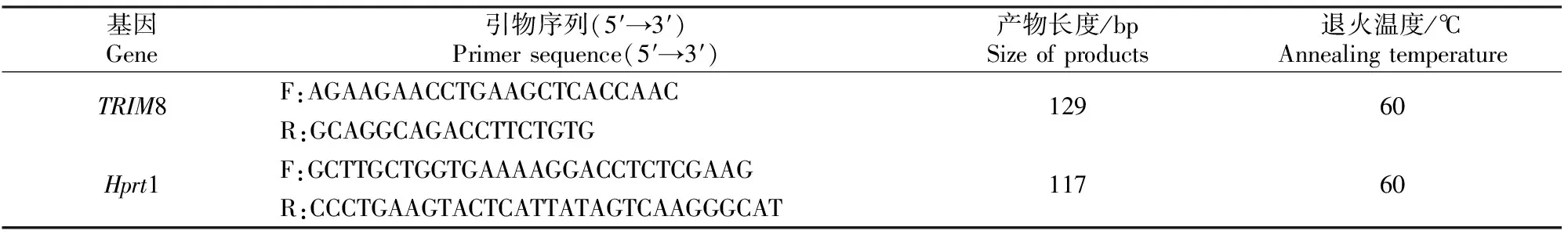
表1 试验的引物序列Table 1 Primer sequences in the test
1.2.3 蛋白水平表达 取上述11种组织,放入玻璃研磨器中并加入IP裂解液和全蛋白酶抑制剂的混合液(V(IP裂解液)∶V(全蛋白酶抑制剂)=100∶1),充分研磨后加入无菌无酶离心管中,13 000g离心10 min,取适量上清液到新的无菌无酶离心管中,加入蛋白上样缓冲液,放入100 ℃水浴锅中煮10 min。
以β-actin蛋白为内参蛋白,采用免疫印迹试验检测TRIM8蛋白在各组织中的表达情况。取制备好的小鼠组织蛋白样品在8% SDS-PAGE凝胶中电泳,蛋白分离后根据Marker的位置切下含有目的蛋白的凝胶,采用湿转法将蛋白转移到NC膜上。将膜放入含50 g/L脱脂奶粉的TBS中封闭3 h,之后将NC膜放入1∶500稀释的TRIM8一抗溶液中4 ℃过夜孵育。取出膜放入TBST(含体积分数0.1% Tween 20)溶液中清洗3 次,每次5 min,然后置于1∶10 000的羊抗鼠荧光二抗中常温避光孵育2 h,再放入TBS溶液中避光清洗3次,每次8 min,摇洗后使用双色红外激光成像系统 Odyssey CLx采集图片。
1.3 TRIM8在小鼠卵巢中的定位
运用免疫组化技术研究TRIM8蛋白在卵巢中的定位。取6周龄雌鼠,脱颈椎处死,取卵巢在PBS中洗净后置于体积分数4%多聚甲醛中固定,24 h后石蜡包埋,制成6 μm厚的切片。卵巢组织切片经过二甲苯脱蜡和不同浓度梯度酒精溶液再水化后置于10 mmol/L的枸橼酸钠中,用微波炉加热10 min进行抗原修复,自然冷却至室温。用链霉素-生物素法(SP法)对卵巢切片进行免疫组织染色,先将切片加入到非免疫动物(羊)血清封闭液中进行封闭,再放入一抗TRIM8抗体(1∶200倍稀释)溶液中4 ℃过夜孵育。用PBS洗净后滴加生物素化的羊抗鼠二抗,室温下孵育10 min,PBS清洗3次,加入链霉菌抗生物素-过氧化物酶溶液检测TRIM8蛋白,用DAB染色试剂盒显色,再用苏木素对细胞核进行染色。试验设对照组,不加一抗,其他步骤与试验组完全一致。最后用封片剂封片,在倒置显微镜下观察组织切片并拍照。
1.4 TRIM8在小鼠早期胚胎中的表达情况
1.4.1 早期胚胎的采集 取6~8周龄雌性小鼠,腹腔注射PMSG 10 IU/只,48 h后腹腔注射hCG 10 IU/只,然后与成年公鼠按照1∶1比例合笼。合笼后14 h检查雌鼠阴道栓,选取有阴道栓的小鼠继续饲养,之后在小鼠早期胚胎发育的不同时期用颈椎脱臼法处死雌鼠,采集1-细胞胚胎、2-细胞胚胎、4-细胞胚胎、8-细胞胚胎、桑葚胚和囊胚,备用。
1.4.2 基因水平表达 通过RT-qPCR技术检测TRIM8基因在小鼠早期胚胎中的表达水平。取小鼠不同发育阶段的早期胚胎各10个,采用CellAmpTMWhole Transcriptome Amplification Kit (Real Time)Ver.2试剂盒提取胚胎RNA并反转录合成cDNA,再利用TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒进行RT-qPCR,反应体系和运行参数参照该试剂盒说明书。采用2-ΔΔCt法对TRIM8基因的表达水平进行分析,以1-细胞胚胎TRIM8的表达量为基准(表达量定为1)来确定其他早期胚胎的表达水平。
1.4.3 蛋白水平表达 取各时期胚胎各80 个,放入试管中,加IP裂解液和全蛋白酶抑制剂混合液(V(IP裂解液)∶V(蛋白酶抑制剂)=25∶1)进行裂解,加入蛋白上样缓冲液,在100 ℃水浴锅中煮 10 min。取制备好的小鼠早期胚胎的蛋白样品进行免疫印迹试验,具体方法同1.2.2节。
1.5 TRIM8在小鼠早期胚胎中的定位
采用免疫荧光结合激光共聚焦显微镜技术探究TRIM8蛋白在早期胚胎发育过程中的定位。取小鼠不同发育时期的胚胎置于免疫染色固定液中,室温下固定1 h,用免疫染色洗涤液摇洗3次,在含有体积分数2% Triton X-100的PBS溶液中打孔20 min,通透打孔后的胚胎放至免疫染色封闭液中封闭4 h,用一抗TRIM8抗体(1∶100倍稀释)于4 ℃条件下过夜孵育,免疫染色洗涤液摇洗3次,再用Alexa Fluor 488标记的山羊抗兔荧光二抗(1∶500倍稀释)避光室温孵育2 h,用免疫染色洗涤液避光摇洗3次,DAPI染核10 min,免疫染色洗涤液避光摇洗3次,清洗后的胚胎移至无水乙醇浸泡过的载玻片上,向胚胎周围滴加荧光抗淬灭剂,用镊子夹住盖玻片轻轻放在有胚胎区域的载玻片上,用指甲油涂抹载玻片四周使其固定,再将载玻片放置在LEICA SP8激光共聚焦显微镜下进行显微观察并照相。
1.6 TRIM8沉默对早期胚胎发育的影响
将1.4.1节收集的胚胎转移至酸性台氏液中消化透明带30~40 s,立即注入1 mL KSOMaa培养液停止消化,然后将胚胎移入KSOMaa培养液中,备用。 用Opti-MEM®Ⅰ液体稀释转染试剂(稀释比例参照siPORT胺类转染说明书),室温下孵育10 min,备用。用Opti-MEM®Ⅰ液体稀释TRIM8 esiRNA和阴性对照siRNA,随后将孵育好的转染试剂与TRIM8 esiRNA(设0.3,0.7和1.0 μmol/L 3个浓度)和阴性对照siRNA(1.0 μmol/L)分别混合并室温静置孵育10 min。将孵育好的转染复合物加入用Opti-MEM®Ⅰ液体清洗2次的电转皿中,再用吸卵针吸取胚胎至电转皿两根电极之间进行电转,设置电转仪参数为:电压20 V,脉冲时间1 ms,脉冲次数3次,重复0次。试验设Opti-MEM®Ⅰ液体电转的受精卵作为空白对照组。各组胚胎均在KSOMaa培养液中培养24 h后收集胚胎细胞,利用RT-qPCR技术在基因水平检测TRIM8的沉默效率,并利用2-ΔΔCt法进行TRIM8基因相对表达水平分析,以空白对照组的表达量为基准(表达量定为1)来确定其他组的表达水平。收集1.0 μmol/L esiRNA沉默TRIM8后的胚胎、空白对照组胚胎和阴性对照组胚胎各100个,制备蛋白样品,采用免疫印迹试验检测TRIM8蛋白的表达情况,具体方法同1.2.2节。
为进一步探究沉默TRIM8对早期胚胎发育的影响,将1.0 μmol/L(沉默TRIM8基因的最适esiRNA浓度)esiRNA沉默组、空白对照组、阴性对照组胚胎用KSOMaa培养液进行培养,培养过程中观察胚胎发育情况并拍照记录,胚胎发育至囊胚期时统计各组囊胚率。
1.7 数据统计分析
应用SPSS 25.0统计软件进行数据差异显著性分析。不同浓度siRNA 沉默合子TRIM8基因的沉默效率采用单因素方差分析法进行显著性检验,每组数据至少重复3次。沉默TRIM8基因后,早期胚胎的发育率采用卡方(χ2) 检验进行显著性分析,当P<0.05 时表示差异显著。
2 结果与分析
2.1 TRIM8在小鼠组织中的表达
利用RT-PCR研究TRIM8基因在小鼠不同组织中的表达情况,结果表明,其在心、肝、 脾、肺、肾、胃、肠、肌肉、子宫、卵巢和睾丸中均有表达 (图1-A)。利用免疫印迹技术研究TRIM8蛋白在小鼠不同组织中的表达,结果显示其在小鼠11种组织中均有表达(图1-B)。
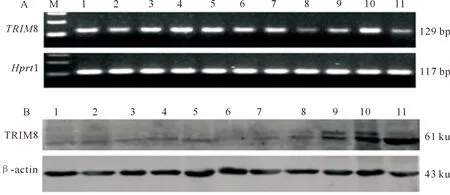
A.TRIM8基因在小鼠不同组织中的表达情况;B.TRIM8蛋白在小鼠不同组织中的表达情况。M.DNA Marker;1.心脏;2.肝脏;3.脾脏;4.肺脏;5.肾脏;6.胃;7.小肠;8.肌肉;9.子宫;10.卵巢;11.睾丸A.RT-PCR analysis of TRIM8 mRNA in mouse tissues;B.Western blot analysis of TRIM8 protein lysates isolated from mouse tissues.M.DNA Marker,1.Heart;2.Liver;3.Spleen;4.Lung;5.Kidney;6.Stomach;7.Intestine;8.Muscle;9.Uterus;10.Ovary;11.Testicles
2.2 TRIM8在小鼠卵巢中的定位
运用免疫组化技术研究TRIM8蛋白在卵巢中的定位,结果表明TRIM8蛋白主要定位在卵巢组织的卵母细胞中(图2)。
2.3 TRIM8在小鼠早期胚胎中的表达
采用RT-qPCR和免疫印迹试验研究TRIM8在小鼠早期胚胎中的表达情况。结果表明,TRIM8基因在1-细胞胚胎到4-细胞胚胎时期表达水平较高,在8-细胞胚胎到囊胚期表达水平较低(图3-A)。TRIM8蛋白在小鼠早期胚胎发育过程中均有表达,但在1-细胞胚胎到4-细胞胚胎时期表达量较高(图 3-B)。
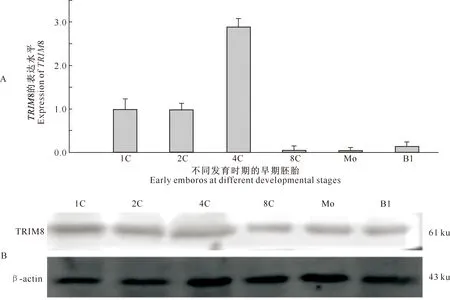
A.TRIM8基因在早期胚胎中的表达情况;B.TRIM8蛋白在早期胚胎中的表达情况。1C.1-细胞胚胎;2C.2-细胞胚胎;4C.4-细胞胚胎;8C.8-细胞胚胎;Mo.桑葚胚;Bl.囊胚。下图同A.Relative expression of TRIM8 in early embryos. B. TRIM8 protein expression in early embryos.1C.One-cell embryos;2C.Two-cell embryos;4C.Four-cell embryos;8C.Eight-cell embryos;Mo.Morula;Bl.Blastocysts.The same below
2.4 TRIM8在小鼠早期胚胎中的定位
试验结果表明,TRIM8蛋白主要定位在早期胚胎的细胞质中(图 4)。
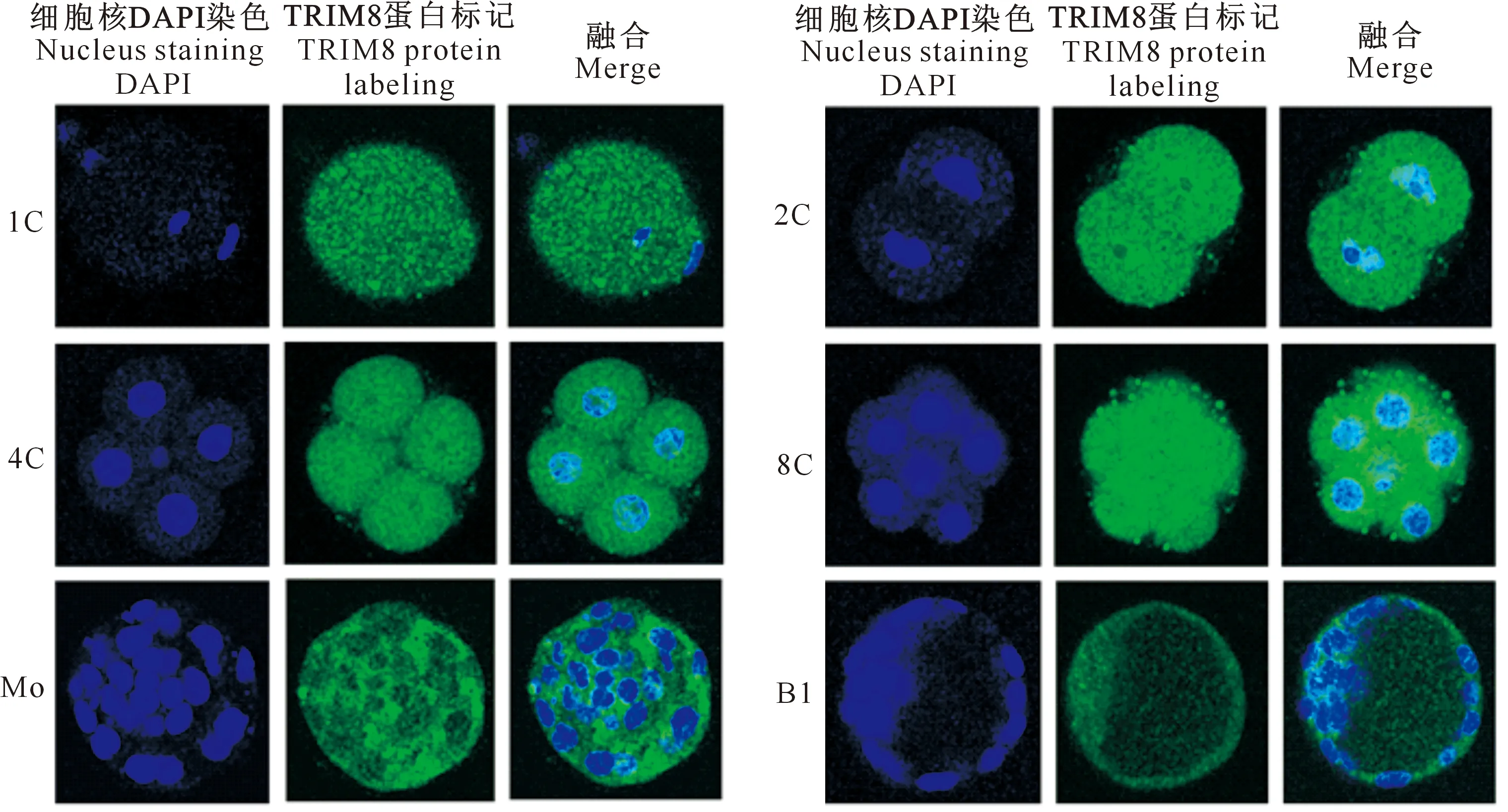
蓝色荧光为细胞核,绿色荧光为TRIM8蛋白Blue fluorescence indicates nucleus,and green fluorescence indicates TRIM8 protein图4 TRIM8蛋白在小鼠早期胚胎中的定位(×200)Fig.4 Localization of TRIM8 protein in early embryos of mouse(×200)
2.5 TRIM8 siRNA的沉默效率
沉默效率检测结果表明,与对照组相比,当esiRNA浓度达到1.0 μmol/L 时,TRIM8基因的沉默效率为83%(图5-A)。免疫印迹试验结果表明,TRIM8基因沉默组胚胎蛋白表达水平明显降低(图5-B)。
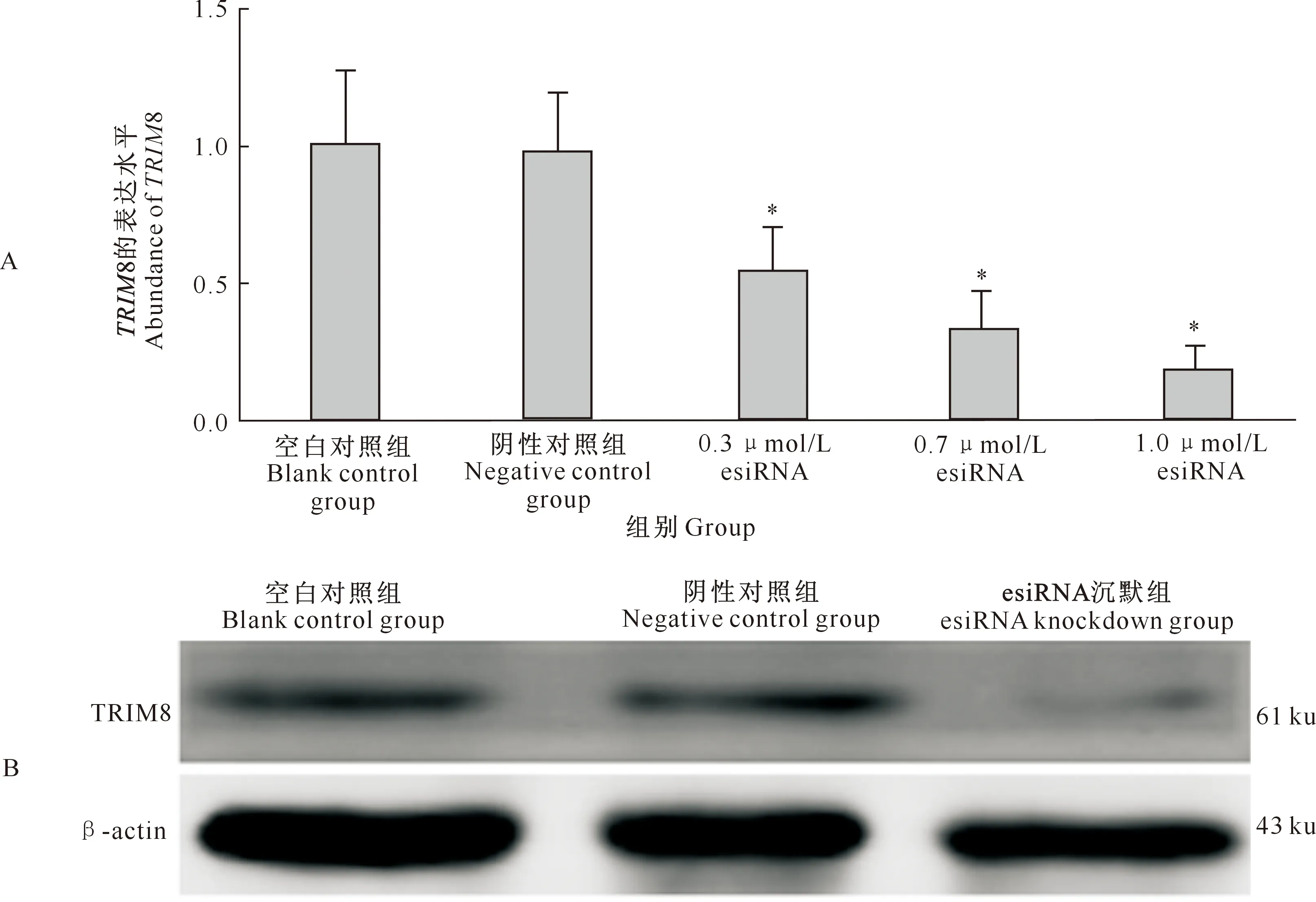
A.合子中TRIM8沉默后其mRNA表达水平;B.合子中TRIM8沉默后其蛋白表达水平A.TRIM8 mRNA level in TRIM8 knockdown embryos;B.Protein expression level after silencing TRIM8 in zygote图5 合子中TRIM8沉默效果检测Fig.5 Detection of TRIM8 silencing effect in zygotes
2.6 沉默TRIM8对小鼠早期胚胎发育的影响
结果表明,胚胎培养3.5 d后,TRIM8沉默组胚胎发育到囊胚的数量明显减少,而空白对照组和阴性对照组胚胎大多数发育到了囊胚阶段(图6-A)。统计分析结果(图6-B)显示,沉默TRIM8基因明显阻滞了早期胚胎发育进程,沉默组的囊胚发育率显著低于空白对照组和阴性对照组(P<0.05)。
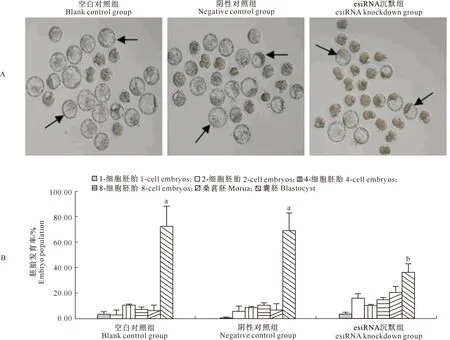
A.TRIM8沉默后胚胎培养3.5 d的形态学表现(×100),箭头标示囊胚;B.胚胎发育率统计结果,同时期胚胎图柱上标不同小写字母表示处理间差异显著(P<0.05)A.Morphology of TRIM8 knockdown embryos after being cultured for 3.5 days(×100),the arrow indicates blastocyst;B.Statistics of embryonic development rate,different lowercase letters indicate significant differences between treatments(P<0.05)图6 TRIM8沉默对小鼠早期胚胎发育的影响Fig.6 Effect of TRIM8 knockdown on early embryonic development of mouse
3 讨 论
通过RT-PCR和免疫印迹试验发现,TRIM8在包括卵巢在内的多种组织中表达,提示该基因可能具有多种生物学功能。本试验主要研究TRIM8在生殖系统中的作用,所以采用免疫组化试验进一步揭示了TRIM8蛋白定位于卵巢组织的卵母细胞中,说明TRIM8蛋白可能在卵子发生或早期胚胎发育过程中发挥一定作用。利用RT-qPCR和免疫印迹试验进一步检测TRIM8在早期胚胎发育过程中的表达,发现TRIM8在早期胚胎发育各个时期均有表达,进一步说明其可能参与了早期胚胎发育过程。通过免疫荧光方法,揭示了TRIM8蛋白主要定位于不同时期早期胚胎的细胞质中,提示TRIM8也可能参与细胞质中的物质代谢及生理活动调控。
TRIM家族部分成员可参与细胞生长和细胞周期调控。研究表明,在不同细胞系中分别沉默TRIM8、TRIM14、TRIM27、TRIM28、TRIM29、TRIM52、TRIM59、TRIM66和TRIM68时会导致细胞周期停滞[10-20]。进一步研究表明,TRIM家族部分成员在细胞有丝分裂不同时期和细胞周期进程调控中发挥作用,TRIM19、TRIM22、TRIM28、TRIM37和 TRIM69主要在有丝分裂前期发挥作用,TRIM19、TRIM32和TRIM69主要在有丝分裂前中期发挥作用,TRIM17、TRIM36和TRIM69主要在有丝分裂中期发挥作用,TRIM17、TRIM21、TRIM47和TRIM76主要在胞质分裂中发挥作用[21]。
前人研究表明,多种TRIM家族蛋白定位于有丝分裂纺锤体的中心体、纺锤体极、动粒、中心粒等关键部位,参与纺锤体形成并发挥重要的调控作用,确保了染色体正确分离[22-29]。最新研究表明,TRIM8的缺失会导致细胞有丝分裂双极纺锤体形成发生错误,影响有丝分裂过程中染色体的稳定性[9],沉默人成纤维细胞的TRIM8基因导致染色体非整倍体数目明显增加[30]。进一步研究发现,TRIM8蛋白与2种有丝分裂蛋白KIF11/Eg5和KIFC1存在相互作用,KIF11和KIFC1蛋白属于驱动蛋白家族成员,主要位于极间微管上,是有丝分裂期间调控双极纺锤体形成的关键蛋白,它们在控制中心体复制和纺锤体组装分离中起着重要作用[31-34],说明TRIM8蛋白在调控细胞有丝分裂纺锤体形成和染色体分离过程中发挥着重要作用。
为了确定TRIM8在小鼠早期胚胎发育过程中的功能,采用RNA干扰方法沉默早期胚胎中的TRIM8基因,结果发现TRIM8沉默胚胎的囊胚形成率显著低于空白对照组和阴性对照组,早期胚胎发育进程明显发生了阻滞,表明TRIM8参与调控小鼠早期胚胎正常发育过程。推测TRIM8可能通过控制小鼠早期胚胎发育过程中双极纺锤体的形成和组装,从而使染色体正确分离,保证早期胚胎有丝分裂的正常进行。在早期胚胎中缺失TRIM8蛋白可能造成纺锤体的组装和染色体的分离异常,最终导致有丝分裂异常,进而阻滞早期胚胎发育,该蛋白可能通过上述分子机制影响小鼠早期胚胎发育进程,但具体的分子机制仍需进一步探究。

