基于二聚人工抗原ELISA检测多残留β2-受体激动剂
刘淼苗,刘啊敏,陈尔净,马 骉,张明洲
(中国计量大学 生命科学学院,浙江 杭州 310018)
β2-受体激动剂常作为猪、牛和其他农场动物的生长促进剂使用,可以促进动物生长,提高瘦肉率[1-3]。养殖户为降低耐药风险,经常将多种兽药混合使用[4],这会导致同一批动物产品中出现多种残留[5]。这些残留的药物影响人体健康,容易出现食物中毒、心血管疾病和中枢神经系统疾病[6]等不良症状,包括我国在内的许多国家相继出台法律法令,明令禁止β2-受体激动剂用于养殖业[7-8]。因此,建立多残留同时检测的高灵敏方法尤为必要。
近年来,高效液相色谱法[9]、气相色谱-质谱法[10]、液相色谱-质谱法[11]、液体色谱-串联质谱法[12]、毛细管电泳电化学检测[13]等分析方法,广泛应用于β2-受体激动剂的检测。虽然大型仪器具有检测灵敏度高,结果准确,可以检测复杂样品的优点,但程序耗时、仪器昂贵、人员培训等因素使其并不适合现场筛查和快速分析[14]。免疫层析法具有简便快速的优点,但灵敏度相对较低[15-16]。酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)具有检测耗时短,操作步骤少,成本低等优点,在β2-受体激动剂残留的快检中具有广泛应用[17-18]。
β2-受体激动剂分为苯酚型和苯胺型[19],克伦特罗(Clenbuterol,CLE)属于苯胺型[20];莱克多巴胺(Ractopamine,RAC)是苯酚类[21]。若要同时检测猪尿中多种兽药残留,须同时检测两种类型。现有检测手段中,多针对一种类型的β2-受体激动剂制备人工抗原,检测目标局限在特定类型。本实验将CLE和RAC与载体蛋白经重氮化反应合成CLE-RAC二聚人工抗原,制备抗CLE-RAC单克隆抗体,达到一次实验同时测定苯酚型和苯胺型两大类β2-受体激动剂的效果。在此基础上,优化ELISA实验反应条件,更高效的实现猪尿中9种β2-受体激动剂的同时检测。该方法可以为β2-受体激动剂等兽药多残留免疫分析提供一种新途径。
1 材料与方法
1.1 试剂及仪器
标准品均购自中检计量生物科技有限公司,具体信息见表1。牛血清白蛋白(BSA,纯度>99.0%)、人血清白蛋白(HSA,纯度>98.0%)、羊抗鼠IgG-HRP购自美国Sigma公司。包被液为50 mmol/L的碳酸盐缓冲液(pH 9.6),稀释缓冲液为10 mmol/L的磷酸盐缓冲溶液(pH 7.4)。稀释缓冲液中加入0.05%的吐温20即得洗液,洗液中加入5% BSA即得封闭液。终止液为2 mol/L硫酸。其他常规化学试剂购自上海国药集团化学试剂有限公司。

表1 标准品相关信息Table 1 Standard related information
Multiskan FC全自动酶联免疫分析仪(美国Thermo公司)用于ELISA检测。Nanopure超纯水仪(美国Thermo公司)供应超纯水。MLS-3750全自动高压灭菌锅(日本Sanyo公司)用于灭菌。MCO-15AC CO2培养箱(日本Sanyo公司)用于细胞培养。
1.2 二聚人工抗原的合成
采用兰尼镍还原法,以羟基苯甲醛和硝基甲烷为起始物,制备莱克多巴胺氨基衍生物(RAC-NH2)。将RAC-NH2采用重氮化法与载体蛋白偶联,合成完整的莱克多巴胺抗原[22]。CLE人工抗原合成的方法与RAC人工抗原合成的方法相同[23]。在此基础上合成二聚人工抗原。用天平称量50 mg CLE和55.2 mg RAC-NH2,两者同时加入至6.2 mL 0.5 mol/L的硫酸溶液中,37 ℃水浴20 min,待其溶解后,4 ℃预冷。加入115.4 μL 10 mg/mL的亚硝酸钠溶液,冰上搅拌反应3 h。用氨基磺酸铵除去过量的NaNO2,将10 mL HSA溶液滴加到上述反应环境中。用1 mol/L NaOH溶液使反应环境的pH值保持在9.0,搅拌4 h。将反应液连续透析4 d,1 d换液2次。透析液保存于-20 ℃备用。将合成效果最好的CLE-HSA-RAC作为免疫原免疫小鼠,进行单克隆抗体制备工作,CLE-BSA-RAC作为包被抗原,合成方法同上。
1.3 单克隆抗体的制备
选择3只6~8周龄Balb/C健康雌性小鼠,首免用无菌生理盐水将免疫原CLE-HSA-RAC稀释成1 mg/mL,与弗氏完全佐剂等量乳化后对小鼠皮下注射[24],剂量为200 μg/只;之后每两周免疫一次,1 mg/mL免疫原CLE-HSA-RAC与弗氏不完全佐剂等量乳化,剂量为100 μg/只。第3次加强免疫后开始对小鼠眼静脉丛采血,检测血清效价。直到效价不继续升高时,用CLE-HSA-RAC对小鼠脾脏冲击免疫。冲击免疫后3 d,将脾脏细胞与SP2/0细胞融合。通过亚克隆筛选结合间接竞争ELISA方法筛选出稳定的单克隆细胞株。将其注射到小鼠体内,获得腹水。纯化腹水以获得特异性单克隆抗体。
1.4 单克隆抗体与二聚人工抗原最佳稀释倍数确定
采用间接竞争ELISA法确定单克隆抗体和CLE-RAC二聚体人工抗原的最佳稀释倍数。包被抗原CLE-BSA-RAC用包被液稀释成1∶4 000、1∶8 000、1∶16 000、1∶32 000四个梯度,100 μL/孔加到96微孔板中,4 ℃封闭过夜。单克隆抗体也稀释成1∶4 000、1∶8 000、1∶16 000、1∶32 000四个梯度,96微孔板中分别加入100 μL/孔的标准品和单克隆抗体,37 ℃反应1 h,洗板3次。加入二抗羊抗鼠IgG,100 μL/孔,37 ℃孵育30 min,加入TMB溶液显色,室温15 min。加入100 μL/孔的H2SO4,终止反应后检测OD450值。OD450值约为1.0时,可以确定包被抗原和单克隆抗体的最佳稀释倍数。
1.5 灵敏度的检测
用ELISA法检测灵敏度。根据1.4节测定的最佳稀释倍数,检测时加入CLE和RAC混合的标准品(CLE∶RAC=1∶1),与包被抗原CLE-BSA-RAC竞争结合单克隆抗体。加入的混合标准品质量浓度梯度为0.1 ng/mL、0.3 ng/mL、0.9 ng/mL、2.7 ng/mL和8.1 ng/mL。采用Origin 8.0软件,以结合率为纵坐标,质量浓度的对数值为横坐标拟合标准曲线。将抑制率为50%的混合物的质量浓度值定义为半数抑制浓度值(IC50)。将抑制率为10%(IC10)的CLE-RAC混合质量浓度值定义为最低检测限。
1.6 基于CLE-RAC特异性分析
在相同的实验条件下分别检测待测物CLE,RAC,PEAA,SAL,CLO,CIMB,BRO,TUL, MAP,CIM,MAB,ZIL,BAM,TER,CLEN的IC50值。设定CLE-RAC单克隆抗体与CLE的交叉反应率为100%,抗体的特异性通过将CLE的IC50值与其他β2-受体激动剂的IC50值的比值来确定。
1.7 样品前处理
猪尿取至离心管中,以7 500 r/min的速度离心6 min。用0.22 μm滤膜过滤上清液,除去少量杂质。每个孔中加入40 μL待测。
1.8 测定基质效应
根据1.7节对空白猪尿样品进行前处理,分别在尿液中添加9种0.3 ng/mL的β2-受体激动剂,重复检测5次。参照Wang等[25]计算方式,基质效应定义为基质因子,计算5次相同质量浓度的供试品溶液与对照品溶液之比的平均值,检测猪尿中9种药物的基质效应。基质因子可接受范围为85%~115%。
1.9 最低检测限和定量限
选择空白猪尿样品20份分别采用本研究建立的间接竞争ELISA方法检测,空白猪尿样品检验平均值加上3倍标准差定义为方法的最低检测限(Limit of detection, LOD),空白猪尿样品检验平均值加上6倍标准差定义为方法的最低定量限(Limit of quantitation, LOQ)。
1.10 准确度与精密度
空白猪尿分别添加0.5和1.0 ng/mL的CLE与RAC混合标准样品(质量比=1∶1),采用本研究ELISA方法检测猪尿中β2-受体激动剂的含量,每组重复6次,计算样品的回收率(%)衡量准确度。精密度以变异系数(CV,%)衡量,6块不同时间包被的酶标板,用同一种质量浓度的同一个样品进行检测,重复6次,统计计算板间CV值。同一时间包被的酶标板,用同一个样品添加不同质量浓度的标准品进行检测,重复6组,统计计算板内CV值。
1.11 LC-MS/MS比对
将不同质量浓度的CLE、RAC和CLE与RAC等质量比混合标准品分别添加至空白猪尿样品中,用本研究建立的方法和LC-MS/MS分别对样品进行检测,通过两种检测方法的相关性验证本研究建立方法的可靠性。
2 结果与分析
2.1 抗原抗体的表征
制备的CLE-BSA-RAC和CLE-HSA-RAC二聚人工抗原使用紫外-可见光谱扫描鉴定。从图1可见,CLE、RAC、BSA与HSA的特征吸收峰分别为294、275、278与279 nm处。与BSA偶联反应产生的偶联物CLE-BSA-RAC分别在279 nm和331 nm处有两个特征吸收峰。偶联物CLE-HSA-RAC分别在281 nm和332 nm处具有两个特征吸收峰。这表明2种偶联物特征吸收峰已发生偏移,由此判断CLE、RAC-NH2已同时与载体蛋白成功偶联。
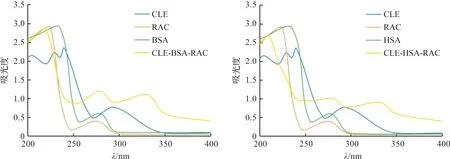
图1 CLE-RAC二聚人工抗原表征图Figure 1 Antigen characterization of CLE-RAC dimerization artificial antigen
对免疫小鼠产生的血清进行效价检测,如图2(a)所示。CLE-RAC-2小鼠效价最高,因此选取2号小鼠制备单克隆抗体。经过三轮亚克隆实验,筛选得到2D1、3C4和4C6等3个稳定分泌抗CLE-RAC的细胞系。如图2(b)所示,灵敏度最好的为细胞系2D1分泌的单克隆抗体,用于后续实验。

图2 小鼠抗血清效价和抗体亲和力鉴定结果Figure 2 Results of antiserum titer in mice and antibody affinity identification
2.2 单克隆抗体与二聚人工抗原最佳稀释倍数确定
结果如表2所示,随着稀释倍数的增加,OD450值不断减小。二聚人工抗原的最适稀释倍数为1∶8 000,单克隆抗体的最佳稀释倍数为1∶4 000。

表2 抗原包被度与抗体稀释倍数Table 2 Antigen coating and antibody dilution factor
2.3 灵敏度的检测
如图3所示,CLE、RAC、CLE-RAC的标准曲线的公式分别为y=-42.973x+44.624(R2=0.992 7),y=-44.224x+45.176(R2=0.984 4),y=-43.388x+45.003(R2=0.985),计算CLE、RAC单一药物和CLE与RAC等质量比混合药物的IC50值分别为0.75 ng/mL、0.77 ng/mL和0.77 ng/mL,最低检测限值分别为0.088 ng/mL、0.097 ng/mL和0.092 ng/mL。
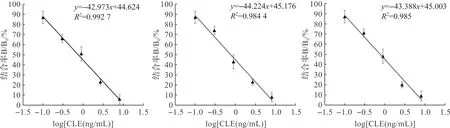
图3 间接竞争ELISA线性标准曲线Figure 3 Linear standard curve of indirect competitive ELISA
2.4 特异性试验
特异性结果如表3所示,有9种β2-受体激动剂的交叉反应率值大于16.97%,其余几种均低于0.1%,因此可以看出该方法能同时检测9种β2-受体激动剂。单克隆抗体识别抗原表位是对氨基苯乙醇胺结构。

表3 CLE-RAC单克隆抗体与其他β2-兴奋剂的交叉反应率
在本研究中发现,MAB的交叉反应率为97.40%,通过图4化学结构式看出,MAB与CLE结构式非常相似,因此交叉反应率高。其余有交叉的几种β2-受体激动剂几乎都有对氨基苯乙醇胺结构,所以也具有特异性。
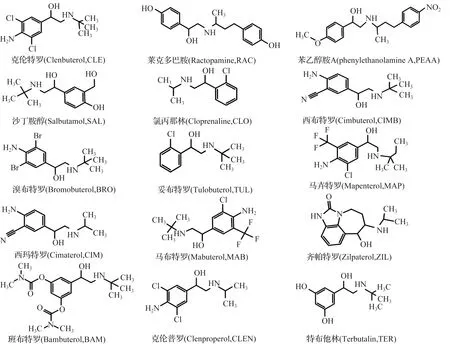
图4 β2-受体激动剂化学结构式Figure 4 Chemical structural formula of β2-agonists
2.5 基质效应
在ELISA分析中,样品前处理一般不需要严格的纯化和提取,但是基质干扰的存在可能会影响实验的灵敏度和重复性。由表4可得,9种β2-受体激动剂的基质因子为(87.9%±2.1)~(112.4%±2.3),在基质因子接受范围内,对结果影响较小。
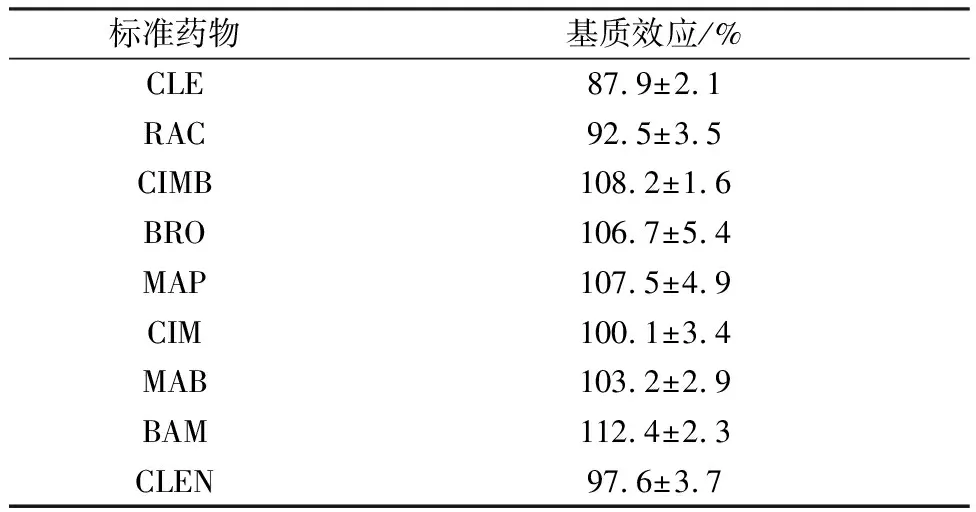
表4 9种β2-受体激动剂的基质效应(n=5)Table 4 Matrix effects of 9 β2-agonists(n=5)
2.6 最低检测限和定量限
本研究用ELISA法检测猪尿样品,测得的LOD值0.300 ng/mL,LOQ值0.513 ng/mL。
2.7 准确度和精密度
结果如表5所示,该方法检测的回收率为78.00%~117.88%。因此,本研究建立方法在检测实际样品时,回收率高,准确度也高。实际样品检测的板内CV小于13.73%,板间CV小于7.69%。结果表明,该方法用于实际样品检测时变异系数较低,检测结果较精密。

表5 阴性生猪尿样加标变异系数与平均回收率
2.8 LC-MS/MS比对
将CLE、RAC单一药物及CLE与RAC等质量比混合物分别添加到空白猪尿样品中,用LC-MS/MS和ELISA对其检测,计算两种方法的相关系数分析其相符性。结果如图5所示,以LC-MS/MS检测值为X轴,ELISA检测值为Y轴,得到线性回归方程分别为1)CLE单一药物:y=0.836 3x+0.183 5(相关系数R2=0.961,n=6);2)RAC单一药物:y=0.864 1x+0.065 3(相关系数R2=0.959 3,n=6);3)CLE与RAC等质量比混合药物:y=0.84x+0.072 7(相关系数R2=0.966 8,n=6)。在实际检测样品时,针对CLE、RAC单一药物和CLE与RAC等质量比混合药物,两种方法检测结果的相关系数分别为0.961、0.959 3和0.966 8,结果表明本研究建立的ELISA方法和LC-MS/MS方法有较好的相符性。
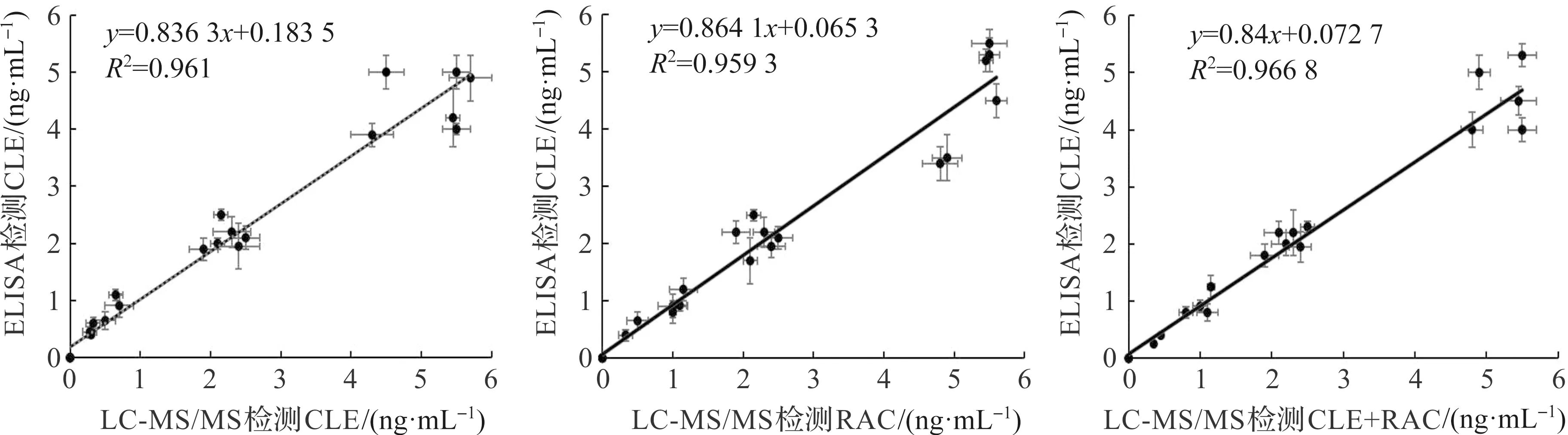
图5 间接竞争ELISA与LC-MS/MS比对检测结果Figure 5 Indirect competition ELISA and LC-MS/MS comparison test results
2.9 本研究与参考文献比较
由表6可以看出,本论文建立的基于二聚人工抗原ELISA检测β2-受体激动剂的方法,能同时检测苯酚型和苯胺型两大类β2-受体激动剂,检测限为0.092 ng/mL,检测水平基本可以达到检测单个β2-受体激动剂时的水平。因此,本方法可以为药物多残留检测提供一个新思路。

表6 同类检测方法比较Table 6 Comparison of similar detection methods
3 讨 论
β2-受体激动剂滥用,会在动物体内蓄积。食用受污染的动物组织会使药物进入人体从而危及健康。因此,对β2-受体激动剂药物残留检测尤为重要。一般来说,动物体内残留的β2-受体激动剂药物有两种类型,利用一次实验同时检测两个目标,对保障食品安全具有重要意义。
沈轩昂等人利用CLE单克隆抗体,结合金纳米材料,检测猪尿中CLE的线性范围为0.078~40 ng/mL,最低检测限为0.041 ng/mL[29]。宋清等人制备RAC单克隆抗体,定量分析结果显示,肉眼检测限为0.5 ng/mL,检测线性范围为0.05~2 ng/mL[30]。两种方法均只能检测单一药物残留。近年来,具有广泛特异性的免疫分析方法越来越多的受到关注。这类免疫分析方法具有检测样品数量多、分析效率高、成本费用低等显著特点[31]。因此,广谱特异性免疫识别已成为多种分析物同时筛选的首选方法。广谱特异性免疫测定需要针对所有目标分析物制备特异性抗体。利用通用半抗原产生广谱特异性抗体是最常用的方法。如Wang等[19]制备了针对CLE及其类似物的非特异性单克隆抗体,可以检测CLE及其类似物。这类方法仅针对一种类型的β2-受体激动剂具有特异性[32]。通用半抗原法虽然能在一定程度上提高β2-受体激动剂的单次检测数量,但仍不能同时检测两种类型的β2-受体激动剂。
本研究通过重氮化反应制备二聚体人工抗原,达到同时检测两类β2-受体激动剂的效果。结合间接竞争ELISA法,建立了一种同时测定苯胺型和苯酚型β2-受体激动剂的广谱特异性免疫分析方法。
4 结 论
本文采用兰尼镍还原法合成RAC-NH2,通过重氮化反应将CLE和RAC-NH2与载体蛋白偶联,得到二聚人工抗原。在此基础上,结合免疫小鼠和杂交瘤细胞技术获得CLE-RAC单克隆抗体,随后利用棋盘法确定最佳稀释倍数。建立的方法可以快速、高灵敏度地检测9种β2-受体激动剂。该方法不仅解决了传统实验中操作复杂、检出限低等问题,还突破了单次实验检出两类β2-受体激动剂的瓶颈。通过与LC-MS/MS方法比较,两种方法之间的相关性较高(R2>95%)。结果表明,本研究建立的基于二聚人工抗原的ELISA检测方法,具有灵敏度高、稳定性高、操作简单等优势,可用于实际样品检测,同时为食品安全检测提供了新思路。

