老年OSAHS患者Periostin、Adropin水平与睡眠呼吸参数、血管内皮功能、颈动脉IMT的关系
刘晓倩 陶赟臻 赵晓秋 柳江红
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)临床表现为睡眠时打鼾、经皮血氧饱和度(pulse oxygen saluration,SpO2)频繁降低、上气道塌陷阻塞等[1]。OSAHS发病机制复杂,与咽部结构缺陷、上气道病理解剖异常、肥胖、神经肌肉因素等有关[2]。研究发现OSAHS与心血管疾病发生有关,而心血管疾病的主要病理基础为动脉粥样硬化,血管内皮损害则会促进OSAHS发生,提示血管内皮功能紊乱可能参与OSAHS发生过程[3]。骨膜蛋白(Periostin)可激活NF-κB通路,介导血管内皮细胞炎症反应;抑制Periostin能减轻与氧化型LDL相关的人主动脉内皮细胞损害,提示Periostin与内皮细胞功能有关[4]。而内皮细胞功能与动脉粥样硬化发生有关,间接表明Periostin可能与动脉粥样硬化发生相关。能量平衡相关蛋白(Adropin)在肝脏、心脏、脐静脉、冠状动脉等均存在表达,它对维持能量代谢具有重要意义,其异常表达与心血管疾病发生有关[5]。基于此,本研究分析OSAHS患者血清Periostin、Adropin水平与睡眠呼吸参数、血管内皮功能、颈动脉内膜中层厚度(intima-media thickness,IMT)的相关性,以期为OSAHS诊疗提供参考,现报道如下。
1 对象和方法
1.1 对象 选取2017年5月至2021年5月张家口市第一医院收治的老年OSAHS患者113例,另择同期来本院体检的老年健康志愿者66名为对照组。OSAHS患者纳入标准:符合《阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)》[6]中关于OSAHS的诊断标准者;年龄≥60岁者;既往无OSAHS治疗史者;对本研究知情同意并自愿签署同意书者。对照组纳入标准:同期体检的老年健康志愿者;愿意配合完成相关实验室检查者;无打鼾习惯者,呼吸暂停低通气指数(apnea hypopnea index,AHI)<5次/h;对本研究知情同意并自愿签署同意书者。排除标准:肝、肾等脏器中重度不全者;恶性肿瘤者;长期使用安眠药、糖皮质激素等药物者;近3个月内有手术、创伤史者;就诊时伴急性/慢性感染者。OSAHS严重度评估标准:(1)轻度:AHI 5~15 次/h,最低 SpO285%~90%;(2)中度:AHI 16~30 次/h,最低 SpO280%~84%;(3)重度:AHI>30次/h,最低 SpO2<80%。OSAHS患者中轻度 34例(轻度组)、中度49例(中度组)、重度 30例(重度组)。4组研究对象性别、年龄、吸烟史、饮酒史、OSAHS家庭史、Epworth嗜睡量表评分[7]、OSAHS合并症比较差异均无统计学意义(均P>0.05),见表1。本研究经医院医学伦理委员会批准。

表1 4组研究对象一般资料比较
1.2 方法
1.2.1 血清Periostin、Adropin及血管内皮功能指标一氧化氮(nitric oxide,NO)、内皮素-1(endothelin-1,ET-1)水平检测 OSAHS患者在就诊当日采血,对照组健康志愿者在体检当日采血。采集空腹肘静脉血3 ml,离心10 min,3 000 r/min,分离血清,存至-80℃环境下备用。采用酶联免疫吸附法检测血清Periostin、Adropin、NO水平,试剂盒购自上海继锦化学科技有限公司(批号:S56109559)。利用放射免疫分析法检测ET-1水平,试剂盒购自北京北方生物技术研究所(批号:S20083014)。上述均为常规检测方法,严格根据试剂盒说明书完成各项操作。
1.2.2 OSAHS患者睡眠呼吸参数检测 在检测当日,患者禁烟酒、浓茶、咖啡等,采用多导睡眠呼吸监测仪(上海涵飞医疗器械有限公司,S-2000PSG型)。患者在就诊当日晚8:00~8:30进入实验室。监测仪共21个电极,从上至下放置,分别接脑电、眼电、下颌肌电、心电、口鼻流速、测鼾声以及接胸带、腹带、SpO2,确保皮肤与各电极之间接触良好。待所有电极接入完毕后进行校正,然后患者在放松状态下入睡,监测当日晚9:00至次日早6:00参数,监测指标包括夜间最长呼吸暂停时间(the longest apnea time,LAT)、AHI、夜间最低SpO2(lowest SpO2,LSpO2)、夜间平均SpO2(mocturnal mean SpO2,MSpO2)、夜间 SpO2低于 90%时间占总睡眠时间百分比(percentage of time when oxygen saturation lower than 90%,SLT90%)、觉醒指数。
1.2.3 OSAHS患者IMT检测 采用彩色超声仪(徐州市大为电子设备有限公司,DW-PF520型)测定患者颈动脉IMT。选择右侧颈动脉,在患者平稳呼吸15 min后取去枕仰卧位,头部偏于左侧,于右颈总动脉近心端距分叉10 mm部位测定IMT,取3次均值作为最终结果。1.3 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。计数资料以频数和构成比表示,组间比较采用χ2检验。相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 4组研究对象血清Periostin、Adropin水平比较轻度组、中度组、重度组、对照组血清Periostin、Adropin水平比较差异均有统计学意义(均P<0.05),且重度组患者血清Periostin水平>中度组>轻度组>对照组(均P<0.05),重度组患者血清Adropin水平<中度组<轻度组<对照组(均P<0.05),见表2。

表2 4组研究对象血清Periostin、Adropin水平比较
2.2 不同严重程度OSAHS患者睡眠呼吸参数比较轻度组、中度组、重度组患者 LAT、AHI、SLT90%、LSpO2、MSpO2、觉醒指数比较差异均有统计学意义(均P<0.05),且重度组患者 LAT、AHI、SLT90%、觉醒指数>中度组>轻度组(均 P<0.05),重度组患者LSpO2、MSpO2<中度组<轻度组(均P<0.05),见表3。
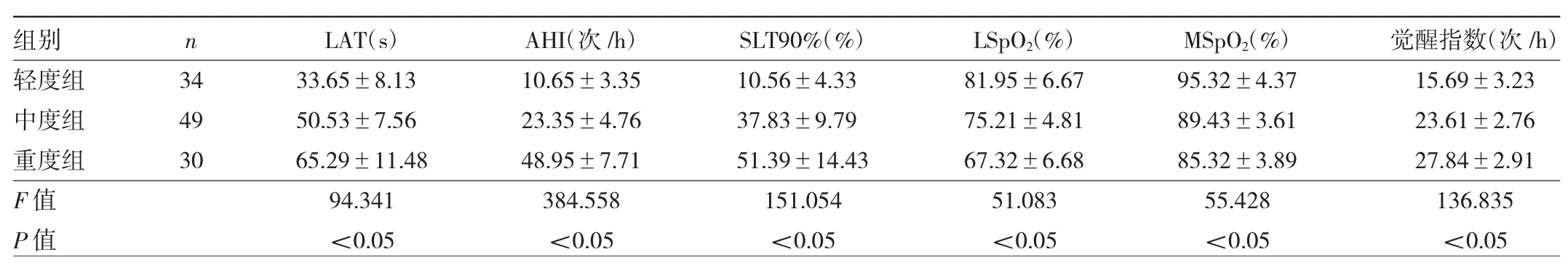
表3 不同严重程度OSAHS患者睡眠呼吸参数比较
2.3 不同严重程度OSAHS患者血管内皮功能指标、颈动脉IMT比较 轻度组、中度组、重度组患者血清NO、ET-1水平及颈动脉IMT比较差异均有统计学意义(均P<0.05),且重度组患者血清ET-1水平、颈动脉IMT>中度组>轻度组(均P<0.05),重度组患者血清NO水平<中度组<轻度组(均P<0.05),见表4。

表4 不同严重程度OSAHS患者的血管内皮功能指标与颈动脉IMT比较
2.4 OSAHS患者血清Periostin、Adropin水平与睡眠呼吸参数、血管内皮功能指标、颈动脉IMT的相关性分析 OSAHS患者血清 Periostin水平与 LAT、AHI、SLT90%、觉醒指数、ET-1水平、颈动脉IMT均呈正相关(均 P<0.05),与 LSpO2、MSpO2、NO 水平均呈负相关(均P<0.05)。OSAHS患者血清 Adropin水平与LAT、AHI、SLT90%、觉醒指数、ET-1 水平、颈动脉 IMT均呈负相关(均 P<0.05),与 LSpO2、MSpO2、NO 水平均呈正相关(均P<0.05),见表5。
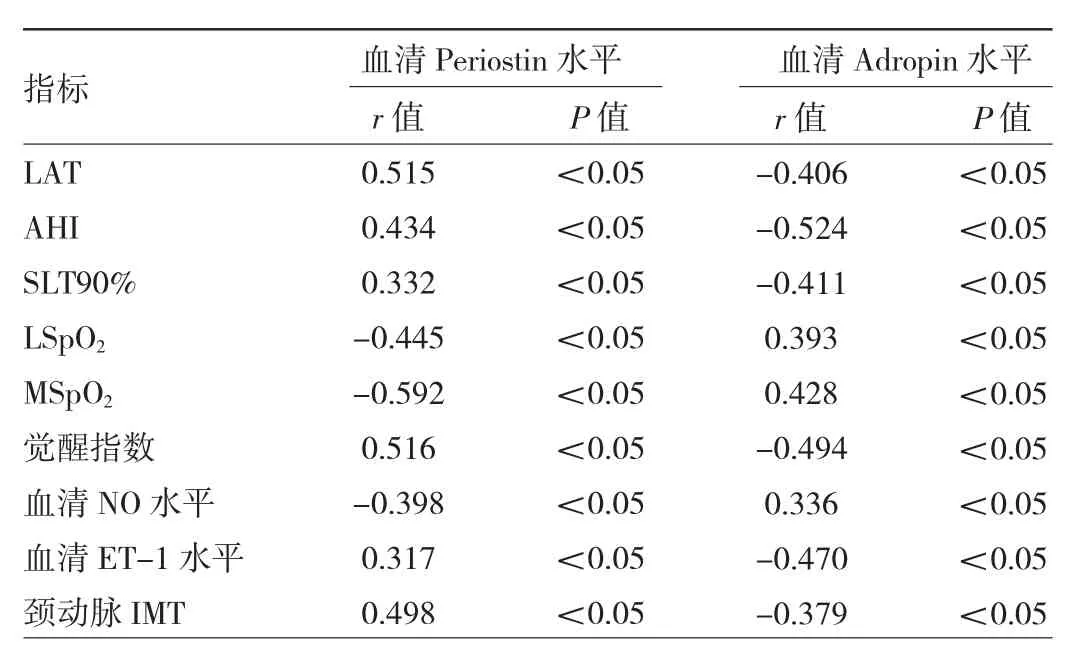
表5 OSAHS患者血清Periostin、Adropin水平与睡眠呼吸参数、血管内皮功能指标、颈动脉IMT的相关性分析
3 讨论
OSAHS是指人在睡眠状态下因上气道塌陷阻塞所致的通气不足、呼吸暂停现象,可引起睡眠结构紊乱、SpO2下降、打鼾等症状[8]。患者上气道阻塞气流受限,可因打鼾症状致颈动脉受到震动并诱发炎症,促使颈动脉内膜厚度增加。通过观察颈动脉IMT,可能对评估OSAHS病情有益[9]。研究发现OSAHS与心血管事件的发生密切相关,患者因存在间歇性缺氧,可诱发血管内皮功能损害,致血管受损,增加心血管疾病发生风险[10]。任佩欣等[11]研究指出Periostin具有高度保守性,在心肌纤维化、血管损伤发生与进展中具有重要作用。冯利娟等[12]则认为Adropin对机体代谢、血管内皮功能均有调节作用,它在冠状动脉内皮细胞内存在表达,对NO生成有促进作用,能保护血管内皮细胞。分析Periostin、Adropin与OSAHS的关系可能对OSAHS诊疗有益。
本研究结果发现,与对照组相比,不同病情程度OSAHS患者的血清Periostin水平升高,而Adropin下降,随着病情加重,Periostin升高以及Adropin下降越明显。OSAHS患者机体处于慢性炎症状态,睡眠时易缺氧,会加重炎症与氧化应激,促进动脉粥样硬化发生和进展[13]。而Periostin蛋白与动脉粥样硬化发生具有密切关联,它在不稳定斑块及受损血管内膜中可见表达,可能通过调节血管生长因子介导粥样硬化斑块形成,引起血管内皮细胞损害[14]。Periostin可能通过参与OSAHS患者的动脉粥样硬化影响病情。Adropin是急性心肌受损的标志物,在心血管系统内可见表达,能调节胰岛素抵抗以及脂质代谢,控制动脉硬化发生风险,且还可激活RISK信号通路,缓解心肌损伤[15]。OSAHS患者血清Adropin水平下降可能与其血管内皮受损程度有关,OSAHS病情越严重,血管内皮损害也相应加重,而Adropin作为血管内皮的保护指标,其表达相应下降。
睡眠呼吸结构紊乱是OSAHS的常见表现,主要因上气道塌陷阻塞引起[16]。本结果显示随着OSAHS病情加重,患者的 LAT、AHI、SLT90%升高,LSpO2、MSpO2降低。OSAHS 患者可通过 LSpO2、MSpO2以及 LAT、AHI、SLT90%判断缺氧程度,上述指标异常越明显表明缺氧越重。郑洪飞等[17]发现OSAHS患者在未接受治疗情况下AHI增高,且病情越重AHI越高,进一步证实OSAHS患者伴有睡眠结构紊乱。本研究发现OSAHS越严重则ET-1水平、颈动脉IMT越高,NO水平越低,提示患者伴有血管内皮功能紊乱。ET-1是内源性缩血管物质,血管内皮一旦受到缺氧、缺血等损害,则致ET-1、NO释放处于失调状态,两者失衡可破坏机体对血管内皮的保护机制,损伤血管内皮功能[18]。颈动脉IMT是血管内皮功能受损的重要指标,在颈动脉出现炎症时可见增高[19]。本研究提示OSAHS患者颈动脉IMT增加,表明其存在明显的血管内皮功能损害。本研究亦发现OSAHS患者血清Periostin、Adropin水平与睡眠呼吸参数、血管内皮功能指标有相关性。Periostin可能通过诱导新生血管生成,破坏血管内皮完整性,损害血管内皮功能[20]。而Adropin则对血管内皮功能有保护作用,其水平增高能保护内皮细胞,反之水平降低则会破坏机体对血管内皮细胞的保护机制,导致病变加重[21]。Periostin可致血管内皮功能受损,而Adropin则对其有保护作用,两者可能通过影响血管内皮功能状态,增加或降低硬化斑块形成风险,影响OSAHS患者病情。
综上所述,老年OSAHS患者血清Periostin水平升高且Adropin水平下降,两者水平变化受OSAHS严重程度的影响,与睡眠呼吸参数、血管内皮功能紊乱、颈动脉IMT密切相关。本研究局限性为老年患者多伴有基础疾病,可能对研究数据有一定影响,未来还需更加严格把控纳入病例,更深入分析Periostin、Adropin对OSAHS病情的影响。

