基于氧化应激通路的朱砂肾毒性机理研究及针灸对氧化应激的缓解作用
胡英华,贾炳超,尚 鑫,于立清,孙 波*
(1.长春中医药大学,长春 130117;2.长春健康职业学院,长春 130012)
朱砂的毒性主要源于包括汞在内的某些成分在肾脏的蓄积而引起的肾脏功能减退,乃至衰竭[1-2]。由于这种蓄积随着年龄的增长而增加,所以,朱砂肾毒性机理的研究对于老年人尤为重要。由于细胞凋亡的进程受到多种细胞信号通路的调控[3],但前期研究结果排除了朱砂肾毒性对JNK通路、Caspase-9介导的线粒体信号通路等的影响,同时考虑到重金属汞离子可以与谷胱甘肽的巯基结合而影响谷胱甘肽在血液中或脏器中的水平,因此本实验将朱砂的肾毒性锁定在与谷胱甘肽水平相关的氧化应激通路[4-5]。
前期的MTT实验与HE实验研究结果已经证明,朱砂以及Hg2+和HgS,经连续给药后均会在不同程度上导致肾脏的病变,并且病变程度与剂量呈同向变化规律,所以,本研究以SD大鼠为研究对象,将这些物质对血液与肾脏中的谷胱甘肽及谷胱甘肽过氧化物酶的影响作为指标,进一步研究朱砂的肾毒性机理。
研究表明,针灸某些穴位可以提高肝脏组织中的谷胱甘肽水平及谷胱甘肽过氧化物酶的活性[6-8],考虑到肾脏与肝脏之间存在精与血之间相互滋生和相互转化的关系,本实验设置了针灸对照组,以此来研究针灸对氧化应激的缓解作用。
1 实验材料
1.1 实验设备
Sigma台式高速冷冻离心机;组织匀浆机江苏金坛江南仪器厂;Mettler Toledo AL204电子分析天平(万分之一)Agilent 1260高效液相色谱仪美国安捷伦通用仪器有限责任公司;电子分析天平(十万分之一)梅特勒-托利多仪器(上海)有限公司;TD4台式低速离心机;南凯达科学仪器有限公司(4 000 r/min);ODS高效液相色谱柱大连依利特分析仪器有限公司;Sigma台式高速冷冻离心机德国Sigma公司3K15;FA1004B型电子天平上海佑科仪器仪表有限公司;19686酶标仪美国BIO-RAD伯乐公司。
1.2 实验药剂
水飞朱砂(批号:20141213)安国市药材天然粉贸易有限公司;硫化汞(分析纯)(批号:20160503)北京化工厂;柠檬酸钠(分析纯)(批号:20160708)北京化工厂;乙腈(色谱纯)(批号:20160205)Fisher实验器材有限公司;氢氧化钠(分析纯)(批号:20150107)北京化工厂;高氯酸(分析纯)(批号:20161126)天津市鑫源化工有限公司;甲醇(色谱纯)(批号:20151117143)山东禹王实业有限公司化工分公司;磷酸氢二钾(分析纯)(批号:201504021)西陇化工股份有限公司;氯化钠(分析纯)(批号:20160105)北京化工厂;EDTA(分析纯)(批号:20160105)天津天泰精细化学品有限公司;硝酸(优级纯)(批号:20150508) 北京化工厂;DTNB标准品(批号:D218200)SIGMA-ALDRICH公司;谷胱甘肽标准品(批号:G4251)SIGMA-ALDRICH公司;GSH-P测试盒(批号:20180116);南京建成生物工程研究所。
2 实验方法与结果
将饲养1周的80只CL级SD大鼠(雌雄各半)按照性别随机平均分为10组,每组为8只。第1组为雄性空白对照组,第2组为雌性空白对照组,第3组为雄性朱砂(饱和溶液)实验组,第4组为雌性朱砂实验组,第5组为雄性HgS(饱和溶液)实验组,第6组为雌性HgS实验组,第7组为雄性HgCl2实验组,第 8 组为雌性 HgCl2(30 μg·mL-1)实验组,第9组为雄性HgCl2+针灸实验组,第10组为雌性HgCl2+针灸实验组。各组实验大鼠每天称重1次,并按其实际体质量给药(0.01 mL·g-1),每天给药2次,早上9点开始,晚上18点开始,第9、10组每天中午12点针灸肾俞和足三里1次。于第16天早上,先经眼眶取血,随后立即颈椎脱臼处死,并迅速取出肾脏称重,备用。
2.1 肾脏组织及血液中谷胱甘肽水平变化的实验研究
2.1.1 肾脏组织中谷胱甘肽水平变化的实验研究 取1/2肾脏,按5:1(V:W)比例将冷藏的A液加入肾脏中,用组织匀浆机制成匀浆,并转移到1.5 mL EP管中,用Sigma台式高速冷冻离心机在-4 ℃下、以14 000 r·min-1的转速离心15 min。取上清液适量,按1:3(V:V)比例加入冷藏的B液,涡旋振荡3 min,然后加入0.5 mL DTNB,涡旋振荡10 min,于4 000 r·min-1离心10 min,定量取上清液 500 μL,按 10:1(V:V)加入 2 mol·L-1的氢氧化钠溶液调节pH,用针式滤器过滤后取10 μL于高效液相色谱仪检测。实验结果见表1、图1。
表1 各肾脏谷胱甘肽含量(±s,n=8) μg·g-1
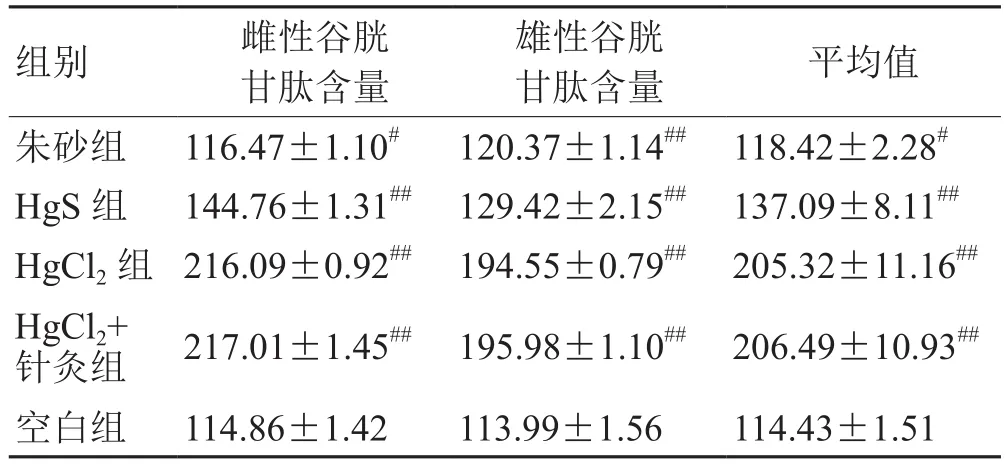
表1 各肾脏谷胱甘肽含量(±s,n=8) μg·g-1
注:与空白组比较,# P<0.05,## P<0.01
组别 雌性谷胱甘肽含量雄性谷胱甘肽含量 平均值朱砂组 116.47±1.10# 120.37±1.14## 118.42±2.28#HgS 组 144.76±1.31## 129.42±2.15## 137.09±8.11##HgCl2组 216.09±0.92## 194.55±0.79## 205.32±11.16##HgCl2+针灸组 217.01±1.45## 195.98±1.10## 206.49±10.93##空白组 114.86±1.42 113.99±1.56 114.43±1.51
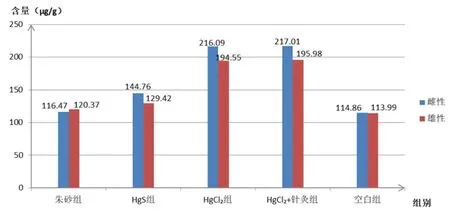
图1 各组肾脏中谷胱甘肽含量
由表1和图1可以看出,经连续给药后,无论对于雄性大鼠,还是雌性大鼠而言,各实验组大鼠肾脏组织中的谷胱甘肽含量相对于空白对照组来讲,均有所升高,而且这种变化具有显著性差异(#P<0.05,##P<0.01)。其中,HgCl2+针灸实验组大鼠肾脏组织中的谷胱甘肽含量的升高最显著,HgCl2实验组、HgS实验组、朱砂实验组大鼠肾脏组织中的谷胱甘肽含量的升高幅度依次减小。
2.1.2 谷胱甘肽标准曲线的制备 精密称取5 mg的谷胱甘肽标准品,溶解并定量转移至25 mL容量瓶中,用pH=7.50的PBS定容,制成浓度为200 ug·mL-1的母液。分别吸取0.2 mL、0.8 mL、1.5 mL、2.5 mL、3.5 mL、4.5 mL至10 mL的容量瓶中,用pH=7.50的PBS定容,分别取不同浓度的谷胱甘肽溶液500 μgL,按1:1(V:V)加入DTNB溶液,静置10 min,用针式滤器过滤后取10 μL于高效液相色谱仪检测其含量,经线性拟合得标准曲线:Y=20.149 45X+ 0.555 25(R2=0.999 99)其中:Y为吸光度,X为浓度。
2.1.3 谷胱甘肽高效液相色谱条件 以0.9%甲酸水溶液(用NaOH调pH=5.20)与6%四氢呋喃乙腈溶液为流动相,流速0.8 mL·min-1,柱温35 ℃,检测波长326 nm,进样后按照表2进行梯度洗脱。

表2 谷胱甘肽高效液相色谱条件梯度洗脱时间表
2.1.4 特殊试剂配制 1)A液的配制:取21 mL高氯酸,用去离子水定容100 mL。2)B液的配制:精密称定6.846 6 g磷酸氢二钾、0.074 5 g乙二胺四乙酸二钠、0.588 2 g柠檬酸钠,加去离子水溶解,配制成100 mL溶液。3)DTNB的配制:精密称定8.953 5 g十水合磷酸氢二钠,制成250 mL去离子水溶液,并用柠檬酸调PH至7.50,备用。精密称定0.198 2 g的DTNB,加入适量上述磷酸盐溶液制成100 mL溶液。
2.1.5 血液样品的制备及谷胱甘肽含量的测定 将经眼眶取出的800 μL血置于2 mL EP管中,按1:1(V:V)加入800 μL的DTNB溶液,离心(4 000 r·min-1)10 min,取上清液适量并按10:1(V:V)比例加入冷藏的A液,涡旋振荡5 min,于4 000 r·min-1再离心10 min,取10 μL上清液于高效液相色谱仪测其谷胱甘肽含量。实验结果见表3、图2。
表3 各组血液中谷胱甘肽含量(±s,n=8) μg·g-1

表3 各组血液中谷胱甘肽含量(±s,n=8) μg·g-1
组别 雌性谷胱甘肽含量雄性谷胱甘肽含量 平均值朱砂组 5.78±0.75 5.93±0.59 5.86±0.65 HgS 组 5.59±0.85 6.01±0.74 5.80±1.19 HgCl2组 5.90±0.52 5.82±1.03 5.86±1.80 HgCl2+ 针灸组 5.82±0.72 5.97±0.97 5.80±0.75空白组 5.34±1.46 5.75±1.87 5.55±1.48
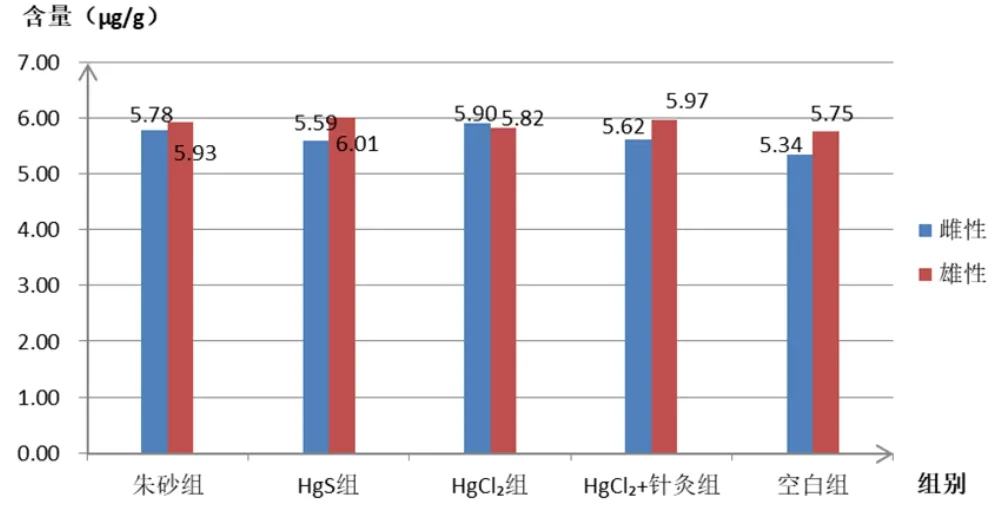
图2 各组血液中谷胱甘肽含量
由表3和图2可以看出,经连续给药后,无论是雄性大鼠,还是雌性大鼠,各实验组大鼠血液中的谷胱甘肽水平相对于空白对照组来讲均无明显变化(P>0.05)。
2.2 肾脏组织中谷胱甘肽过氧化物酶的活力的实验研究
2.2.1 肾脏样品的制备及谷胱甘肽过氧化物酶的活力的测定 将2.1.1余下的1/2肾脏称重,并按1:8(W:V)比例加入冷藏的生理盐水,用组织匀浆机制成匀浆,然后转移到1.5 mL EP管中,于-4℃、3 000 r·min-1的条件下离心15 min,取出上清溶液,备用。
取5 μL,加入酸性染色液5 mL,静置10 min后,用酶标仪于595 nm的波长下测定吸光度,并据此分析样品中总蛋白的含量。
另取上清液0.1 mL,按下表加入试剂盒中的试剂1与试剂2。

?
混匀,-4℃、4 000 r·min-1离心10 min,取上清液1 mL,并按下表加入试剂盒中的试剂3~5作显色反应。
?
混匀,室温静置15 min,待显色反应达成平衡后,用酶标仪于412 nm波长下测量其吸光度,并据此分析谷胱甘肽过氧化物酶的活力,结果见表4、图3。
表4 各组肾脏谷胱甘肽过氧化物酶酶活力(±s,n=8)
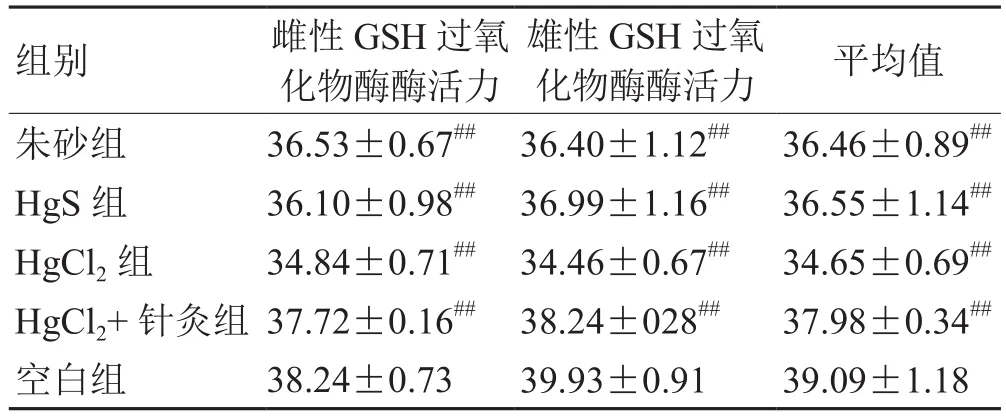
表4 各组肾脏谷胱甘肽过氧化物酶酶活力(±s,n=8)
注:与空白组比较,## P<0.01
组别 雌性GSH过氧化物酶酶活力雄性GSH过氧化物酶酶活力 平均值朱砂组 36.53±0.67## 36.40±1.12## 36.46±0.89##HgS 组 36.10±0.98## 36.99±1.16## 36.55±1.14##HgCl2组 34.84±0.71## 34.46±0.67## 34.65±0.69##HgCl2+针灸组 37.72±0.16## 38.24±028## 37.98±0.34##空白组 38.24±0.73 39.93±0.91 39.09±1.18
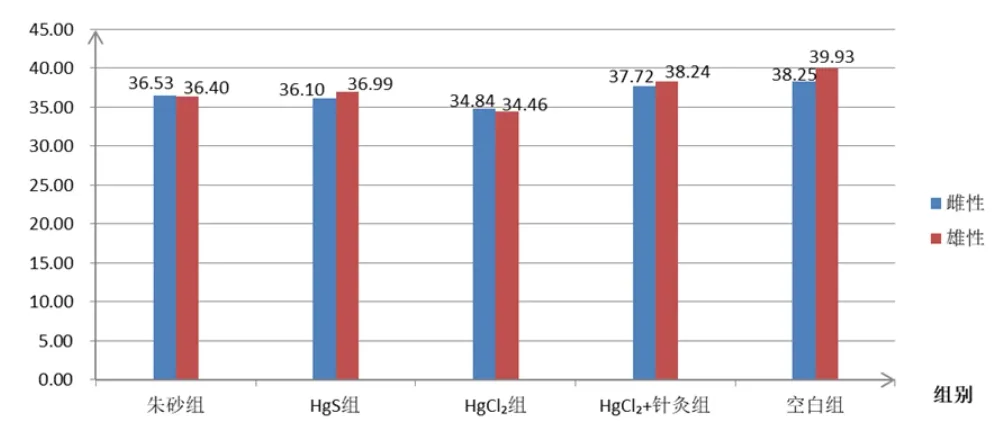
图3 各组谷胱甘肽过氧化物酶酶活力测定数据
由表4和图3可以看出,经连续给药后,无论对于雄性大鼠,还是雌性大鼠而言,各实验组大鼠肾脏组织中的谷胱甘肽过氧化酶活力均有明显降低,而且这种变化还具有显著性差异(##P<0.01)。其中,HgCl2实验组大鼠肾脏组织中的谷胱甘肽过氧化酶活力的降低最显著,HgS实验组、朱砂实验组、HgCl2+针灸实验组谷胱甘肽过氧化酶活力下降值依次减小。
2.2.2 标准蛋白曲线的制备 精密称定牛血清白蛋白2 mg,加去离子水制成0.2 mg·mL-1的母液。再精密量取0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL,分别置于5 mL的EP管中,加去离子水至总体积为1 mL,分别再加入G-250试剂(酸性染色液)5 mL,立即混匀,静置10 min后以1号的EP管为空白对照,在595 nm的波长处测定吸光度。以X表示总蛋白含量为横坐标,Y表示吸光度值,得线性回归方程:Y=0.002 5X+ 0.208(R2=0.997 6)
3 讨论
经过长期的对朱砂毒性研究,几乎所有的参与者都达成了这样的共识,给予实验动物的供试品中,可溶于水的Hg2+含量越高,经连续给药后,实验动物肾脏组织中Hg2+的含量就会越高。这一结论可以从生物药剂学与药物动力学理论中找到依据,因为朱砂中的主要毒性成分汞是以可溶于水的Hg2+形式、按照微孔途径的被动转运机理透过胃肠道生物膜而被吸收进入血液,并以同样的转运机理分布于包括肾脏在内的机体相关组织中,所以,供试品中Hg2+的浓度与实验动物肾脏组织中Hg2+的含量成正比。然而,与这一结果相符的应该是“肾脏组织中Hg2+的含量越高,谷胱甘肽的水平就应该越低”,因为谷胱甘肽可以与包括Hg2+在内的重金属离子形成配合物而排出体外。但是,这一推测显然不符合表1和图1中的数据显示的实验结果。
成熟的理论表明,谷胱甘肽以还原型(GSH)及其氧化型(GSSG)两种形式广泛存在于哺乳动物、植物和微生物细胞内,并以GSH/GSSG比例远超过10:1来维持生物或植物的氧化系统与抗氧化系统的平衡,以此将活性氧(ROS)控制在较低的水平,使之精密地调节细胞的分化、增殖、凋亡、转化、癌变及基因的表达。当GSH/GSSG比例明显减小时,活性氧(ROS)的水平就会升高,其调节功能亦随之而降低,从而使细胞受到损伤。由此可以推测,肾毒性最强的HgCl2组肾脏组织中的谷胱甘肽水平应该最低。这样推测的结果显然也与表1和图1中数据显示的实验结果不相符。
表4 和图3实验数据显示,谷胱甘肽过氧化酶(GPX4)活力的实验结果给出了上述两个问题的答案。谷胱甘肽过氧化物酶活性是谷胱甘肽还原体内脂质氧化物的重要标志,其活性高,表明有足够量的还原型谷胱甘肽参与机体的正常生理活动;而其活性低则表明谷胱甘肽没有作为还原剂起到还原作用,GSH/GSSG比例明显下降,使得GSH没有作为还原剂来维持氧化系统与抗氧化系统的平衡。在一般的生理环境下,还原型谷胱甘肽所占的比例减小的原因无非就是形成了氧化型谷胱甘肽。然而,在Hg2+存在的条件下,还原型谷胱甘肽还可以其巯基上的孤对电子向Hg2+的空d轨道配位,形成了比较稳定的配合物。而这种配合物的形成无疑会导致游离型谷胱甘肽的减少,进而造成肾脏的氧化应激性损伤。
按照一般规律,重金属离子与谷胱甘肽结合后便会排出体外,也正因为如此,各实验组大鼠血液中的谷胱甘肽水平均应该低于对照组。然而,生成于肾细胞内部的这种配合物却很难以被动转运的方式排出体外,所以才导致了与谷胱甘肽生成配合物的Hg2+在肾脏的蓄积。由于这种蓄积影响了细胞的正常的内部环境,因而也是导致肾细胞死亡的重要因素之一。
由实验结果可以看出,虽然HgCl2+针灸实验组大鼠肾脏的谷胱甘肽水平基本同于HgCl2实验组,但是HgCl2+针灸实验组大鼠肾脏的谷胱甘肽过氧化酶活性却仅低于对照组。这一实验结果表明,虽然HgCl2+针灸实验组大鼠肾脏的谷胱甘肽总量与HgCl2实验组大鼠肾脏的谷胱甘肽总量相近,但HgCl2+针灸实验组大鼠肾脏游离的谷胱甘肽所占的比例较高。由此可见,针灸刺激某些特殊穴位,如肾俞和足三里,可以提高谷胱甘肽过氧化物酶的活力,增强活性氧对谷胱甘肽的竞争力,同时减少谷胱甘肽与Hg2+形成配合物的比例,这无疑会在一定程度上促进谷胱甘肽作为还原剂参与肾脏细胞内的氧化还原反应,进而对朱砂以及Hg2+造成的氧化应激起到一定的缓解作用。这一研究结果为临床上采用针灸方法对抗连续使用含有朱砂的制剂引起的肾脏损伤提供了依据。

