FCGBP 在头颈鳞状细胞癌中的表达和免疫功能分析
曹宇杰,沈志森,叶栋,陈佳意
有研究发现IgG-Fc 片段结合蛋白(FCGBP)在多种肿瘤发生、进展中起着重要作用,且与多种肿瘤的免疫细胞浸润相关。在结直肠癌中,特别是在转移性组织中,FCGBP 被发现高表达,并且FCGBP 的表达增加显著降低了结直肠癌患者的整体生存率[1]。而在胆囊癌中,FCGBP的表达相较于正常组织降低,并且是肿瘤生长因子1(TGF-1)诱导的上皮间充质转换的关键调节因子[2]。还有研究发现FCGBP在前列腺癌中低表达,且与疾病进展有关[3]。然而FCGBP 在头颈鳞状细胞癌(HNSC)中的作用和机制尚不清楚,本研究评估了FCGBP 在HNSC中的表达情况及其与预后的相关性,并初步探究FCGBP 与HNSC 免疫细胞浸润的关系。现报道如下。
1 资料与方法
1.1 材料 从癌症基因组图谱(TCGA)数据库(https:/cancergenome.nih.gov//)下载基因转录组测序数据共544 例,其中499 例HNSC肿瘤组织数据,45 例正常组织数据。对每例肿瘤样本下载对应相关临床数据进行分析,包括年龄、性别、肿瘤分级、T 分期、N 分期和临床分期。人HNSC 标本15 例(在距肿瘤病灶边缘>0.5 cm 处解剖)均来自在宁波大学附属李惠利医院住院并接受手术的患者,由病理医师盲检后确认为肿瘤或癌旁正常组织,并获得本院医学伦理委员会批准。
1.2 方法
1.2.1 FCGBP表达水平、临床预后和通路富集分析 采用R 软件(3.5.1 版本)分析FCGBP 在499 例HNSC 肿瘤组织和45 例正常组织中的表达水平差异并作图,使用R 软件“survival”包进行Cox风险回归分析和生存曲线分析。使用“clusterProfiler”包的gseKEGG 函数进行基因集富集分析(GSEA)。
1.2.2 免疫组织化学染色与分析 采用甲醛固定手术切除的HNSC肿瘤及邻近组织,石蜡包埋后切成4 m 厚的切片,再用二甲苯和乙醇脱蜡。将切片在柠檬酸钠缓冲液(pH值6.0)中120℃煮沸20min,进行抗原修复,然后在3% H2O2中室温孵育10 min 以阻断内源性过氧化物酶。再将切片与FCGBP 兔单克隆抗体[Ab cam(Ab121202),Cambridge,UK]进行免疫反应,然后与二抗一同孵育。切片用二氨基联苯胺(Sigma,Cat No.ZLI-9018)溶液显色,苏木精复染,用各种浓度的酒精脱水后封片。在显微镜下观察FCGBP 免疫反应切片并由病理学医师解释。
1.2.3 免疫细胞浸润分析 采用由Newman 等[4]开发的CIBERSORT 软件计算基于基因表达数据的特定组织中的细胞组成,并评估目标细胞丰度。本研究利用R 软件对下载的HNSC 肿瘤组织数据进行筛选和矫正,然后使用CIBERSORT软件评估22 种免疫细胞浸润水平。利用R 软件统计FCGBP 表达量和免疫细胞浸润水平的相关性并绘图。
1.3 统计方法 采用R 软件及CIBERSORT 软件进行数据分析,计数资料采用2检验和Fisher 精确检验,并采用单因素及多因素Cox 回归分析。P <0.05为差异有统计学意义。
2 结果
2.1 FCGBP 在HNSC 中的表达分析FCGBP 在HNSC 肿瘤组织中低表达(封四彩图1),FCGBP 低表达水平的HNSC患者OS 较差(P <0.001),预后不佳(封四彩图2)。进一步选择了3 种类型的HNSC肿瘤组织(舌癌5 例、喉癌5 例、下咽癌5例)和配对癌旁组织进行免疫组化实验,结果显示FCGBP在HNSC肿瘤组织中染色强度显著降低(封四彩图3)。

图1 正常组织和HNSC 肿瘤组织的FCGBP 表达水平
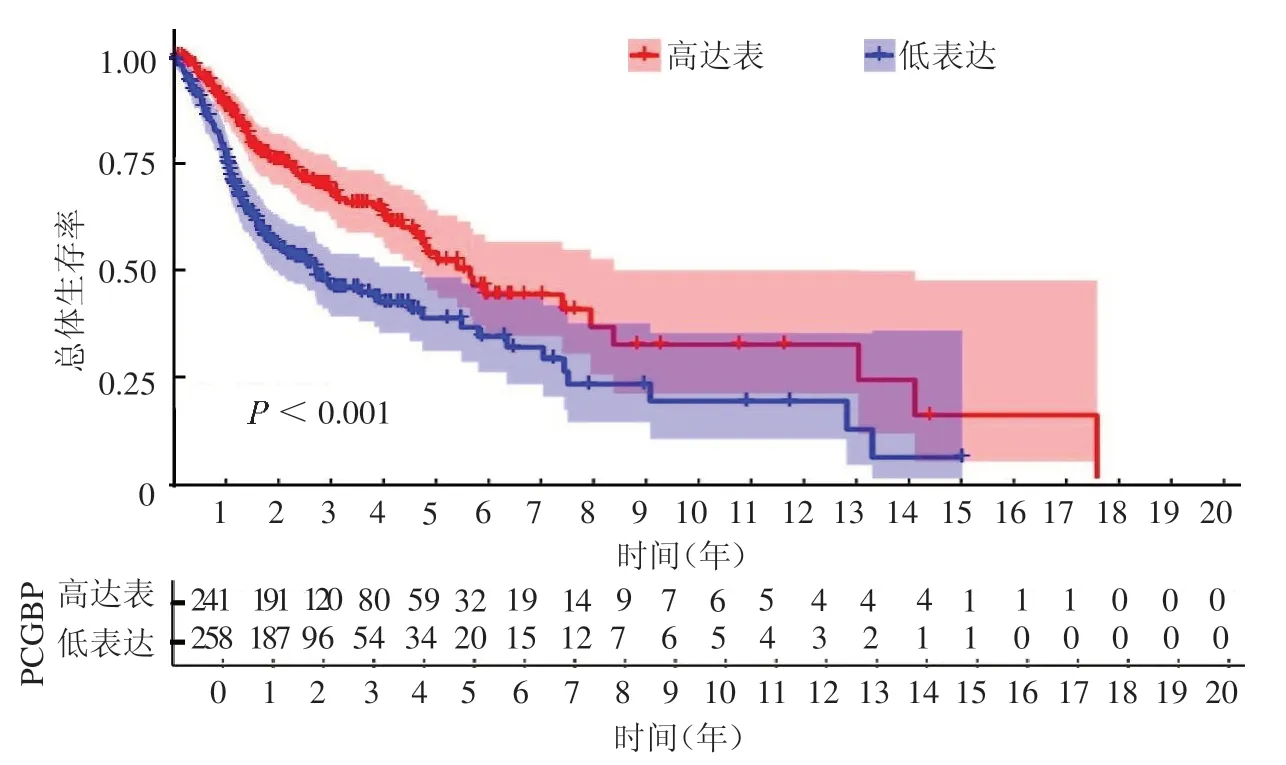
图2 不同FCGBP 表达水平的HNSC 生存率
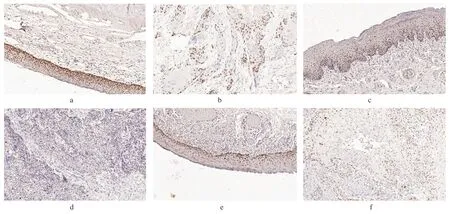
图3 舌癌、喉癌、下咽癌肿瘤组织和癌旁正常组织的免疫组化染色结果(envision 二步法,×20)
图4 不同FCGBP 表达水平的HNSC 患者年龄、性别、病理分级、T 分期、N 分期、临床分期的分布情况
2.2 FCGBP 表达水平及其与HNSC 患者临床病理因素的相关性 FCGBP 的表达水平与HNSC 患者的T 分期及临床分期有关(封四彩图4)。相较于FCGBP 高水平表达组,在FCGBP 低水平表达组中,更高级别T 分期的HNSC患者比例明显增加(P=0.02),更高级别临床分期的HNSC患者比例也明显增加(P=0.009)(图1)。单因素Cox 回归分析显示,FCGBP 表达量、年龄及临床分期是影响预后的危险因素,见表1。多因素Cox 回归分析显示,FCGBP 表达量、年龄及临床分期是影响HNSC 患者预后的独立危险因素,见表2。
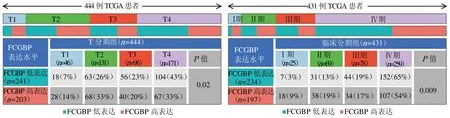
图1 FCGBP 表达水平与HNSC 患者T 分期和临床分期相关

表1 影响HNSC 患者生存的预后因素的单因素Cox 回归分析

表2 影响HNSC 患者生存的预后因素的多因素Cox 回归分析
2.3 FCGBP 在HNSC 中的GSEA 分析
在前10 条富集通路中发现有多条通路可能与免疫细胞相关,如细胞黏附分子、T细胞受体信号通路、B细胞受体信号通路、细胞因子及细胞因子受体相互作用通路。
2.4 FCGBP 与HNSC 中免疫细胞浸润相关性 与FCGBP 低表达组相比,在FCGBP 高表达组中,幼稚B 细胞、浆细胞、滤泡辅助性T 细胞(Tfh)、调节性T细胞(Tregs)、静息树突状细胞及静息肥大细胞浸润水平较高,而CD8+T 细胞、静息NK 细胞、M0 巨噬细胞、M2 巨噬细胞、嗜酸性粒细胞及中性粒细胞浸润水平较低。见图2。
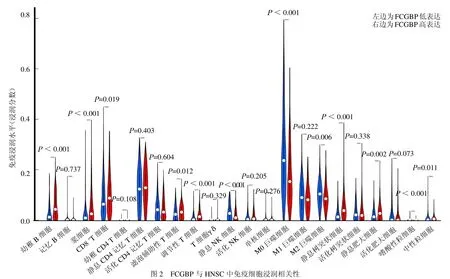
图2 FCGBP 与HNSC 中免疫细胞浸润相关性
3 讨论
相较于正常组织,FCGBP 在HNSC肿瘤组织中低表达,并利用免疫组化实验证实了这一发现。据报道,在结肠癌中,与非转移性组织相比,FCGBP 在转移性组织中表达下调[5]。在骨肉瘤中,FCGBP 也被发现在肿瘤组织中表达下调。Wang 等[6]关于FCGBP 的泛癌研究发现,FCGBP在HNSC等7 种肿瘤组织中低表达,而在乳腺癌等14 种肿瘤中高表达,不同肿瘤类型中FCGBP的表达水平差异可能反映了不同的作用机制。本研究进一步发现 FCGBP 低表达与HNSC 患者的不良预后有关。临床病理因素分析表明,FCGBP 表达水平、年龄和临床分期与HNSC 患者预后相关,并且是独立的预后影响因子。这些结果提示FCGBP具有生物标志物的潜力,并可能作为HNSC 的保护因子。还有研究发现在HPV 感染的HNSC 患者中FCGBP表达水平上调,推测FCGBP 还与HPV感染有关,并且其上调与患者较长的生存时间相关[7]。GSEA 的KEGG 通路分析结果显示FCGBP 参与了多种免疫相关信号通路,这提示FCGBP可能在调节肿瘤免疫中起关键作用。
B细胞(也称B淋巴细胞)可生成抗体,充当抗原呈递细胞,并分泌细胞因子。Naive B 细胞可发育成为其他成熟B 细胞。浆细胞是终末分化的B 淋巴细胞,可构成性地分泌抗体,提供针对病原体的保护[8-9]。浆细胞可生成IgM、IgG 和IgE等高亲和力的抗体,提供免疫记忆[10]。Tfh 可以促进生发中心(GC)内B 细胞分化成浆细胞和记忆性B 细胞[11-13]。树突状细胞可以诱导T 细胞活化和分化,从而启动适应性反应,并且可以增强并调节免疫反应,增强外周T 细胞的耐受性[14-15]。肥大细胞经IgE 介导后活化,可能在抗肿瘤免疫中起重要作用[16]。本研究进一步评估了HNSC 肿瘤组织中22种免疫细胞的浸润水平,发现上述有利于免疫抑制作用的免疫细胞在高FCGBP表达组中浸润水平增加。M2 巨噬细胞主要参与降低炎症反应,与免疫抑制有关。一项前列腺癌的研究显示,相较于M2 巨噬细胞低表达组,高表达组患者生存率明显降低,且M2 巨噬细胞被认为是独立的危险因素[17]。M0 巨噬细胞又称非活性巨噬细胞,可以被细胞因子诱导从而向M1 或M2 表型转化。有研究发现M0 巨噬细胞浸润比例高的膀胱癌患者预后差[18]。在本研究中,M2、M0 巨噬细胞浸润水平在高FCGBP 表达组中显著降低,这提示FCGBP 可能降低了M0 巨噬细胞的表达水平,抑制M2 型巨噬细胞的转化。

