IL-1基因多态性与胃食管反流病患者炎症及肠道菌群的关系
费多灵,柯进晶
胃食管反流病(GERD)为胃内容物反流入食管所造成的不适症状及并发症的一类消化内科疾病,临床上较为常见。其发病为一个多因素的、长期的发展过程,可能与生活环境、生活习惯、便秘及肥胖等多种因素有关。近年来越来越多的研究表明遗传因素在GERD 的发病中存在重要作用,寻找导致该病发生和发展的因素对临床诊治具有重要意义[1]。基因多态性为影响疾病易感性的重要因素,在多种疾病的易感性中探讨基因多态性具有显著价值。目前已发现多种细胞因子、趋化因子等参与了GERD 的疾病过程,白细胞介素-1(IL-1 )是较为典型的炎性介质,可通过多种途径调节胃酸分泌,研究显示IL-1 的IL-1 -31、IL-1 -511 基因位点与GERD 存在密切关系[2]。同时,肠道菌群的变化也会改变肠道炎症水平、免疫状态,影响GERD的发生发展[3]。因此,本研究对IL-1 基因多态性与GERD 患者炎症及肠道菌群的关系进行了探究,以期为该病的临床防治提供有效依据,现报道如下。
1 资料与方法
1.1 一般资料 选取浙江省岱山县第一人民医院2019 年1 月至2020 年1 月收治的GERD 患者60 例作为研究组。纳入标准:(1)符合GERD 的诊断标准,GERD 量表评分≥8 分[4-5];(2)自愿参与本研究并签署知情同意书,临床资料完整。排除标准:(1)合并消化性溃疡、继发性食管炎、食管手术后食管炎等相关食管炎;(2)其他因素所致食管病变;(3)近期服用促胃肠动力药、质子泵抑制剂(PPI)等抑酸剂及胃黏膜保护剂等药物;(4)合并影响本研究的其他因素。其中男34 例,女26 例;年龄26~58 岁,平均(42.4±3.7)岁。另选择同期健康志愿者60 例作为对照组,其中男36 例,女24例;年龄22~60 岁,平均(42.5±3.8)岁。两组一般资料差异无统计学意义(P >0.05),具有可比性。
1.2 方法
1.2.1 IL-1 -31 及IL-1 -511 基因多态性检测 于入院当日(健康志愿者于检查日)清晨收集3 ml 空腹静脉血,采用红细胞裂解液-酚-氯仿提取法提取DNA,-20 ℃保存待测。聚合酶链反应-限制性片段长度多态性(PCR-RFLP)检测IL-1 -31、IL-1 -511 基因多态性,引物由上海生工生物工程有限公司合成。IL-IL-1 -31 引物序列:上游:5’-AGAAGCTTCCACCAATACTC-3’;下游 :5’-ACCACCTAGTTGTAAGGAAG-3’;IL-1 -511 引物序列:上游:5’-TGGCATTGATCTGGTTCATC-3’;下游:5’-GTTTAGGAATCTTCCCACTT-3’。PCR 反应条件:95℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35 个循环,再72 ℃延伸5min。2%琼脂糖凝胶电泳观测结果。PCR 产物由上海生工生物工程有限公司测序,结果返回后对相应位点分型记录。
1.2.2 血清炎症因子水平检测 于入院当日(健康志愿者于检查日)清晨收集3ml空腹静脉血,3000 r/min 离心10 min 获取血清,采用酶联免疫吸附实验(ELISA)检测血清炎症因子IL-1、IL-4、IL-10 及肿瘤坏死因子-(TNF-)水平,试剂盒由赛默飞世尔科技公司提供。
1.2.3 肠道菌群数量测定 收集所有研究对象10 g 新鲜粪便,与90 ml 无菌稀释液混合,10 倍稀释后采用微量加样法接种培养,对粪便样本中大肠杆菌、肠球菌、乳酸菌、类杆菌、双歧杆菌及梭菌数量进行培养计数和鉴定。
1.3 统计方法 采用SPSS 20.0 统计学软件进行数据分析,计量资料以均值±标准差表示,采用方差分析或t 检验;计数资料采用2检验。P <0.05 为差异有统计学意义。
2 结果
2.1 两组血清炎症因子水平比较 研究组血清IL-1、IL-4 及TNF-水平均高于对照组(均P<0.05);两组血清IL-10水平差异无统计学意义(P >0.05)。见表1。
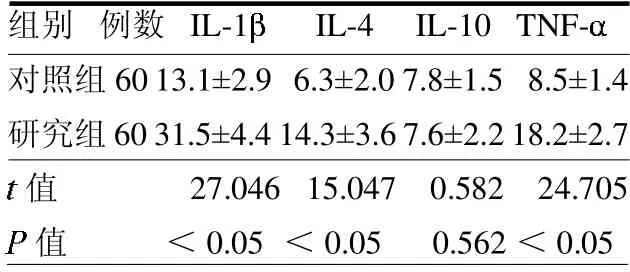
表1 两组血清炎症因子水平比较 ng/L
2.2 两组肠道菌群数量比较 研究组大肠杆菌、肠球菌数量高于对照组,乳酸菌、类杆菌及双歧杆菌数量低于对照组(均P <0.05);两组梭菌数量差异无统计学意义(P >0.05)。见表2。
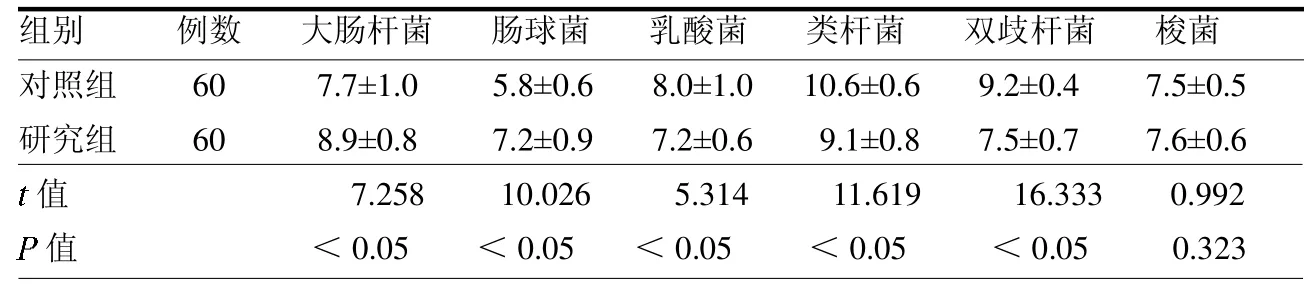
表2 两组肠道菌群数量比较 个
2.3 两组IL-1 基因多态性比较 研究组IL-1 -31 TT 基因型高于对照组,CC基因型低于对照组,T 等位基因频率高于对照组(均P <0.05);IL-1 -511 CC、CT基因型高于对照组,C等位基因频率高于对照组(均P <0.05)。见表3。
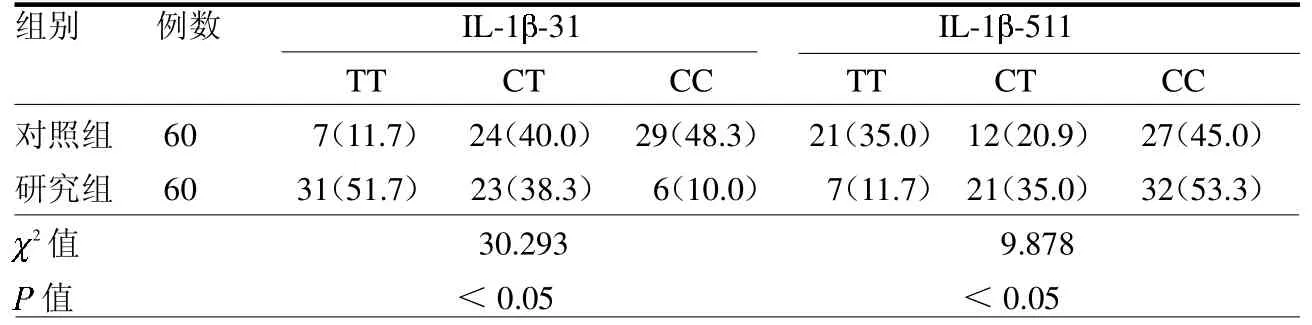
表3 两组IL-1 基因多态性比较 例(%)
2.4 GERD患者IL-1 -31、IL-1 -511 基因型与血清炎症因子水平的相关性IL-1 -31 TT 基因型GERD 患者血清IL-1、IL-4 及TNF-水平均高于IL-1-31 CT 基因型、CC 基因型(均P <0.05);IL-1 -511 CC 基因型GERD 患者血清IL-1、IL-4 及TNF-水平均高于IL-1 -511 CT 基因型、TT 基因型(均P<0.05)。见表4。

表4 GERD 患者IL-1 -31、IL-1 -511 不同基因型血清炎症因子水平比较 ng/L
2.5 GERD患者IL-1 -31、IL-1 -511 基因型与肠道菌群数量的相关性 不同基因型GERD 患者肠道菌群大肠杆菌、乳酸菌、类杆菌及双歧杆菌数量差异均有统计学意义(均P <0.05)。见表5。
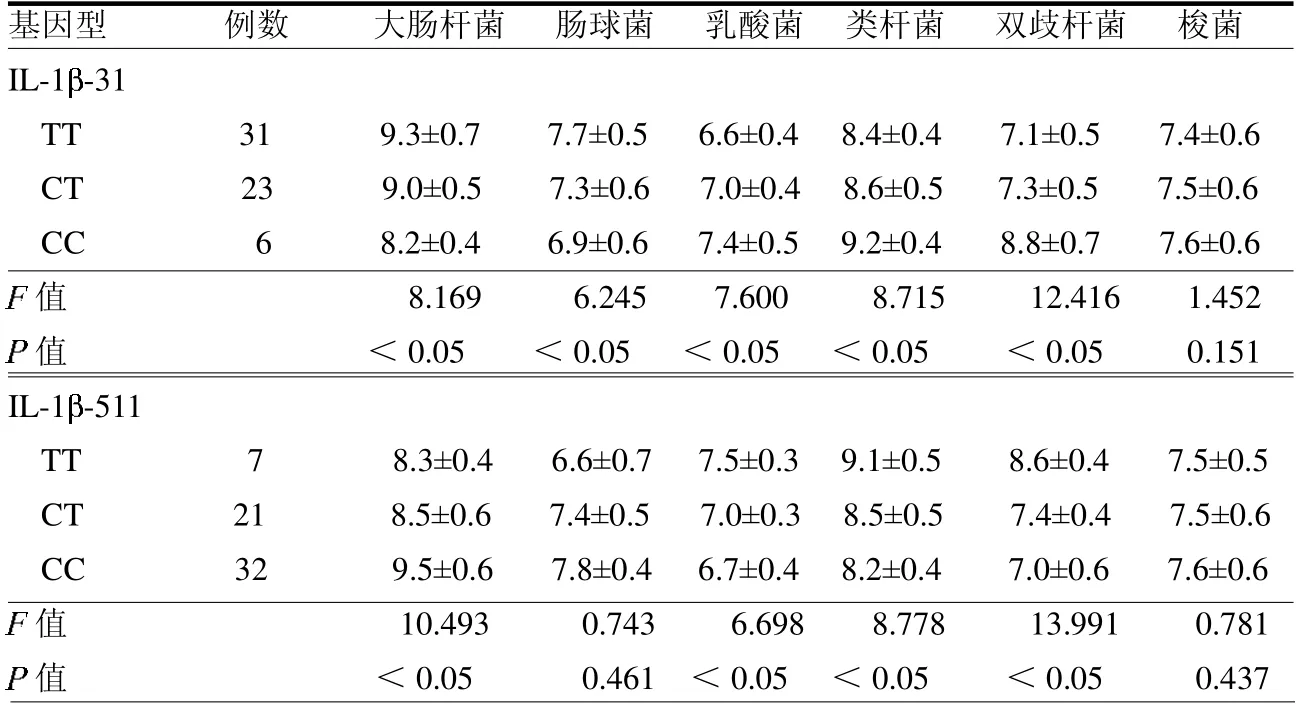
表5 GERD 患者IL-1 -31、IL-1 -511 不同基因型肠道菌群数量比较 个
3 讨论
GERD 在临床上较为常见,患者有典型的反酸、胃灼热等表现,并伴有声音嘶哑、哮喘、咽部异物感及慢性鼻炎等食管外症状,因而患者容易因食管外症状造成就诊延误或误诊。随着疾病的发展加重容易形成Barrett’s 食管及食管癌,严重影响患者的身体健康及生活质量。研究表明,GERD存在家族聚集性,提示遗传因素在GERD 的发病过程中存在重要作用[6]。因此,研究GERD 发病过程中相关基因对于该病的临床防治具有重要意义。
IL-1 主要包含IL-1、IL-1 及IL-1 RA,为免疫炎症反应中最关键的功能细胞因子,IL-1 参与调解胃黏膜上皮壁细胞功能,参与调解上皮壁细胞胃酸分泌的调节过程,多项研究证实在GERD 患者中存在IL-1 水平升高[7]。另有研究显示,GERD 患者食管黏膜组织中IL-1 mRNA表达水平明显高于正常黏膜组织[8]。本研究结果显示,GERD 较健康志愿者IL-1、IL-4 及TNF-水平显著升高,提示GERD 患者炎症因子水平显著升高。IL-1 在-31、-511 等位点C-T 碱基发生突变而产生的基因多态性与多种疾病的发生发展关系密切。本研究研究组IL-1-31 TT基因型显著高于对照组,CC基因型显著低于对照组,T 等位基因频率显著高于对照组;同时,IL-1 -511 CC、CT基因型显著高于对照组,C 等位基因频率显著高于对照组。这提示IL-1 -31、IL-1 -511 基因多态性与GERD 的发病有着密切关系,IL-1 -31 TT 基因型和T等位基因、IL-1 -511 CC 基因型和C 等位基因为GERD 发生的重要遗传因素。本研究IL-1 -31 TT 基因型GERD 患者血清IL-1、IL-4 及TNF-水平显著高于IL-1 -31 CT 基因型和CC 基因型;IL-1-511 CC 基因型GERD 患者血清IL-1、IL-4 及TNF-水平显著高于IL-1 -511 CT 基因型和TT 基因型。这提示IL-1-31、IL-1 -511 基因多态性与GERD 患者机体炎症因子水平升高存在密切关系,IL-1 -31、IL-1 -511 位点碱基突变后,可增加IL-1 的分泌,IL-1 升高可提升胃体内炎症水平,破坏胃壁细胞导致胃酸分泌减弱[9-10]。
肠道菌群是影响消化道疾病发生的重要因素,肠道微生物不仅可影响肠道营养物质的分解、吸收,进而影响机体代谢过程,还可影响机体炎症、免疫状态,影响消化道疾病的发生发展[11]。研究指出,消化道微生态改变参与了GERD 的病理过程[12]。本研究GERD 患者较健康对照组大肠杆菌、肠球菌数量显著升高,乳酸菌、类杆菌及双歧杆菌数量显著降低;同时,IL-1 -31、IL-1 -511 位点碱基突变与GERD 患者肠道菌群大肠杆菌、乳酸菌、类杆菌、双歧杆菌数量存在相关性。但本研究中GERD 患者各微生物菌群数量级差异不大,这可能与微量加样法接种培养结果与患者肠道真实菌群数量存在一定差异有关,且本研究纳入患者数量较少也可能导致结果出现一定偏倚。

