FKBP1B在乳腺癌中的表达及其临床意义
张少森 鞠久君 朱雪洁 王彩霞
乳腺癌是最常见的恶性肿瘤之一,是女性癌症死亡的最主要原因。2020年世界卫生组织发布的癌症统计数据中,乳腺癌目前已经成为全球发生率最高的癌症[1]。乳腺癌目前最主要的治疗方法仍然以手术切除为主,因此寻找特异性靶向治疗药物对乳腺癌的防治具有重要意义[2]。
FK506结合蛋白1B(FK506 binding proteins 1B,FKBP1B)是FKBPs家族中的一员[3]。FKBP是肽基-脯氨酰顺式/反式异构酶 (PPIases),能够将蛋白质中的脯氨酸从顺式构型转化为反式构型,是一种广泛分布且系统发育保守的非淋巴特异性蛋白,存在于许多真核生物中[4]。FKBP属于亲免素家族,可以与FK506、雷帕霉素、环孢菌素等免疫抑制药物结合,参与肿瘤发生和化疗耐药等多个过程[5, 6]。FKBPs通过特定的蛋白相互作用以及伴侣蛋白的作用执行多种生理功能[7]。很多研究发现,FKBP家族成员在多种肿瘤中异常表达,且抑制FKBPs有明显的增加细胞凋亡的作用,使得FKBP家族成员成为新的可能的肿瘤靶点[8~12]。作为FKBP1B的类似物,FKBP12被报道能够调控TGF-β信号[13]。然而FKBP1B在肿瘤中的表达情况以及其对肿瘤发展的影响尚未可知。
本研究检测了不同恶性程度的乳腺癌组织和乳腺癌癌旁组织中FKBP1B的表达情况,以及不同恶性程度的乳腺癌细胞系中FKBP1B的表达量。本研究在低度恶性的乳腺癌细胞系MCF-7中过表达FKBP1B,采用CCK-8实验和Transwell小室实验分别评价FKBP1B对乳腺癌细胞的增殖和迁移的影响,并用Western blot法探讨其可能的作用机制,旨在为研究FKBP1B在乳腺癌发展中的作用奠定基础,为乳腺癌的诊断和靶向治疗提供理论依据。
材料与方法
1.主要试剂:DMEM培养基购自中国维森特公司;10%的胎牛血清购自美国Gibco公司;100U/ml青霉素和100μg/ml链霉素购自美国Hyclone公司。Turbo转染试剂和Trizol购自美国Invitrogen公司。免疫印迹和免疫组化用FKBP1B抗体和免疫印迹化学发光液购自美国Santa Cruz公司,β-actin购自中国北京中杉金桥生物技术有限公司,HRP偶联抗兔和抗小鼠IgG均购自美国Cell Signaling Technology公司。PCR引物在睿博生物有限公司合成,DH5α感受态细胞购自中国天根生化科技(北京)有限公司;qPCR SuperMix购自中国北京全式金公司,反转录试剂盒和蛋白marker购自美国Thermo Fisher公司,PVDF膜、8.0μm的Millicell 悬挂式细胞培养小室和超滤管购自美国Millipore公司;细胞增殖检测试剂盒 CCK8(cell counting kit-8)购自日本Dojindo公司。
2.细胞培养与转染:人乳腺癌MCF-7和MDA-MB-231细胞均购自国家生物医学实验细胞资源库。用含有100U/ml青霉素,100μg/ml链霉素,10% FBS的DMEM培养。所有细胞均在含有5% CO2的37℃恒温细胞箱中培养。通过慢病毒感染的方法构建FKBP1B过表达MCF-7细胞系。将包装质粒psPAX2、pVSVG和包含有FKBP1B的转移质粒pLentiCMV按照3∶1∶4的比例共同转染到HEK-293T细胞中。72h后,细胞上清用0.45μm滤膜过滤,加入到MCF-7细胞中。其中病毒的效价为1×108U/ml,侵染细胞时病毒感染复数(MOI)为50。细胞培养48h后,向细胞中加入杀稻瘟菌素进行筛选。过表达引物上游引物:5′-ATTCTAGAATGGGCGTGGAGATCGAGACCATCTCC-3′,下游引物:5′-ATGGATCCTCACTCTAAGTTGAGCAGCTCCACGTCAAAGA-TGAG-3′(下划线标注处为酶切位点)。
3.实时荧光定量PCR检测各组细胞FKBP1B的表达:利用TRIzol法提取MCF-7细胞的总RNA,反转录成cDNA。qRT-PCR的程序按照试剂盒的说明书进行操作。以GAPDH作为内参,测定FKBP1B的相对表达量,采用2-ΔΔ Ct法进行分析。FKBP1B引物序列上游引物:5′-CTGACCTGCACCCCTGATG-3′,下游引物:5′-GGTGGCATTGGGAGGGATG-3′。GAPDH引物序列上游引物:5′-ATCAAGAAGGTGGTGAAGCA-3′,下游引物:5′-AGACAACCTGGTCCTCAGTGT-3′。
4.Western blot法检测:收取各组细胞,对照组(NC)、空载体组(control vector)、过表达FKBP1B组(FKBP1B-OE)。加入裂解液,煮样后,进行SDS-PAGE,后于4℃条件下将蛋白转印到PVDF膜,牛奶室温封闭30min,用稀释好的抗体4℃孵育过夜,TBST清洗3遍后,用相对应的二抗孵育1h,ECL发光法显影。
5.CCK-8 法检测各组细胞增殖活性: 种植1×103个/(100微升·孔)的细胞到96孔板。每组细胞设置4个平行复孔。48h后,取出96孔板,弃去细胞上清液。将CCK-8(cell counting kit-8)试剂与空的DMEM按照1∶10的比例混合。将配置好的 CCK-8 试剂以100微升/孔的量加入待测细胞中,同时做4个空白对照。将96孔板放回培养箱中继续培养,2h后,在450nm条件下用酶标仪检测吸光度(A)值。
6.Transwell实验检测各组细胞的侵袭能力:将空载体组(control vector)和过表达FKBP1B组(FKBP1B-OE)细胞按5×104个/(200微升·孔)的细胞进行稀释。8μm的Transwell小篮装在24孔板中,下层加入600μl含有5%胎牛血清的DMEM培养基。上层加入200μl细胞悬液,细胞在小篮中培养48h后,将24孔板取出。弃去原培养基,用4%多聚甲醛室温固定30min。PBS清洗后,加入结晶紫染色,室温放置1h。用棉签把小篮内部的细胞和基质胶擦去并充分清洗,放置在盛有PBS缓冲液的24孔板中。在显微镜下拍照。
7.IHC检测临床样本中FKBP1B的表达:将购买的切片放置在60℃烘箱中烘烤 20min 进行脱蜡处理。将石蜡切片依次放入二甲苯以及不同浓度的乙醇中进行水化处理。柠檬酸缓冲液修复, 3%的双氧水去除内源性过氧化物酶的活性。山羊血清封闭后,FKBP1B抗体4℃过夜。PBS清洗后,HRP标记的二抗孵育。加入DAB显色,苏木精复染。用不同浓度乙醇溶液进行脱水处理。封片后显微镜下拍摄不同视野。
结 果
1.不同恶性程度的乳腺癌组织和癌旁组织FKBP1B的表达情况:免疫组化结果显示,FKBP1B的阳性表达主要定位于细胞质中(图1),且FKBP1B的表达量随着乳腺癌的恶性程度的增加而升高。肿瘤组织中的FKBP1B表达量明显高于正常组织(P<0.001);对69位肿瘤患者进行TNM分期后分析发现,Ⅰ期患者FKBP1B表达主要集中在0级和1级,Ⅱ期患者主要集中在1级和2级,Ⅲ~Ⅳ期患者主要集中在2~3级。统计分析结果表明,Ⅰ期、Ⅱ期和Ⅲ~Ⅳ期患者的FKPB1B的表达差异有统计学意义(P=0.045,表1)。
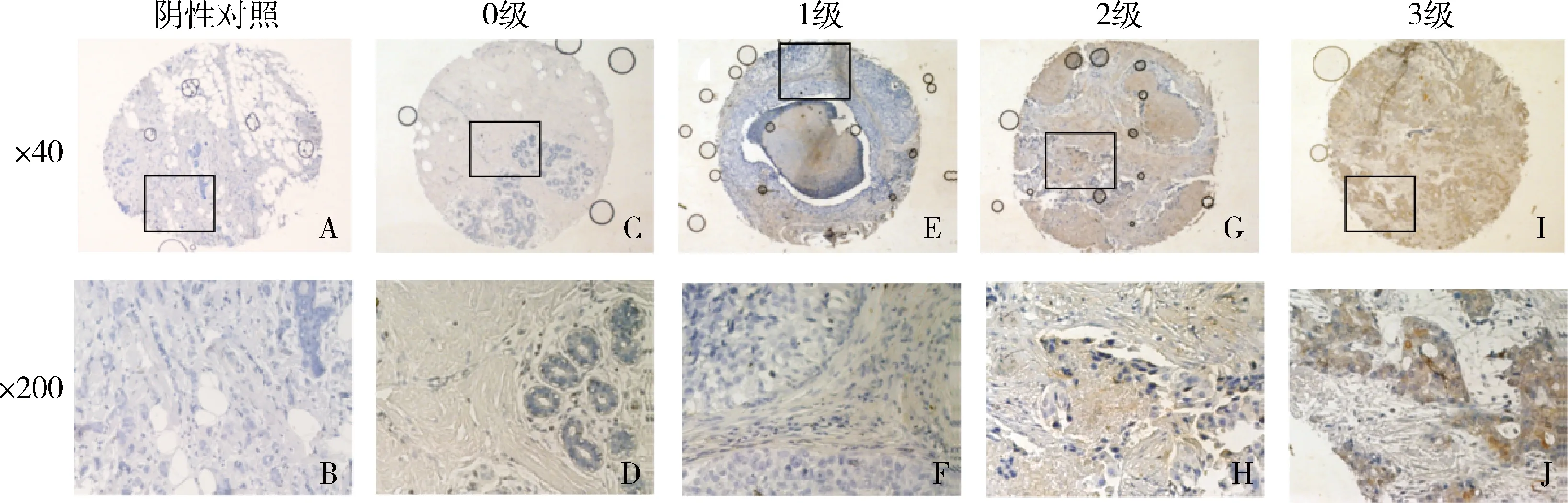
图1 免疫组化检测FKBP1B在不同恶性程度的乳腺癌及正常乳腺癌组织中的表达根据FKBP1B的表达情况,从少到多分为0、1、2、3级。图示为阴性对照(A、B),FKBP1B在0级(C、D),1级(E、F),2级(G、H)和3级(I、J)的代表图片。病理切片为二氨基联苯胺(DAB)染色后,苏木精复染

表1 FKBP1B在不同恶性程度的乳腺癌及正常乳腺癌组织中的表达情况(n)
2.不同乳腺癌细胞系中FKBP1B表达情况:与低恶性程度乳腺癌细胞系MCF-7比较,高恶性程度的乳腺癌细胞系MDA-MB-231的FKBP1B的mRNA水平明显增加(图2A)。免疫印迹实验显示,MDA-MB-231中FKBP1B的蛋白表达水平明显高于MCF-7(图2B)。

图2 不同恶性程度的乳腺癌细胞中FKBP1B的mRNA和蛋白表达水平A.实时荧光定量PCR检测MCF-7和MDA-MB-231细胞中FKBP1B的表达量;B.免疫印迹检测MCF-7和MDA-MB-231细胞中FKBP1B的表达量,β-actin作为内参
3.过表达FKBP1B促进乳腺癌细胞的增殖:在MCF-7中过表达FKBP1B,免疫印迹显示过表达组FKBP1B的蛋白水平明显高于对照组(图3)。细胞增殖实验结果表明,与对照组比较,过表达FKBP1B的MCF-7细胞的增殖速率明显增加(图4)。

图3 Western blot法检测各组MCF-7细胞中FKBP1B的蛋白水平
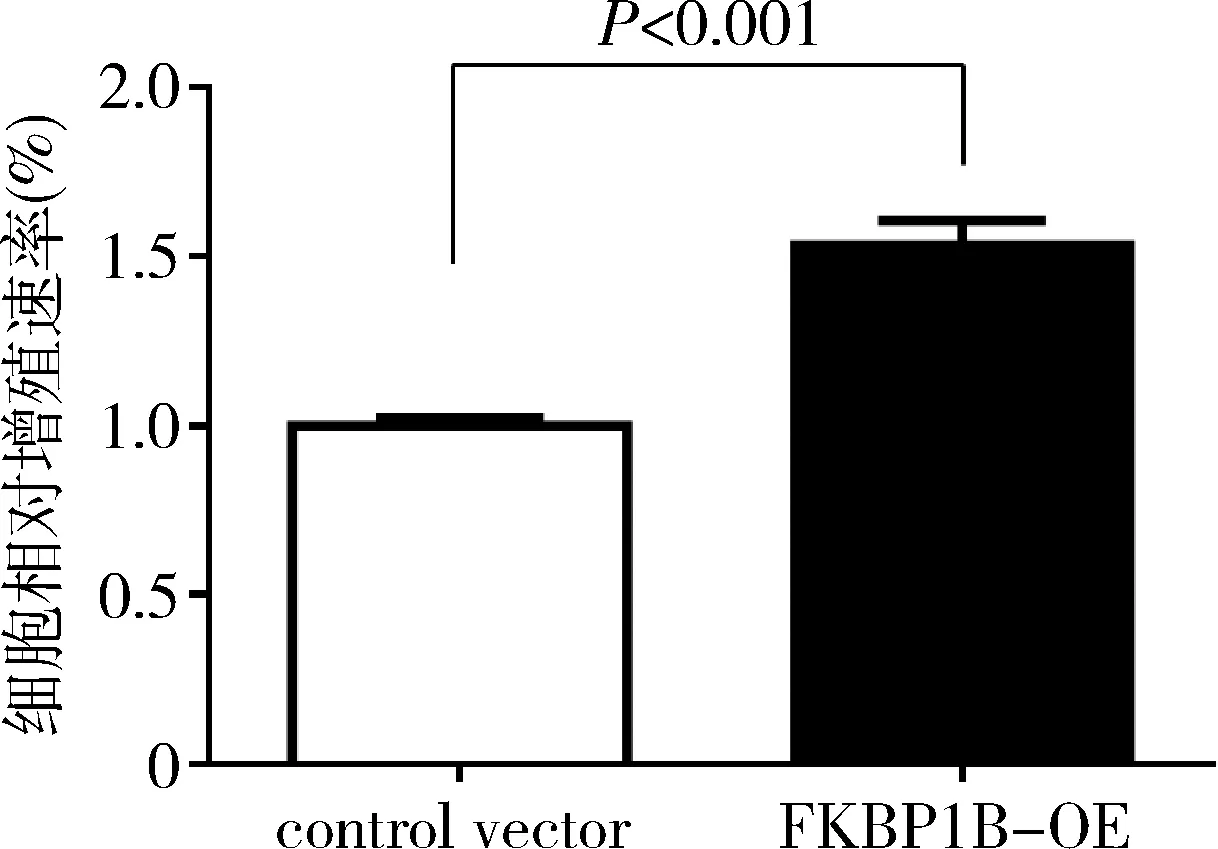
图4 CCK-8检测各组MCF-7细胞增殖活性
4.过表达FKBP1B对乳腺癌细胞迁移能力的影响:迁移实验结果显示,与对照组比较,过表达FKBP1B后的MCF-7的迁移率显著增加(图5)。
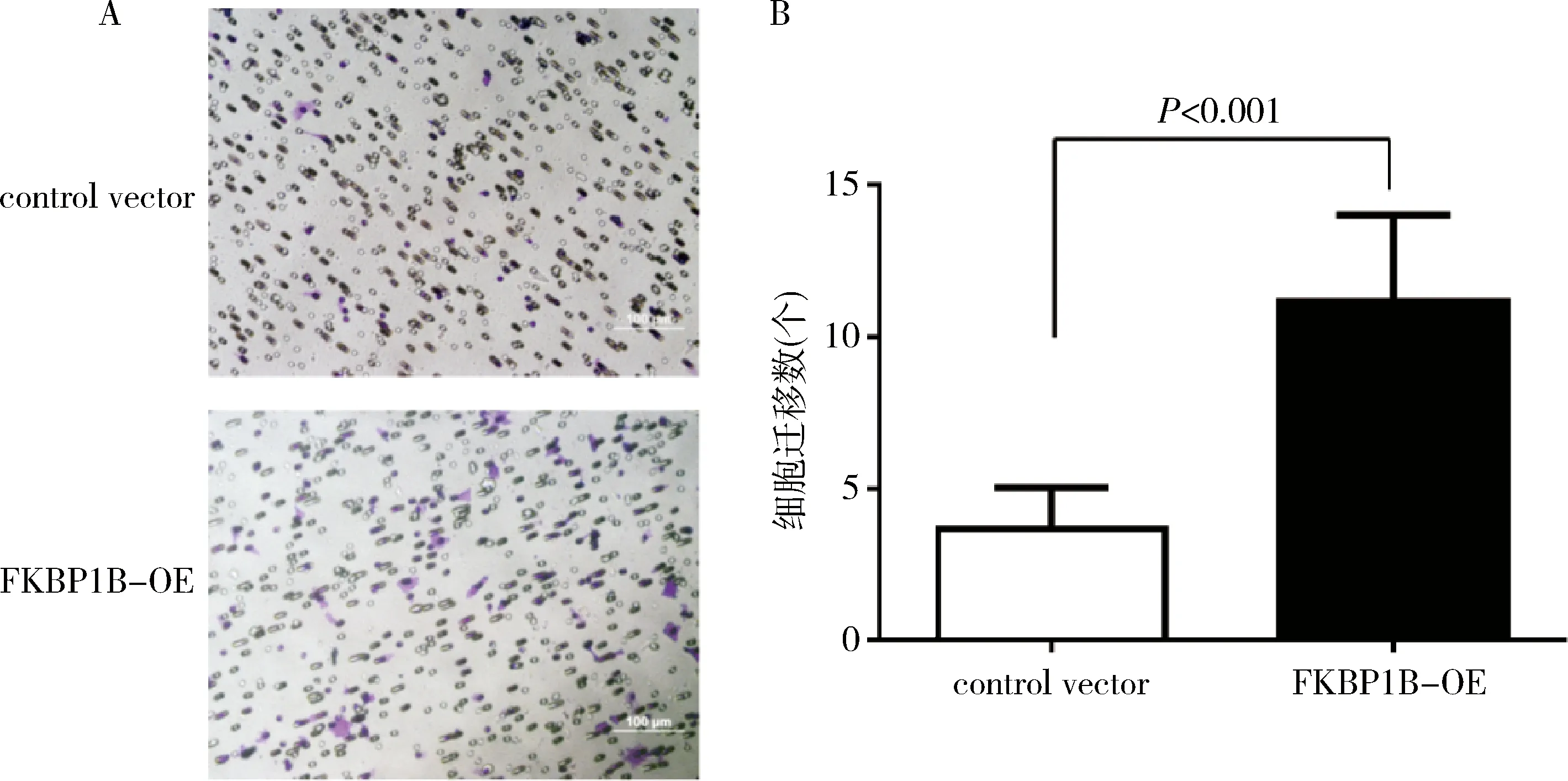
图5 过表达FKBP1B促进MCF-7细胞的迁移(×200)A.Transwell 迁移实验代表图片;B.Transwell 迁移实验统计结果
5.FKBP1B促进Hsp90α的分泌:免疫印迹实验表明,FKBP1B在MDA-MB-231中的表达水平高于MCF-7;同时,MDA-MB-231的胞外Hsp90α显著高于MCF-7(图6),而两个细胞中的胞内Hsp90α没有显著变化。此外,在MCF-7中过表达FKBP1B能够显著促进Hsp90α的分泌(图7),但不影响胞内Hsp90α的含量。

图6 乳腺癌细胞中FKBP1B的表达与胞外HSP90α(eHSP90α)的分泌的相关性

图7 过表达FKBP1B 促进HSP90α的分泌
讨 论
乳腺癌是女性恶性肿瘤的第一大杀手[14]。目前乳腺癌的治疗主要以外科手术切除为主,以化疗为辅助手段。然而化疗对人体产生的不良反应非常大[15]。尽管免疫疗法以及多种乳腺癌标志物正在被探索,但仍然缺乏有效的用于临床的靶点和标志物[16,17]。因此,急需探索乳腺癌发展的分子机制,寻找辅助筛查的标志物和潜在的分子靶标。
FKBP家族成员分布广泛,被报道能够调节糖皮质激素信号、经典和非经典NF-κB信号、mTOR/Akt信号和TGF-β信号[18]。近年来,大量的文章报道FKBP家族的蛋白与肿瘤的发展密切相关。其中,FKBP11能够通过p53促进口腔鳞状细胞癌的细胞增殖和肿瘤的发生[19]。FK506结合蛋白5(FK506-binding protein 5,FKBP5)被报道促进甲状腺乳头状癌的发展[20]。FKBP10能够调控蛋白翻译从而影响肺癌以及消化道肿瘤的发展[21, 22]。靶向FKBP12能够增强 TGF-β信号并且刺激慢性淋巴细胞白血病的凋亡[23]。然而作为FKBP家族的一员,FKBP1B在肿瘤中的作用尚未见报道。本实验结果证明,与正常乳腺癌组织比较,乳腺癌组织中的FKBP1B表达明显较高,且FKBP1B在乳腺癌组织中的表达量随恶性程度的增加而增加。与低度恶性的乳腺癌细胞系MCF-7比较,高度恶性的乳腺癌细胞MDA-MB-231中的FKBP1B的mRNA和蛋白表达水平明显增多。该结果表明,FKBP1B的表达与乳腺癌的恶性程度相关。为了进一步探索FKBP1B是否影响了乳腺癌的发展,笔者在MCF-7中过表达FKBP1B,通过CCK-8和Transwell实验发现过表达FKBP1B促进了乳腺癌细胞的增殖和迁移能力。
笔者前期研究已经发现,胞外Hsp90α与肿瘤的恶性程度密切相关且能够促进肿瘤的进展[24]。本研究发现,MDA-MB-231的胞外Hsp90α含量明显高于MCF-7,与FKBP1B的趋势一致。因此推测FKBP1B可能通过促进Hsp90α的分泌促进肿瘤进展。进一步发现过表达FKBP1B后,胞外Hsp90α明显增多。此外,FKBP家族的FKBP51和FKBP52被报道能够与Hsp90形成复合物,从而影响肿瘤的发展[18]。FKBP家族的FKBP38也被报道能够与Hsp90作用从而调控肿瘤细胞的凋亡。这些报道进一步佐证了FKBP家族蛋白与Hsp90的亲近关系。
综上所述,本研究表明FKBP1B在乳腺癌中的表达随恶性程度的增高而增多,过表达FKBP1B能够明显的促进乳腺癌细胞的增殖和迁移能力,并且能够增加Hsp90α的分泌。提示FKBP1B可能通过促进Hsp90α的分泌从而促进乳腺癌的发展,但其相关机制还有待于进一步探讨。

