AZD4547联合LAG-3抗体对小鼠肺癌模型的作用
陆 敏 陆 舜
非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺恶性肿瘤的85%,根据分期、病理及分子病理分型的不同,患者可选择性地接受手术、放疗、化疗、靶向治疗或免疫治疗[1,2]。成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)是NSCLC中重要的驱动基因,其选择性抑制剂AZD4547已进入肺癌的Ⅲ期临床试验阶段[3,4]。以免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)为代表的免疫治疗在NSCLC中应用广泛,除了已经广泛应用于临床治疗的程序性死亡-1(programmed death-1,PD-1)抗体,淋巴细胞激活基因-3(lymphocyte-activation gene 3,LAG-3,又称CD223)抗体的相关临床试验也在多个瘤种内开展[5]。研究显示,FGFR抑制剂联合PD-1抗体在小鼠中重塑肿瘤免疫微环境,并产生协同抗肿瘤作用,而FGFR抑制剂与LAG-3抗体联用的抗肿瘤效应尚不明确[6,7]。本研究旨在探究FGFR抑制剂联合LAG-3抗体在小鼠肺癌模型中的抗肿瘤效应及其对肿瘤免疫微环境的影响,为治疗NSCLC提供更多的联合用药依据。
材料与方法
1.主要材料和试剂:6~8周龄的雄性C57BL/6小鼠(SPF级)购自上海灵畅生物科技有限公司,经过上海交通大学动物实验伦理委员会批准,饲养于上海交通大学MED-X研究院SPF无菌动物房。小鼠LLC细胞系传代自本实验室既往冻存细胞株。AZD4547(瑞典AstraZeneca公司)、LAG-3抗体(GoInVivoTMPurified anti-mouse LAG-3,美国Biolegend公司)、对照IgG抗体[Rabbit (DA1E) mAb IgG XP®Isotype Control,美国CST公司)、APC-Cy7 anti-mouse CD3ε 500μg(美国Biolegend公司)、Ms CD8a FITC 53-6.7 500μg(美国BD Pharmingen公司)、Ms TNF PE MP6-XT22 100μg(美国BD Pharmingen公司)、Ms IL-2 BV421 JES6-5H4 50μg(美国BD Pharmingen公司)购自上海优宁维生物科技有限公司。LiberaseTMDL Research Grade(瑞士Roche公司)、细胞滤网(美国BD FALCON公司)、红细胞裂解液(FS1143)购自上海复申生物科技有限公司。
2.细胞培养:从液氮中取出冻存的LLC细胞,37℃水浴解冻,离心并重悬于完全培养液(DMEM 基础培养液+10% FBS+1%青霉素-链霉素双抗)中,在 37℃、5%CO2的培养箱中培养。每隔2~3天换液,密度达到80%~90%时传代,直至接种皮下瘤模型。DMEM基础培养液、FBS、1%青霉素-链霉素双抗、PBS等细胞培养所用试剂(美国Invitrogen Gibco公司)购自赛默飞世尔科技(中国)有限公司。
3.模型构建:胰酶消化贴壁培养的LLC细胞,PBS洗两遍,细胞计数后用PBS 重悬至5×106/ml,暂存冰上。在SPF动物房内,向每只小鼠的左侧胁肋部皮下注射100μl细胞悬液,每天观察小鼠状态。自接种后第7天起,每隔3天用游标卡尺测定皮下瘤体积,皮下瘤体积(V)=(L×W2)/2(其中V是肿瘤体积,L是最长径长度,W是最短径长度)。
4.药物干预:自接种后第7天起,AZD4547以12.5mg/(kg·d)的剂量灌胃给药,6~8周龄的小鼠约为0.02千克/只,故B组和D组小鼠AZD4547的给药量为0.25毫克/(只·天),A组和C组给予空白溶剂(PBS+2%DMSO)。接种皮下瘤后的第7天、第10天、第13天和第16天,LAG-3抗体以100微克/只的剂量腹腔注射给药,C组和D组给予小鼠LAG-3抗体,A组和B组给予等量对照 IgG抗体。
5.标本处理:至肿瘤接种后第19天,快速颈椎脱臼处死小鼠,完整剥离皮下瘤,取鱼肉样组织分为两部分,置于冰上暂存。一部分组织放入用铅笔写有编号的包埋盒,4%PFA固定并过夜,次天用水冲洗并用乙醇梯度脱水,转移至通风橱后,二甲苯处理、浸蜡、包埋和切片(厚度10μm),常温下保存。另一部分组织用手术刀切碎,放入含0.1mg/ml Liberase DL(cat 5401160001, 美国Sigma Aldrich公司)的DMEM 基础培养液中,组织破碎机处理40min后,将絮状混合物用直径70μm的滤网过滤,离心、洗涤、裂红后,用直径40μm的滤网再次过滤,离心后重悬为单细胞悬液,用于流式细胞术。
6.免疫组织化学染色(immunohistochemistry, IHC):将石蜡切片脱蜡、修复抗原后, 3%过氧化氢溶液孵育、PBS(pH7.4)洗涤,稍甩干水分。用5%BSA按一定比例稀释好的小鼠CD8一抗(GB13429,武汉赛维尔生物科技有限公司)覆盖表面,平放于湿盒内4℃孵育过夜,次日洗去一抗,加入二抗(HRP标记)稀释液室温孵育50min。PBS洗涤3次,滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色,最后复染细胞核、脱水封片。在正置荧光显微镜(德国Leica公司)下,在10倍目镜、20倍物镜下摄片。
7.流式细胞术:洗涤单细胞悬液并用新鲜配置的细胞因子激活液[Cell Activation Cocktail (with Brefeldin A),美国Biolegend公司]重悬细胞,37℃温箱内孵育6h,结束后离心、洗涤,与细胞表面分子抗体混合物冰上避光孵育30min,使用细胞固定试剂盒(Foxp3/Transcription Factor Staining Buffer Set,美国eBioscience公司)进行破膜、透化处理,再与细胞因子抗体混合物冰上避光孵育50min。洗涤并用PBS(1%EDTA、2%BSA)重悬细胞至200~300μl,置于冰上暂存,上机前将EP管里的细胞吹打均匀,过滤后转移到流式管中,在BD Fortessa流式细胞仪中检测。
8.统计学方法:使用 FlowJo 10.0.7软件分析流式细胞术的数据。使用Prism 7.0a软件分析4组数据之间的统计学差异,应用非配对t检验和Welch′s校正。以P<0.05为差异有统计学意义。除另有说明外,实验均重复3次。所有图像均具有代表性。
结 果
1.各组皮下瘤生长曲线比较:为了对比抗FGFR、抗LAG-3以及联合用药的抗肿瘤效果,本研究设置了4个对照组,分别是A组(空白对照)、B组(AZD4547)、C组(LAG-3抗体)和D组(AZD4547联合LAG-3抗体),于皮下瘤接种后第19天瘤体进行摄片(图1A),同时绘制肿瘤生长曲线(图1B)。结果显示,C组对比A组提示LAG-3抗体仅能轻微抑制肿瘤生长(P<0.05);B组对比A组提示AZD4547可部分抑制肿瘤生长(P<0.001);D组对比A组(P<0.001)、B组(P<0.05)差异均有统计学意义,提示AZD4547联用LAG-3抗体具有协同抗肿瘤效应(图1)。
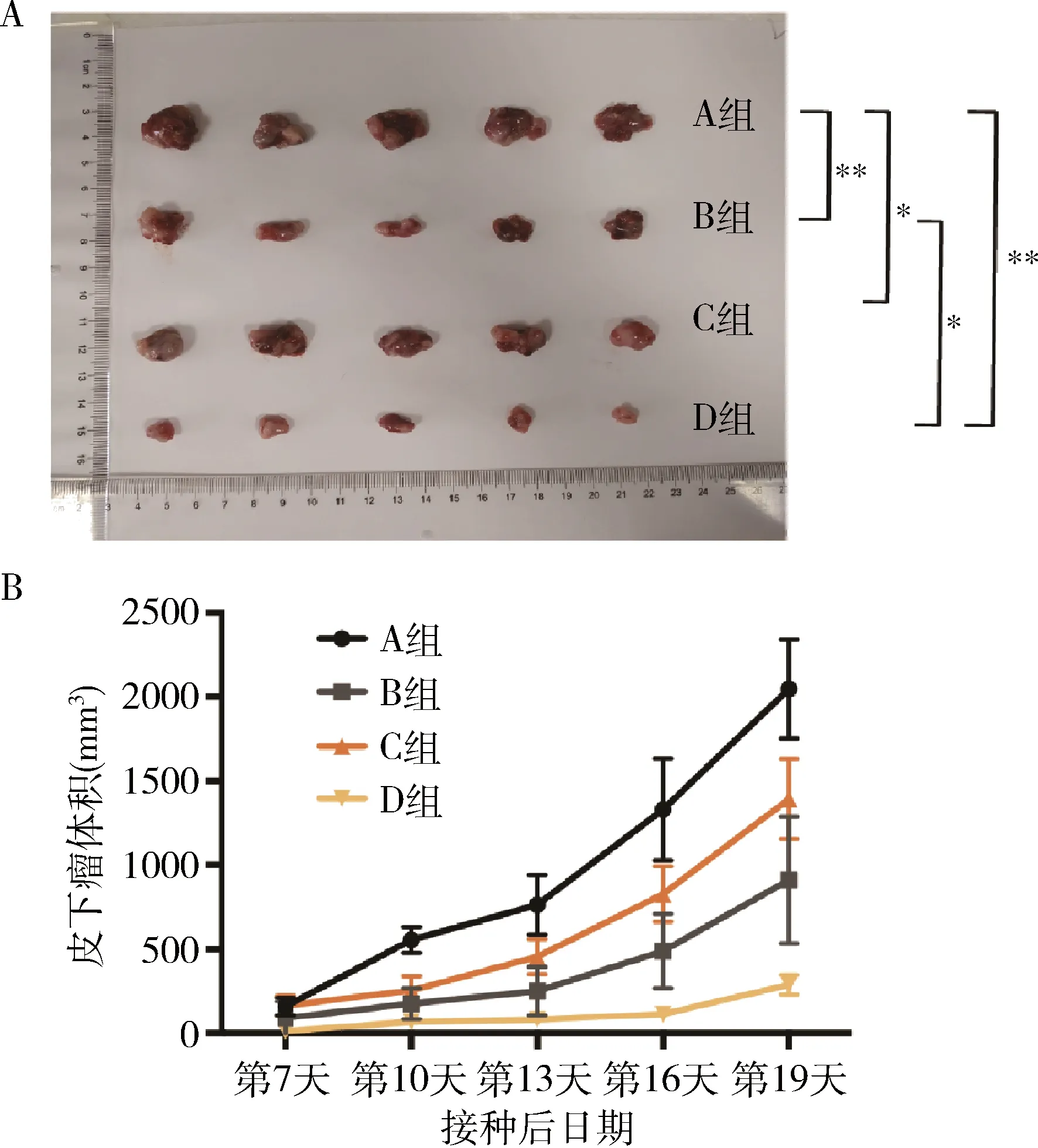
图1 AZD4547联合LAG-3抗体在小鼠体内显著抑制皮下瘤生长A.小鼠皮下瘤接种后第19天,取出瘤体拍摄体积对比图;B.皮下瘤的肿瘤生长曲线(n=5,*P<0.05,**P<0.001)
2.各组CD8抗体IHC染色比较:新鲜皮下瘤组织经过石蜡包埋、切片处理,通过CD8抗体染色来反映肿瘤微环境内CD8+T细胞浸润水平。与A组比较,B组CD8表达少量增加,C组CD8表达增加更明显,而D组CD8表达增加最为显著(图2)。

图2 AZD4547联合LAG-3抗体促进CD8+T细胞浸润(HE,×200)A.A组;B.B组;C.C组;D.D组。各组皮下瘤组织的IHC染色图(n=5),棕黄色为CD8+T细胞,用红色箭头指出
3.各组CD8、TNF-α、IL-2流式检测结果比较:另一部分新鲜皮下瘤组织处理成单细胞悬液后用荧光标记的抗体染色,用于反映肿瘤微环境内的免疫特征。结果显示,与A组比较,B组的CD8、TNF-α、IL-2表达仅为轻度升高(P<0.05),C组的CD8、TNF-α、IL-2表达升高更为明显(P<0.01),提示AZD4547和LAG-3抗体对于免疫微环境具有不同程度的抗肿瘤效应;而D组CD8、TNF-α、IL-2的表达水平较C组轻度升高(P<0.05)、较B组升高更为明显(P<0.01),提示两药联用的抗肿瘤免疫激活作用较单独给药更强(图3)。

图3 联合用药显著提高CD8+T细胞、TNF-α和IL-2表达水平A. CD3+细胞群中CD8+的百分比;B. CD8+细胞群中TNF-α+的百分比;C.CD8+细胞群中IL-2+的百分比。将皮下瘤消化为单细胞悬液并进行流式染色分析,该图显示了CD8+T细胞的特征(n=5,*P<0.05,**P<0.01,*** P<0.001)
讨 论
既往研究显示,FGFR抑制剂在多种实体瘤的动物模型中展示出了对肿瘤免疫反应的调节作用,包括单药或联合免疫治疗对CD8+T细胞、自然杀伤细胞、肿瘤相关巨噬细胞等免疫细胞的激活或抑制效应[6,8~10]。在原发性肺腺癌的基因工程小鼠模型中,FGFR抑制剂(厄达替尼)联合应用小鼠PD-1抗体后,T淋巴细胞的克隆多样性增加和抗肿瘤免疫反应增强,提示FGFR抑制剂与PD-1抗体对于NSCLC具有协同抗肿瘤效应,但FGFR抑制剂联合其他类型免疫治疗的研究尚无报道[6]。
LAG-3主要表达于耗竭的CD4+和CD8+肿瘤浸润T细胞,其表达水平升高与各类型肿瘤的疾病进展、不良预后相关,因此LAG-3是一类具有治疗价值的免疫检查点,目前已研发出十余种LAG-3阻断药物[5,11,12]。已报道的两项Ⅰ/Ⅱ期临床研究显示,抗LAG-3联合抗PD-1治疗在多种实体瘤中耐受性良好,在部分患者中展现出持续临床反应和免疫特征调节作用[13,14]。然而,LAG-3的分子调控机制和生物学功能仍有待进一步探究,该分子通路是否与其他肿瘤调控通路交互作用尚未明确,同时缺乏与其他类型靶向或免疫药物联用的方案设计。
基于以上现状,本研究首先用LL2小鼠NSCLC细胞系构建了同源性的小鼠皮下瘤模型,通过AZD4547和LAG-3抗体的给药与否将小鼠分为4组,对比不同给药方式下肿瘤直径的差异;同时取出皮下瘤进行肿瘤组织内CD8+T细胞的数量、活性的检测,以评估药物对于肿瘤免疫微环境的影响。本研究的实验结果显示,AZD4547联合LAG-3抗体在小鼠肺癌模型中展示出了协同抗肿瘤效应,增加了CD8+T细胞的浸润,提高了CD8+T细胞中激活性细胞因子的表达水平,这提示同时抑制FGFR和LAG-3是治疗NSCLC的一个潜在用药组合。
在目前的晚期NSCLC治疗手段中,靶向治疗和ICIs是继传统化疗药物以后最主要的抗肿瘤药物类型,前者通过阻断细胞生存相关的信号通路来抑制肿瘤的生长,而后者则通过激活CD8+T细胞、自然杀伤T淋巴细胞等产生抗肿瘤效应[15,16]。靶向药物面临着响应期短的困境,而免疫治疗的抗肿瘤反应具有持续性激活的特点,二者联合应用可能提高整体药物响应率[2,17]。多项Ⅰ/Ⅱ期临床试验探索了“靶向+免疫”模式的疗效和安全性,其中厄洛替尼联合纳武利尤单抗、吉非替尼联合度伐利尤单抗在FGFR突变的NSCLC 患者中展示出了可接受的安全性并使部分患者获益[18,19]。而本研究通过在小鼠NSCLC模型中尝试其他靶点的联合治疗,为更多患者提供了潜在的用药方案,如携带FGFR扩增或染色体易位、高表达LAG-3以及对PD-1抗体产生耐药的患者,以及存在其他未知敏感突变的患者。
本研究也存在一些不足:①未进行FGFR与LAG-3信号通路相关性的细胞机制研究;②未能采用证据等级更高的原位瘤模型、自发性肺癌模型、人源性模型;③未探究两药联用的疗效预测标志物[6,12,20]。综上所述,本研究表明,FGFR抑制剂与LAG-3抗体联合用药在小鼠皮下瘤中抑制癌细胞增殖并激活CD8+T细胞,具有协同抗肿瘤效应。

