努比亚山羊LMCD1基因生物信息学分析、真核表达载体的构建及表达
邹剑伟,邹菊红,申玉建,韦 一,张叁保,连子童,徐建建,宋 颖,黄艳娜,韦英明,蒋钦杨,郑自华
(1.广西大学动物科学技术学院,南宁 530004;2.广西大学农牧产业发展研究院,南宁 530004)
LIM结构域蛋白被定义为具有双锌指基序的蛋白,共有氨基酸序列C-X2-C-X16-23-H-X2-C-X2-C-X16-23-C-X2-C,其中C代表半胱氨酸,X代表其他氨基酸[1]。研究发现,1个LIM结构域约由55个氨基酸和8个高度保守的氨基酸残基组成,LIM结构域蛋白被公认为细胞调节机制的关键成分,是细胞生长、细胞分化和细胞骨架重塑的重要调节剂[2]。目前关于LIM蛋白的细胞功能研究已有报道[3],但关于LIM结构域基因1(LIM domain gene 1,LMCD1)生物学功能的报道较少。基于LIM结构域之间的序列关系和蛋白质结构的分类,将LIM蛋白共分成3类:第1类蛋白具有LIM结构域相关的序列;第2类蛋白不仅有相关的LIM结构域,而且含有1个额外的短的保守基序;第3类蛋白包含的LIM结构域比第1和2类蛋白的LIM结构域更相关。LMCD1属于第3类,有着比前两组蛋白彼此关联更加密切的LIM结构域[4]。据报道,LMCD1是最初由Lin11、Isl-1和Mec-3 (LIM)中发现的锌指基序定义的一组蛋白质中的一部分,除了2个C-端LIM结构域外,LMCD1在N-端区域包含1个富含半胱氨酸的结构域,在蛋白质的中央部分包含1个PET结构域[5-6]。
骨骼肌是人体中最具活力的组织之一,约占人体总重的40%,占人体总蛋白质含量的50%~70%。人体骨骼经历不间断的重塑以维持骨稳态,这主要依赖于破骨细胞的骨吸收与成骨细胞的骨形成之间的协调平衡[7-8]。LIM结构域蛋白被认为与蛋白质-蛋白质相互作用有关[9],LMCD1基因中LIM结构域的存在提示它可能参与了骨骼肌蛋白质之间的相互作用[10-11]。据报道,骨形态发生蛋白(bone morphogenetic protein,BMP)在骨髓基质干细胞的成骨分化中发挥着关键作用[12-13],LMCD1基因通过调节BMP信号促进人骨髓干细胞成骨分化,其被认为是一种新型的成骨分化调节剂,可能是骨代谢相关疾病的潜在治疗靶点[14]。骨骼肌质量非常依赖于蛋白质降解和合成之间的适当平衡[15]。LIM和LMCD1可以正向调节肌肉质量,促进肌肉蛋白质的合成,调控肌纤维的大小,LMCD1基因在体内充足表达可以增加臂力,同时可降低对钙处理的需求并减少肌肉疲劳。相反,沉默LMCD1基因的表达会损害钙处理和力量,并在没有明显萎缩的情况下诱发肌肉疲劳,除此之外,LMCD1基因在骨骼肌疾病患者的骨骼肌中表达量下降[16]。
LMCD1基因在细胞生长、组织器官和骨骼肌肉发育过程中具有重要的调控作用,目前LMCD1基因在小鼠和人等物种上的研究越来越多,但在山羊上鲜见报道。努比亚山羊具有体型大、生长速度快、繁殖性能强、耐粗饲及产肉率高等特点,是著名的乳肉兼用型山羊[17]。本研究克隆努比亚山羊LMCD1基因CDS区序列并进行生物信息学分析,构建真核表达载体并检测其表达,以期为后续研究LMCD1基因在山羊骨骼肌肉发育机制中的调控作用提供理论依据。
1 材料与方法
1.1 材料
3只10月龄努比亚山羊由广西大学动物科学技术学院实习基地提供;山羊骨骼肌卫星细胞和pEGFP-N1载体均由广西大学动物遗传育种实验室保存。
2×RapidTaqMasterMix酶、Solution 1、氯仿、异丙醇、DL2000 DNA Marker、DL5000 DNA Marker均购自生工生物工程(上海)股份有限公司;无内毒素质粒小提中量试剂盒、Cycle Pure Kit、DNA胶回收试剂盒均购自天根生化科技(北京)有限公司;大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;RNA提取试剂Trizol、pEGFP-N1载体、反转录试剂盒、SYBR Premix ExTaqTM(Tli RNaseH Plus)、PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit均购自宝生物工程(大连)有限公司;ClonExpress MultiS One Step Cloning Kit、2×Phanta Max MasterMix、HiScriptⅡQ RT SuperMix for qPCR(+gDNA Wiper)均购自南京诺唯赞生物科技有限公司;LipofectamineTMLTX Reagent、DMEM和FBS均购自Life公司。
1.2 引物设计与合成
参考GenBank中山羊LMCD1基因预测序列(登录号:XM_005695648.2),根据ClonExpress MultiS One Step Cloning Kit的要求,利用CE Design v.1.03引物设计软件设计1对引物:F:5′-TCAGATCTCGAGCTCAAGCTTATGGCAAAG-GTGGCCAAGG-3′;R:5′-ATGGTGGCGACCGG-TGGATCCTCAGGAGCGTTTGGACTTGC-3′。 引物由南宁捷尼斯生物科技股份有限公司合成。
1.3 RT-PCR扩增
按照Trizol说明书提取背最长肌组织总RNA,使用紫外分光光度计测定RNA浓度和纯度后,反转录合成cDNA,-20 ℃保存备用。
以cDNA为模板进行PCR扩增。PCR反应体系15 μL:2×RapidTaqMasterMix酶7.5 μL,上、下引物各0.5 μL,cDNA 1.0 μL,加ddH2O补足体系。PCR反应程序:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸95 s,共30个循环。对PCR产物进行1.5%琼脂糖凝胶电泳鉴定后,用DNA凝胶回收试剂盒回收PCR阳性产物。
1.4 真核表达载体 pEGFP-N1-LMCD1的构建及鉴定
用Hind Ⅲ和BamH Ⅰ双酶切pEGFP-N1后,利用Cycle Pure Kit回收线性化载体。按照 ClonExpress MultiS One Step Cloning Kit说明书将线性化pEGFP-N1载体及目的片段定向连接。连接体系20 μL:5×CE Ⅱ Buffer 4 μL,Exnase Ⅱ 2 μL,线性化pEGFP-N1 4 μL,插入片段5 μL,ddH2O 5 μL。37 ℃孵育30 min后置于4 ℃迅速降温。 连接后的重组质粒命名为 pEGFP-N1-LMCD1,转化大肠杆菌DH5α感受态细胞,挑取单克隆菌落扩大培养并进行菌液PCR和测序验证。按照无内毒素质粒小提中量试剂盒说明书提取pEGFP-N1-LMCD1质粒,-20 ℃保存备用。
1.5 生物信息学分析
使用DNAStar中的Seq-Man软件对测序结果与GenBank数据库中公布的山羊LMCD1基因序列进行比对,之后进行相似性比对并构建系统进化树;利用ExPASy在线程序(https:∥www.expasy.org/)分析蛋白的基本理化性质及亲/疏水性;利用SignalP 4.0在线程序(http:∥www.cbs.dtu.dk/services/SignalP/)预测蛋白信号肽;利用TMHMM Server v.2.0在线程序(http:∥www.cbs.dtu.dk/services/TMHMM/)预测蛋白的跨膜结构域;利用NPS®SOPMA在线程序(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白的二级结构;利用SWISS-MODEL在线程序(http:∥swissmodel.expasy.org)预测蛋白的三级结构。
1.6 细胞培养及转染
复苏山羊骨骼肌卫星细胞,置于37 ℃、5% CO2培养箱中培养,待细胞融合度达到90%时传至6孔板中,待细胞融合度达到80%后转染。将提取的无内毒素pEGFP-N1-LMCD1及pEGFP-N1质粒稀释至浓度1 000 ng/μL,按照LipofectamineTMLTX Reagent说明书进行转染,并设阴性对照对照。转染后24和48 h使用Nikon T-80i倒置荧光显微镜观察荧光表达情况。
1.7 实时荧光定量PCR
按照试剂盒说明提取转染pEGFP-N1及pEGFP-N1-LMCD1质粒的山羊骨骼肌卫星细胞RNA,反转录合成cDNA,以其为模板进行实时荧光定量PCR检测LMCD1基因的表达水平。根据GenBank中羊LMCD1基因预测序列(登录号:XM_005695648.2),利用Primer Premier 5.0软件设计定量引物:F1:5′-ACCACTGCTTGAGCTCT-GAC-3′;R1:5′-GGTGGGATCTTTCCCTGTGG-3′;以GAPDH为内参基因,引物序列:F2:5′-CCCG-TTCGACAGATAGCCGTA-3′;R2:5′-GGTGGG-ATCTTTCCCTGTGG-3′。引物均由南宁捷尼斯生物科技股份有限公司合成。
PCR反应体系10 μL:TB Green Ⅱ酶5 μL,上、下游引物各0.3 μL,模板2.5 μL,RNase-free dH2O 1.9 μL。PCR反应程序:95 ℃ 30 s;95 ℃ 5s,60 ℃ 30 s,共40个循环。每个样本进行3次生物学重复,运用2-ΔΔCt法计算LMCD1基因的相对表达量。采用SPSS 24.0软件进行单因素方差分析(One-Way ANOVA),结果以平均值±标准误表示,以P<0.05为差异显著性判断标准。
2 结 果
2.1 LMCD1基因RT-PCR扩增与重组质粒pEGFP-N1-LMCD1构建
通过RT-PCR扩增努比亚山羊LMCD1基因目的片段,经1.5%琼脂糖凝胶电泳检测显示,得到单一条带,大小约为1 092 bp(图1),与预期大小相符。测序结果表明,所得基因片段大小与GenBank数据库中预测的山羊LMCD1基因CDS序列长度一致。构建重组质粒pEGFP-N1-LMCD1后转化大肠杆菌DH5α感受态细胞,经培养后挑取单菌落进行菌液PCR验证,1.5%琼脂糖凝胶电泳结果显示,条带大小约为1 092 bp,与预期结果一致。

图1 努比亚山羊LMCD1基因PCR扩增电泳结果Fig.1 Electrophoresis of PCR amplification results of LMCD1 gene in Nubian goats
2.2 生物信息学分析
2.2.1 序列比对 对获得的阳性重组质粒进行测序,测序结果用MegAlign软件进行分析比对,结果显示,努比亚山羊LMCD1基因CDS区全长1 092 bp,可编码363个氨基酸。LMCD1基因CDS区中有2处碱基发生突变(图2),其中974 bp处为错义突变,C变为T,丙氨酸变成了缬氨酸;1 065 bp处为同义突变。

图2 努比亚山羊LMCD1基因序列突变位点Fig.2 Sequence mutation site of LMCD1 gene in Nubian goats
2.2.2 相似性比对及系统进化树构建 将LMCD1基因序列分别与GenBank数据库中其他物种的LMCD1基因分子序列进行相似性比对,并构建系统进化树。结果显示,努比亚山羊LMCD1基因序列与山羊相似性最高(99.8%),而与斑马鱼相似性最低(55.4%),与其他物种的相似性在87.0%~98.8%之间(图3);马源LMCD1分子与人源处于同一小分支,亲缘关系较近,而与斑马鱼相距较远(图4)。相似性比对与系统进化树结果相一致,表明LMCD1分子在不同物种中较为保守。

图3 不同物种LMCD1基因相似性比对Fig.3 Similarity alignment of LMCD1 gene among different species
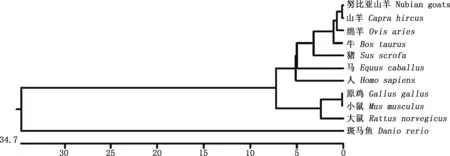
图4 LMCD1基因系统进化树Fig.4 Phylogenetic tree of LMCD1 gene
2.2.3 理化性质分析及信号肽预测 使用在线程序ExPASy中的ProtParam工具分析LMCD1基因编码蛋白的基本理化性质,结果显示,LMCD1基因共编码363个氨基酸,其中甘氨酸含量最高(8.8%),天冬酰胺含量最低(1.4%);同时包含46个带负电荷氨基酸残基(天冬氨酸+谷氨酸)和53个带正电荷氨基酸残基(精氨酸+赖氨酸)(表1)。LMCD1蛋白分子式为C1775H2818N508O533S29,原子总数为5 663,分子质量为40.73 ku。理论等电点(pI)为8.47,为碱性蛋白。半衰期为30 h;蛋白不稳定系数为51.41,为不稳定蛋白;脂肪指数为67.96。亲/疏水性分析发现,LMCD1蛋白第213位赖氨酸(Lys)亲水性最强(-3.289),第197位亮氨酸(Leu)疏水性最强(1.700)(图5)。整体看,该蛋白肽链大部分位于亲水区域,为亲水性蛋白。
2.2.4 信号肽及蛋白跨膜结构预测 利用SignaIP 4.0在线程序其信号肽进行预测,结果显示,LMCD1蛋白无信号肽(图6)。利用TMHMM Server v.2.0在线程序对其跨膜结构进行预测,结果显示,该蛋白不存在跨膜区(图7)。
2.2.5 二级结构及三级结构 利用SOPMA在线程序预测LMCD1蛋白二级结构发现,无规则卷曲、α-螺旋、延伸链和β-转角占比分别为53.17%、30.58%、11.85%和4.41%(图8)。利用SWISS-MODEL在线程序预测LMCD1蛋白三级结构(图9),与二级结构结果一致。
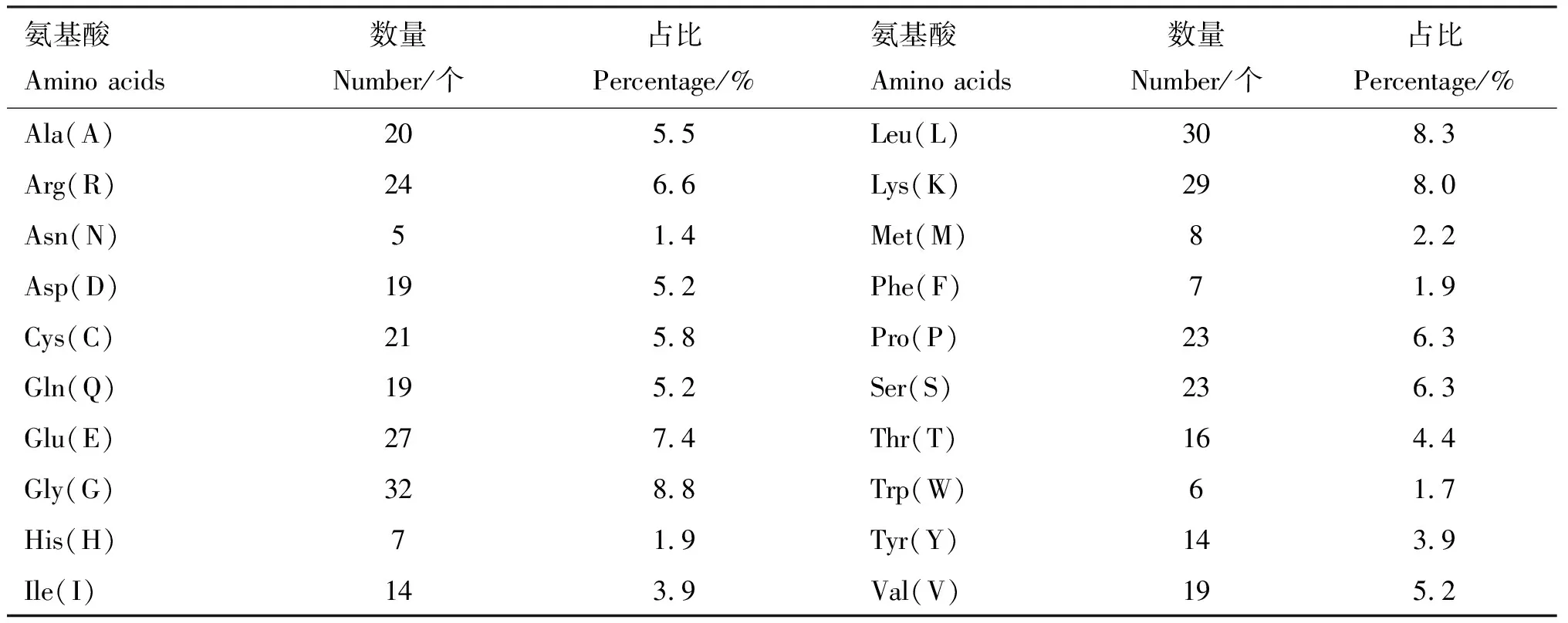
表1 努比亚山羊LMCD1蛋白氨基酸组成
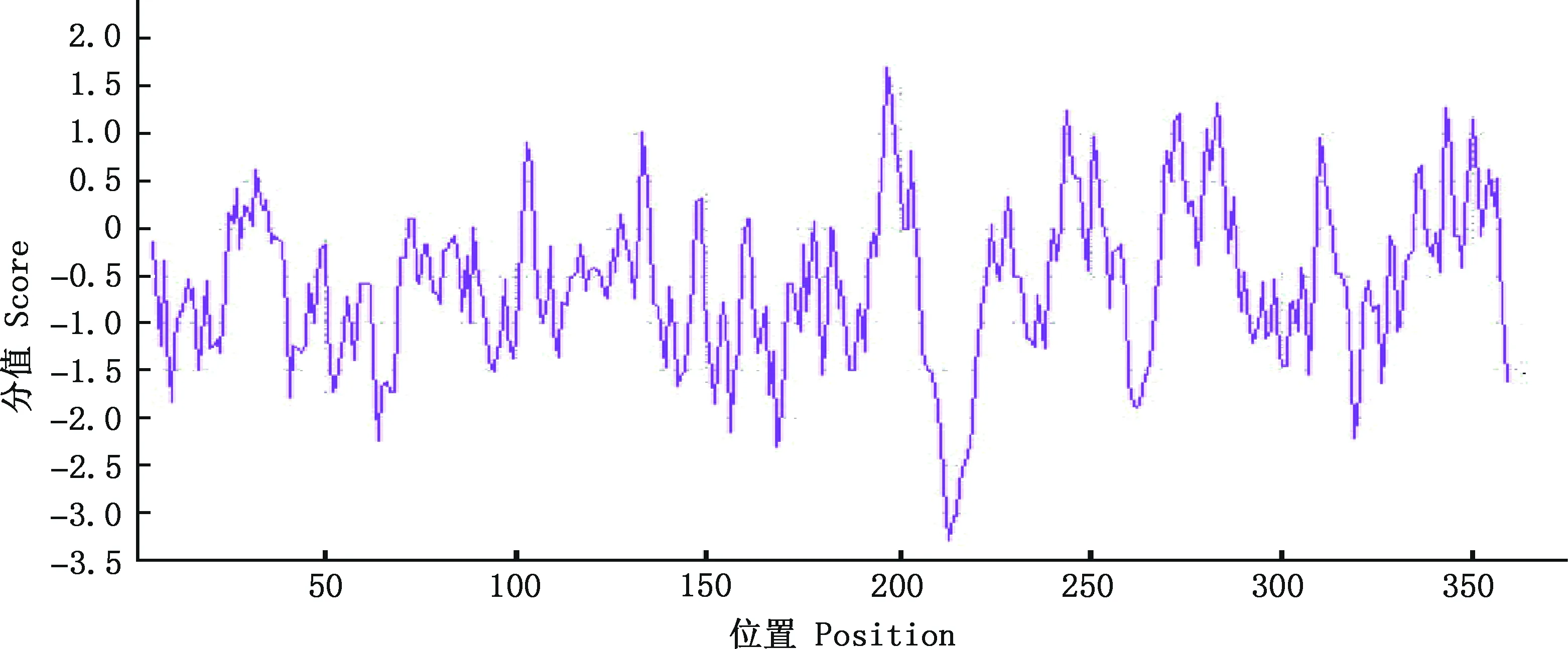
图5 努比亚山羊LMCD1蛋白亲/疏水性分析Fig.5 Hydrophilicity and hydrophobicity analysis of LMCD1 protein in Nubian goats
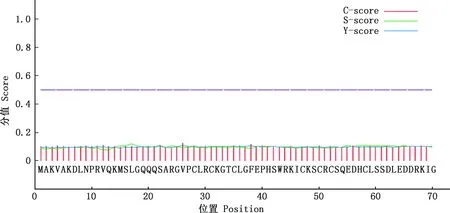
图6 努比亚山羊LMCD1蛋白信号肽预测Fig.6 Signal peptide prediction of LMCD1 protein in Nubian goats
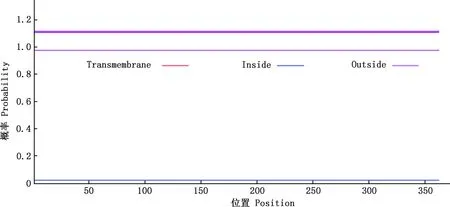
图7 努比亚山羊LMCD1蛋白跨膜结构预测Fig.7 Transmembrane structure prediction of LMCD1 protein in Nubian goats

H,α螺旋;e,延伸连;t,β转角;c,无规则卷曲H,Alpha helix;e,Extended strand;t,Beta turn;c,Random coil图8 努比亚山羊LMCD1蛋白二级结构预测Fig.8 Secondary structure prediction of LMCD1 protein in Nubian goats
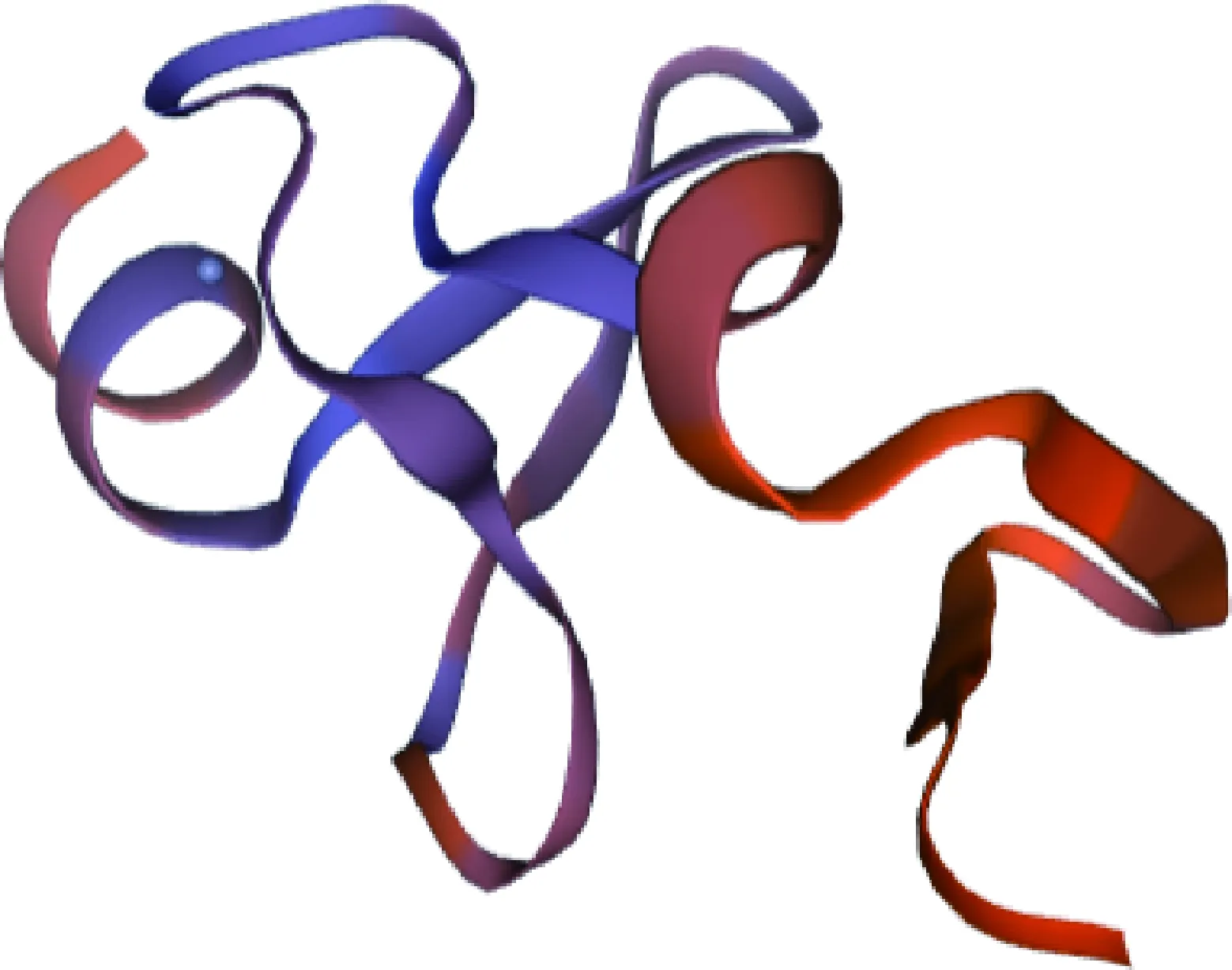
图9 努比亚山羊LMCD1蛋白三级结构预测Fig.9 Tertiary structure prediction of LMCD1 protein in Nubian goats
2.3 真核表达载体的构建及鉴定
利用限制性内切酶Hind Ⅲ和BamH Ⅰ双酶切pEGFP-N1-LMCD1重组质粒,得到2个片段分别为1 092和4 733 bp(图10),与预期大小一致。
2.4 pEGFP-N1-LMCD1表达载体转染骨骼肌卫星细胞
将pEGFP-N1-LMCD1、pEGFP-N1和阴性对照分别转染骨骼肌卫星细胞,转染48 h时在荧光倒置显微镜下观察到绿色荧光;在转染了pEGFP-N1-LMCD1、pEGFP-N1的细胞中能够观察到表达EGFP的细胞,而阴性对照未见荧光信号(图11)。表明本试验构建的pEGFP-N1-LMCD1载体在骨骼肌卫星细胞中成功表达,即pEGFP-N1-LMCD1真核表达载体构建成功。
分别提取pEGFP-N1-LMCD1和pEGFP-N1组努比亚山羊骨骼肌卫星细胞总RNA,反转录后进行实时荧光定量PCR检测,结果显示,pEGFP-N1-LMCD1组LMCD1基因表达量极显著高于pEGFP-N1组(P<0.01,图12),证明pEGFP-N1-LMCD1真核表达载体成功转入努比亚山羊骨骼肌卫星细胞并表达。
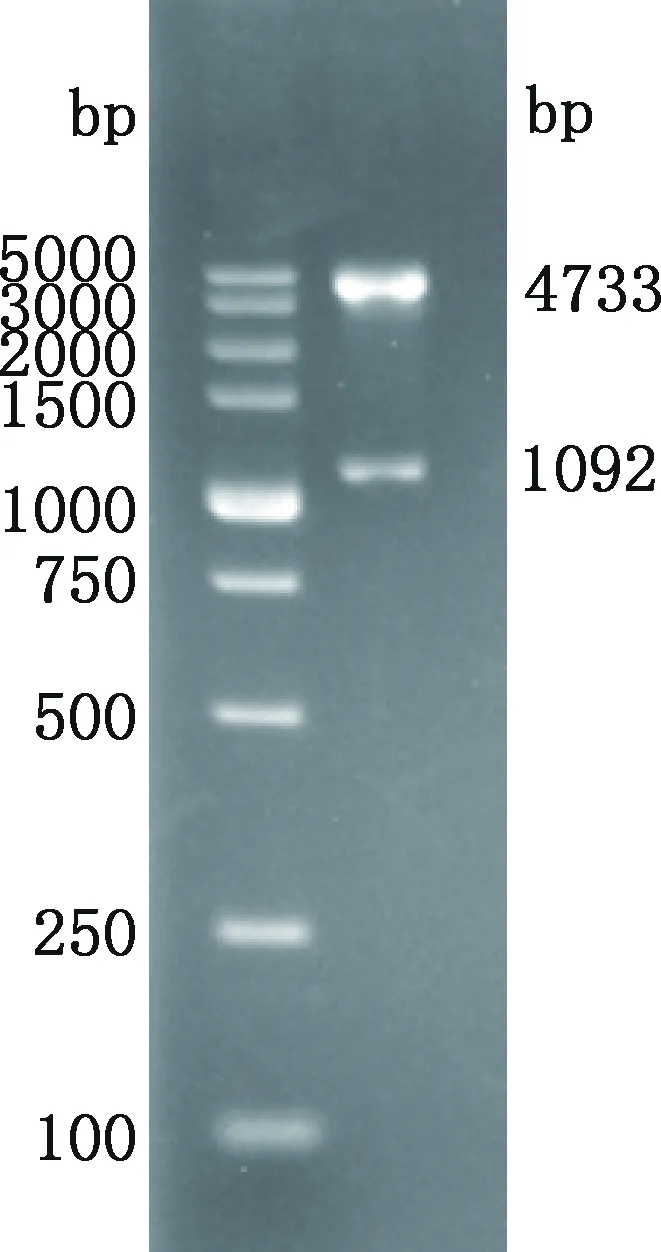
图10 真核表达载体pEGFP-N1-LMCD1的酶切鉴定Fig.10 Enzyme digestion of eukaryotic expression vector pEGFP-N1-LMCD1

图11 pEGFP-N1-LMCD1重组质粒转染骨骼肌卫星细胞(100×)Fig.11 Transfection of skeletal muscle satellite cells with pEGFP-N1-LMCD1 recombinant plasmid (100×)
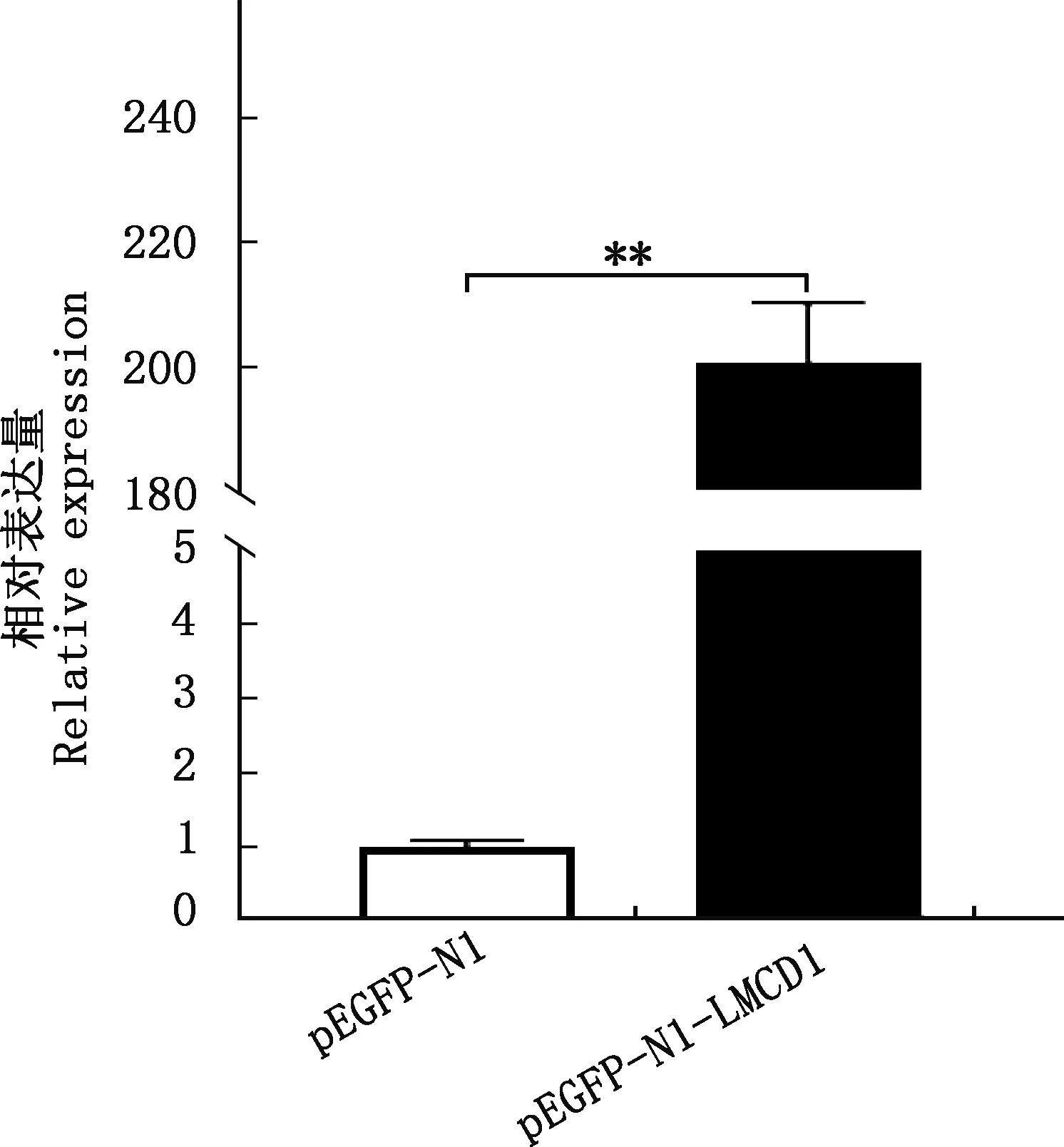
**,差异极显著(P<0.01)**,Extremely significant difference (P<0.01)图12 pEGFP-N1-LMCD1转染努比亚山羊骨骼肌卫星细胞后LMCD1基因的表达Fig.12 Expression of LMCD1 gene of skeletal muscle satellite cells transfected with pEGFP-N1-LMCD1 in Nubian goats
3 讨 论
肌肉LIM蛋白由2个相邻的LIM结构域和1个富含甘氨酸的结构域组成[18-19],它是骨骼肌和心肌发育的重要调节因子。LMCD1基因家族特有的LIM结构域和1个保守的富含半胱氨酸的基序主要在肌肉组织中表达[20]。目前已获得人LMCD1基因完整CDS区,并通过辐射杂交定位将该基因定位到3p26-p24;将小鼠LMCD1基因定位到6号染色体的中心区。Northern印迹分析发现,在大多数受试的成人和胎儿组织中存在1个1.7 kb的LMCD1转录本,其在骨骼肌中表达量最高;LMCD1在胎儿大脑、肝脏及成人大脑、肝脏、胸腺、小肠或外周血中很少或没有表达[6]。除此以外,LMCD1在肺脏的远端气道上皮、血管平滑肌和心肌中高表达,在造血和心血管组织中充当GATA功能的共激活剂,通过与GATA6相互作用限制GATA6在肺脏和心脏发育过程中的调控作用[18]。在小鼠上,LMCD1在体外和体内均能有效诱导心肌细胞肥大,而敲除该分子可防止心肌肥大。因此,LMCD1可能是新的抗肥厚策略的一个有吸引力的靶点[21]。
骨骼肌是人体中最具活力的组织之一,骨骼肌质量严格依赖于蛋白质降解和合成之间的适当平衡[22]。据报道,LMCD1是骨骼肌质量和功能的调节剂,正向调节肌肉质量,LMCD1表达在体内和体外增加蛋白质的合成,调控肌纤维的大小,减少肌浆网Ca2+释放,提高肌肉的抗疲劳性[16]。目前国内对LMCD1基因的研究较少,Wang等[23]对猪LMCD1基因CDS区进行克隆和序列分析,发现其在骨骼肌和心肌中均高度表达。Wang等[24]对猪LMCD1基因外显子3的G294A位点多态性进行了基因分型,并分析了该多态性与肉质和胴体性状的关系,结果显示,基因型频率为AA>AG>GG,且AA基因型的瘦肉率和脂肪率与AG基因型的相关性接近显著,LMCD1基因可能为猪育种中骨骼肌性状的候选基因,而在山羊上的研究却几乎没有。本研究扩增努比亚山羊LMCD1基因CDS区进行生物信息学分析,并构建其真核表达载体,为今后构建携带LMCD1外源基因的真核表达载体提供了数据支撑,也为后续研究LMCD1基因在山羊骨骼肌肌肉发育机制中的调控作用提供理论依据。
4 结 论
本试验成功扩增了努比亚山羊LMCD1基因CDS区序列,长度为1 092 bp,编码363个氨基酸;努比亚山羊LMCD1蛋白为不稳定的碱性亲水性蛋白,不存在跨膜结构;成功构建了pEGFP-N1-LMCD1重组质粒并将其转染至山羊骨骼肌卫星细胞,在细胞水平和分子水平上证实了该重组质粒成功转入努比亚山羊骨骼肌卫星细胞并检测到其表达。

