猪肠黏膜保护因子HO-1的短小芽孢杆菌表达系统建立与分析
刘靖松,付京城,温丙言,杨彦宾,郭 爽,焦显芹,陈 瑾,黄若超,王月影,李和平
(1.河南农业大学,农业农村部动物生化与营养重点开放实验室,郑州 450046;2.河南农业大学动物医学院,郑州 450046)
仔猪断奶后通常会导致生长性能下降和严重腹泻[1]。仔猪腹泻大多是因感染传染性胃肠炎病毒、饲养管理不当所引起的,这会导致仔猪肠道受损,进而使肠道菌群失调,致使有害的病原微生物大量增殖,破坏了肠黏膜功能。在过去的几十年里,抗生素被有效地用于治疗腹泻或改善断奶仔猪的生产性能[2],但是,过早使用抗生素容易破坏肠黏膜屏障[3-4]。因此,亟需寻找新的抗生素替代品来治疗断奶仔猪腹泻,提高仔猪的生产力。
血红素加氧酶(heme oxygenase,HO)是一种细胞内的限速酶,可以促进血红素的降解,并生成CO和胆绿素[5-6],存在3种亚型:HO-1、HO-2和HO-3。其中,HO-1是一种保护性因子,可以参与细胞保护、凋亡和炎症的调节[7],在猪、牛、羊等动物体内广泛存在。生理情况下,HO-1在胃肠道低浓度表达[8],但在病变和炎症时,HO-1的表达量上调可以明显抑制炎症反应并改善肠黏膜屏障的破坏[9-10]。研究发现,HO-1的上调可以改善SD大鼠放射性肠炎的胃肠道症状,明显降低细胞凋亡和炎症因子的表达[11]。目前有大量的证据证明HO-1的上调有助于改善肠道的炎症情况,修复肠道损伤[12-14]。
短小芽孢杆菌属于芽孢杆菌,是革兰氏阳性菌,作为新型的基因工程菌能够高效分泌多种细胞外蛋白[15],在电击转化法下可以表现出较高的转化率,易于构建克隆载体的表达。近期有研究表明,芽孢杆菌可以在胞外高效表达外源性的α-淀粉酶[16]、蛋白酶和普鲁兰酶[17],说明芽孢杆菌对外源蛋白的表达具有较为突出的优势。
尽管HO-1对肠黏膜屏障表现出较强的保护作用,但是从动物体内分离的HO-1成本较高、产量较低,且活性不高,很难直接用于大规模生产。因此,本研究对HO-1能否通过短小芽孢杆菌在体外表达进行探讨,为解决断奶仔猪腹泻提供新的方法。
1 材料与方法
1.1 组织样、菌株与质粒
猪脾脏组织和大肠杆菌DH5α感受态细胞均由河南农业大学农业部动物生化与营养重点开放实验室保存;短小芽孢杆菌HB116、穿梭载体pNCMO2、pMD19-T载体均购自TaKaRa公司。
1.2 主要试剂
DL2000 DNA Marker、DL5000 DNA Marker、DNA聚合酶、SMART MMLV Reverse Transcriptase、RNase Inhibitor、MiniBEST Plasmid Purification Kit、胶回收试剂盒、MiniBEST DNA Fragment Purification Kit均购自TaKaRa公司;T4 DNA连接酶购自NEB公司;2×SDS-PAGE蛋白上样缓冲液购自北京鼎国昌盛生物技术有限责任公司;蛋白质分子质量标准、限制性内切酶SalⅠ、KpnⅠ均购自Thermo Fisher Scientific公司;琼脂糖购自Genview公司;Anti-6×His Tag鼠源单克隆抗体、HRP标记的山羊抗鼠IgG均购自Abcam公司。
1.3 PCR扩增
根据GenBank中公布的HO-1基因序列(登录号:NM_001004027.1),利用Primer Premier 6.0软件设计特异性引物,引物序列为:F:5′-GCGTCGACATGGAGCACTCACAGCCCAA-3′;R:5′-R:CGGGGTACCTTAGTGATGGTGATGG-TGATGCATGGCATAAAGCCCCATGG-3′。 根据pNCMO2质粒多克隆位点的酶切位点序列,在猪HO-1基因引物序列中分别插入SalⅠ、KpnⅠ酶切位点及6×His标签。用Trizol法提取猪脾脏组织RNA,利用SMART MMLV Reverse Transcriptase反转录为cDNA,以cDNA为模板扩增HO-1基因,PCR扩增及检测均参照温丙言[18]方法进行。将鉴定正确的PCR产物用胶回收试剂盒纯化回收。
1.4 克隆载体构建及鉴定
按照pMD19-T载体试剂盒说明将HO-1与pMD19-T载体体系混匀,16 ℃连接12~16 h。连接产物转化大肠杆菌DH5α感受态细胞,冰浴30 min后,42 ℃ 90 s,结束后立即放在冰上5 min,在无菌操作台中加入1 335 μL无抗LB液体培养基,室温下220 r/min摇床孵育1 h。孵育结束后,取150 μL菌液涂布在LB固体(Amp+,100 μg/mL)培养基上,37 ℃过夜培养。
在无菌操作台内使用无菌枪头从LB固体培养基中挑选单个菌落接种于500 μL LB液体培养基(Amp+,100 μg/mL)中,37 ℃、220 r/min震荡孵育8 h,进行菌液PCR鉴定。使用1.0%琼脂糖凝胶电泳检测菌液PCR扩增产物,通过凝胶成像系统观察,对扩大培养的阳性克隆样品菌液提取质粒并送生工生物工程(上海)股份有限公司测序,重组质粒命名为pMD19-HO-1。
1.5 重组表达载体pNCMO2-HO-1构建及鉴定
将pNCMO2与pMD19-HO-1载体使用限制性内切酶SalⅠ、KpnⅠ进行双酶切,37 ℃孵育30 min,酶切产物通过1.0%琼脂糖凝胶电泳检测。胶回收酶切产物,将T4 DNA连接酶体系与纯化的酶切产物混匀,16 ℃下孵育12~16 h,转化大肠杆菌DH5α感受态细胞。 使用LB固体培养基(Amp+,100 μg/mL)对阳性克隆菌进行筛选与鉴定,方法同1.4,重组质粒命名为pNCMO2-HO-1。
1.6 短小芽孢杆菌的转化及重组HO-1的诱导表达
将2 mL短小芽孢杆菌菌液接种于250 mL MT液体培养基中,37 ℃、220 r/min震荡孵育至对数生长期(D600 nm值为0.4~0.8),冰上孵育30 min后,常温下6 000 r/min离心10 min收集菌体,使用预冷的电击缓冲液吹打洗涤1次,6 000 r/min离心5 min,重复3次,洗涤结束后使用100 μL电击缓冲液悬浮菌体。取300~500 ng纯化后的质粒加入悬浮的菌液中,使用电转仪进行电穿孔转化。阳性克隆菌的筛选与鉴定同1.4。
将测序正确的重组表达载体的菌液活化,接种于MT固体培养基(Nm+,10 μg/mL),37 ℃过夜孵育,挑选单菌落于5 mL MT固体培养基(Nm+,10 μg/mL)中,室温下120 r/min摇床孵育48~64 h,在1 mmol/L IPTG诱导前,构建阳性对照(pNCMO2-BLA表达α-淀粉酶约55 ku)和阴性对照(pNCMO2空载体),在相同条件下进行诱导表达。
1.7 SDS-PAGE电泳及Western blotting分析
对诱导表达HO-1的菌液5 000 r/min离心5 min,分离上清和菌体,使用相同体积的PBS对菌体重悬;使用超声波破碎仪将收集的细菌在PBS中裂解,分离上清和菌体;将SDS上样缓冲液加入裂解后的液体,在99 ℃沸水中孵育10 min,进行SDS-PAGE电泳。 使用考马斯亮蓝对SDS-PAGE电泳胶进行12~16 h染色,脱色后使用AmershamImager 600超灵敏多功能成像仪观察蛋白表达情况。将煮沸孵育后的样品进行Western blotting分析,转膜后对PVDF膜进行封闭、洗膜、孵育;使用Amersham Imager 600进行曝光并拍照。
2 结 果
2.1 HO-1基因的克隆及鉴定
本研究克隆获得猪HO-1基因CDS区,长约897 bp(图1),与预期片段大小相符。测序结果发现,所获序列与GenBank中HO-1基因序列(登录号为:NM_001004027.1)完全一致,编码298个氨基酸。
2.2 pMD19-T-HO-1克隆载体构建
将HO-1基因与pMD19-T载体连接,构建重组载体pMD19-T-HO-1,转化大肠杆菌DH5α感受态细胞,阳性克隆经菌液PCR鉴定发现,在约897 bp处有目的条带(图2),与预期大小相符。说明试验成功构建了pMD19-T-HO-1克隆载体。
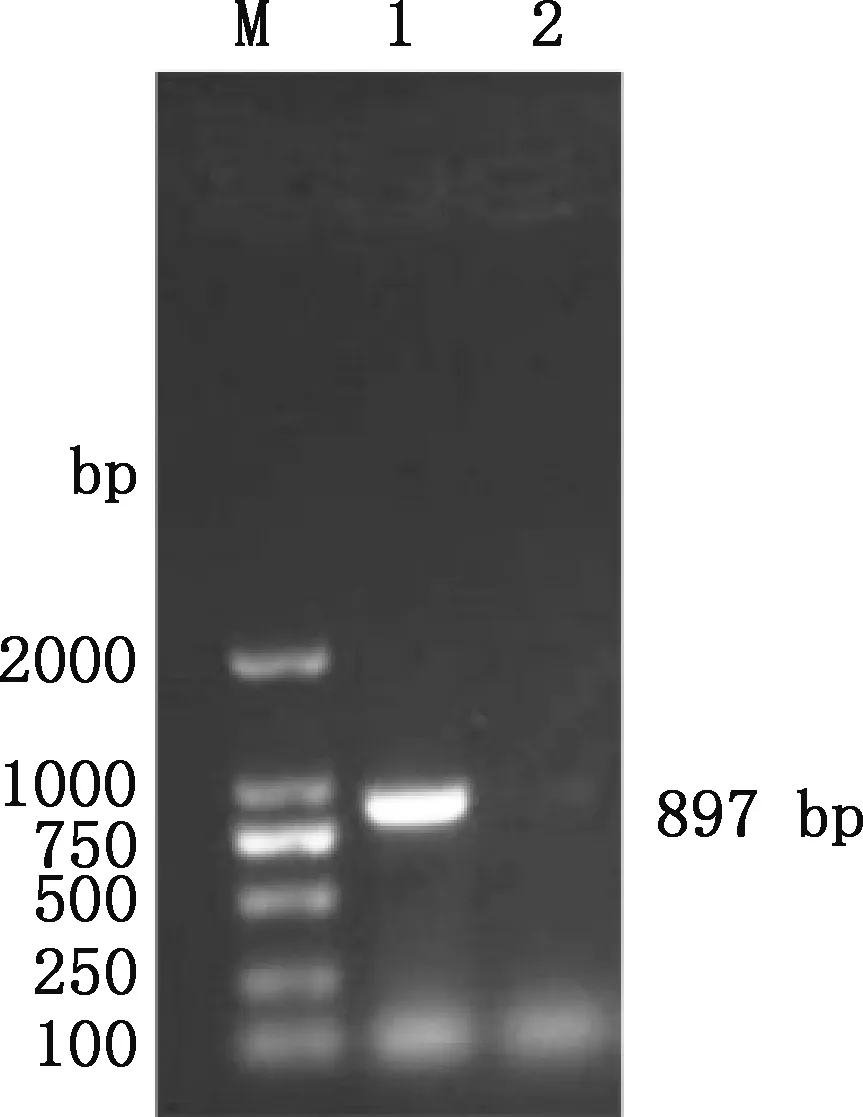
M,DL2000 DNA Marker;1,猪HO-1基因CDS区PCR扩增产物;2,阴性对照M,DL2000 DNA Marker;1,PCR amplification product of porcine HO-1 gene;2,Negative control图1 猪HO-1基因PCR扩增电泳图Fig.1 The ectrophoresis of PCR amplification of porcine HO-1 gene
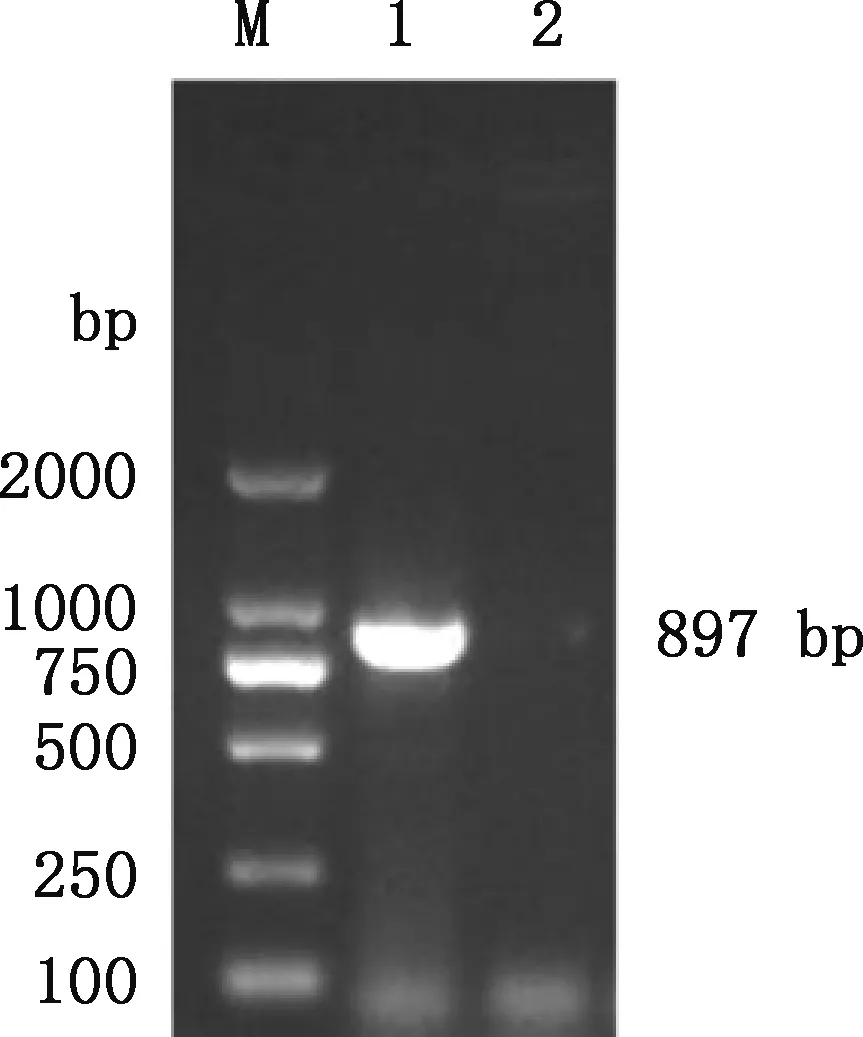
M,DL2000 DNA Marker;1,pMD19-T-HO-1重组载体;2,阴性对照M,DL2000 DNA Marker;1,pMD19-T-HO-1 recombinant vector;2,Negative control图2 pMD19-T-HO-1重组载体菌液PCR鉴定Fig.2 The bacteria PCR identification of pMD19-T-HO-1 recombinant vector
2.3 pNCMO2-HO-1重组表达载体构建
对表达载体pNCMO2和重组质粒pMD19-T-HO-1进行双酶切后,使用T4 DNA连接酶连接,转化大肠杆菌DH5α感受态细胞,阳性克隆经菌液PCR鉴定发现,在约897 bp处有目的条带(图3),与预期大小相符;提取阳性克隆质粒,经限制性内切酶SalⅠ和KpnⅠ双酶切,在约5 200和897 bp处分别观察到pNCMO2载体片段和HO-1基因片段(图4),均与预期大小相符。说明 pNCMO2-HO-1重组表达载体构建成功。
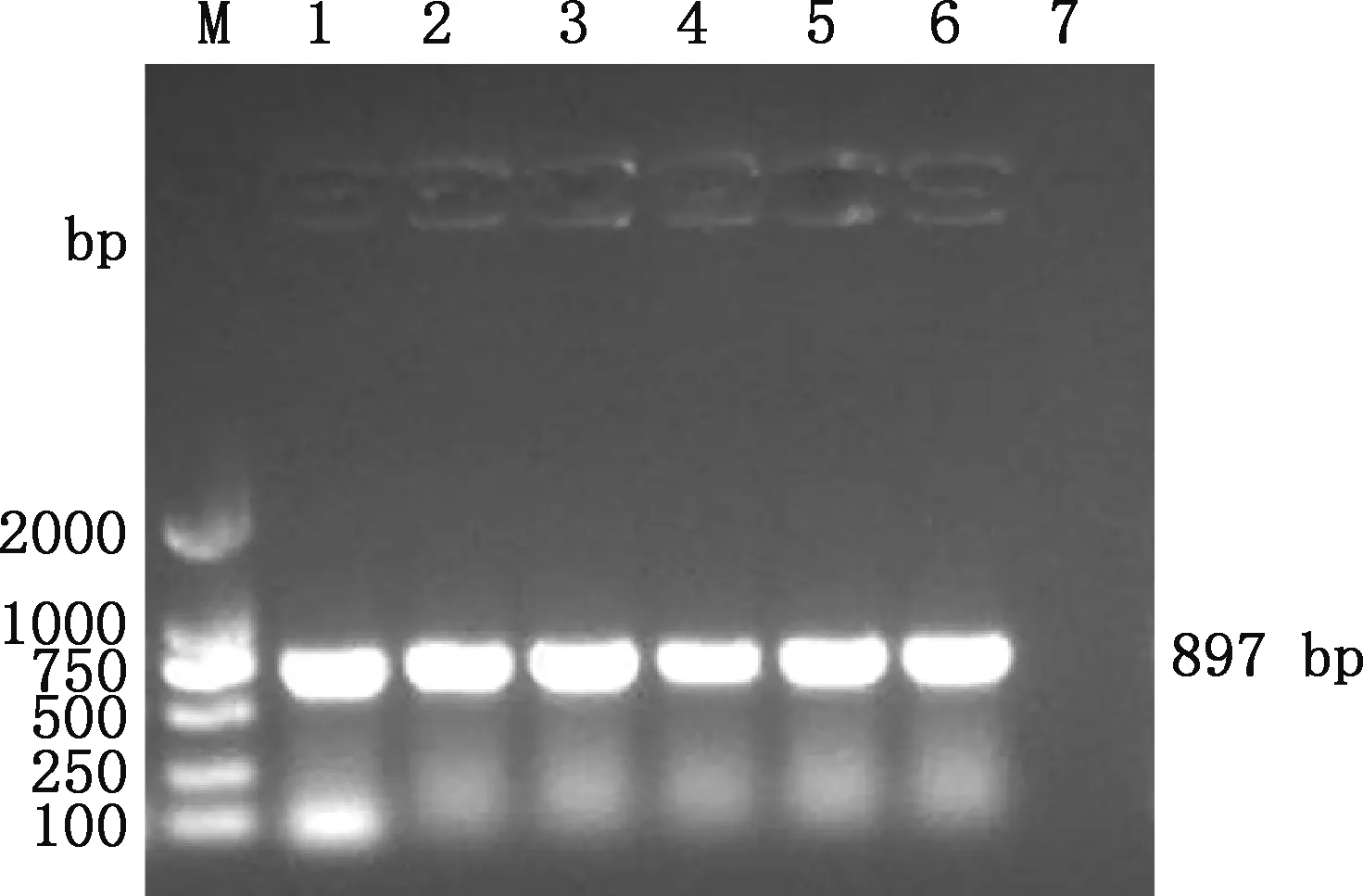
M,DL2000 DNA Marker;1~6,pNCMO2-HO-1重组载体;7,阴性对照M,DL2000 DNA Marker;1-6,pNCMO2-HO-1 recombinant vectors;7,Negative control图3 pNCMO2-HO-1重组表达载体菌液PCR鉴定Fig.3 The bacteria PCR identification of pNCMO2-HO-1 recombinant expression vector
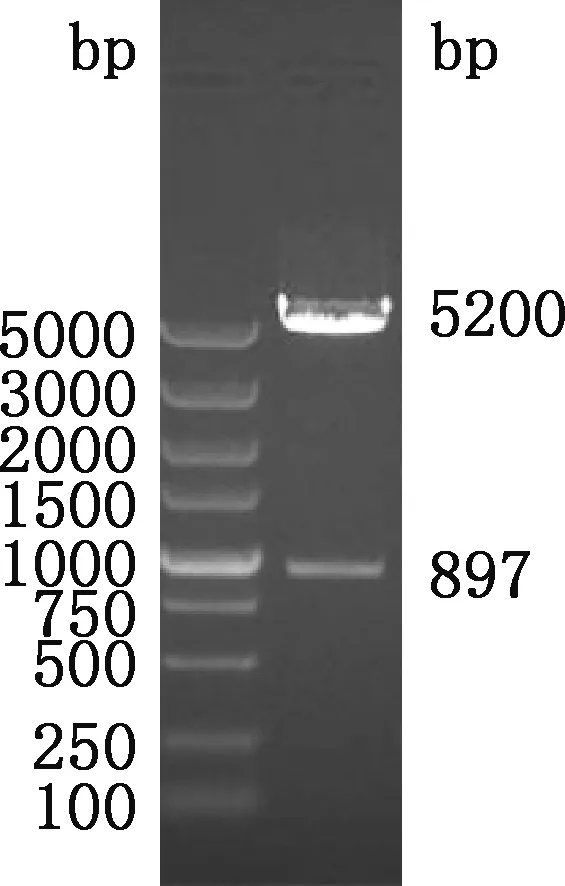
图4 pNCMO2-HO-1重组表达载体双酶切鉴定Fig.4 Double enzyme digestion identification of pNCMO2-HO-1 recombinant expression vector
2.4 短小芽孢杆菌的电转化
将pNCMO2-HO-1重组表达载体通过电转化技术转入短小芽孢杆菌,菌液PCR鉴定发现约897 bp大小片段(图5),与预期相符。重组菌经SalⅠ和KpnⅠ双酶切,分别在5 200和897 bp处获得预期大小片段(图6)。提示重组表达载体pNCMO2-HO-1成功转入短小芽孢杆菌。
2.5 重组融合蛋白分析
将测序正确的质粒pNCMO2-HO-1转入短小芽孢杆菌,裂解菌液后经SDS-PAGE检测,结果显示,pNCMO2-HO-1诱导后上清中在36.5 ku处有明显的蛋白条带,而其他对照组在该位置未观察到蛋白(图7),说明HO-1重组蛋白成功表达。 Western blotting结果显示,pNCMO2-HO-1诱导后上清液中能够分泌出36.5 ku的蛋白(图8),大小与预期相符,pNCMO2-HO-1诱导后全菌蛋白中未检测到蛋白表达,说明成功表达了HO-1重组蛋白。
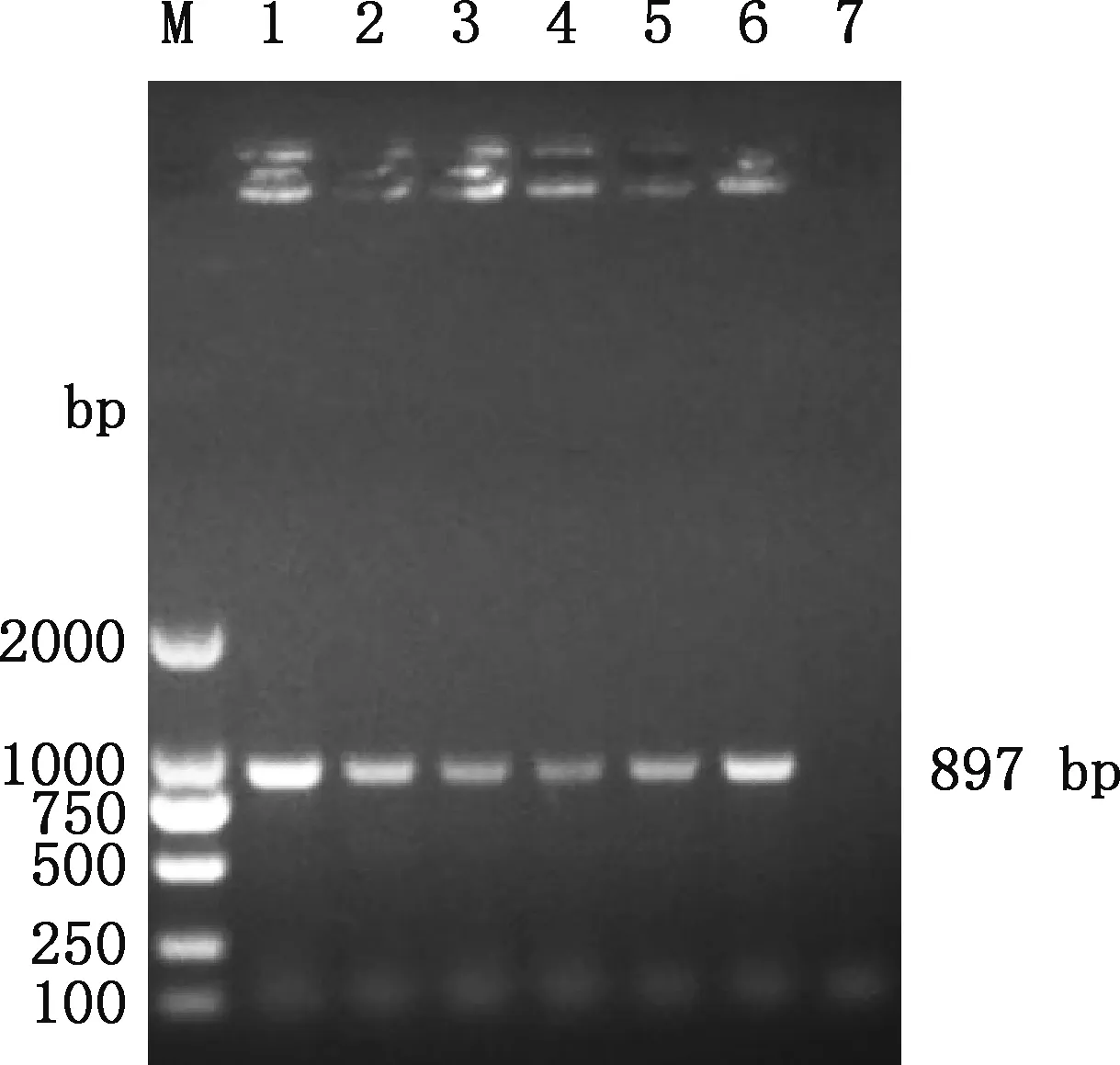
M,DL2000 DNA Marker;1~6,pNCMO2-HO-1重组菌液;7,阴性对照M,DL2000 DNA Marker;1-6,pNCMO2-HO-1 recombinant bateria;7,Negative control图5 pNCMO2-HO-1重组菌PCR鉴定Fig.5 PCR identification of pNCMO2-HO-1 recombinant bacteria
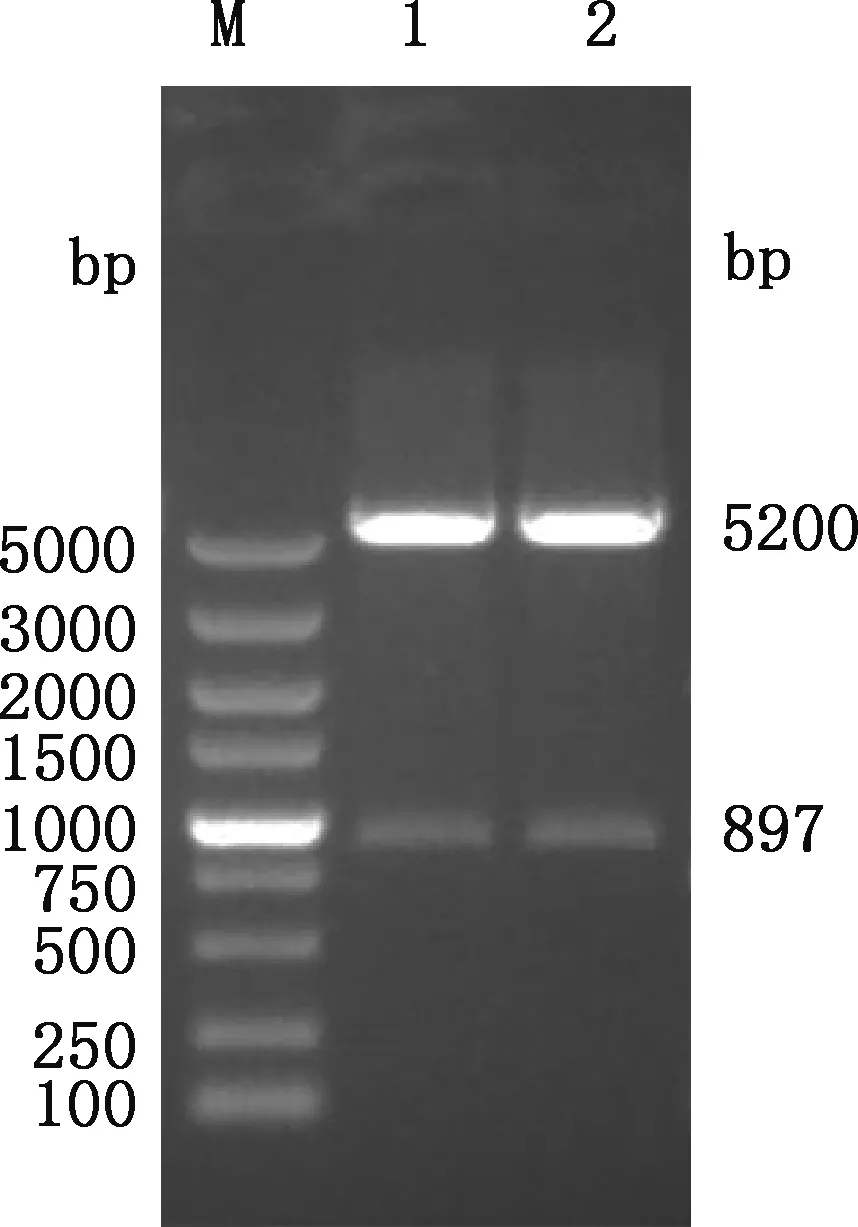
M,DL5000 DNA Marker;1、2,pNCMO2-HO-1重组菌液经Sal Ⅰ和Kpn Ⅰ双酶切M,DL5000 DNA Marker;1 and 2,pNCMO2-HO-1 recombinant bacteria digestion by restriction enzyme Sal Ⅰ and Kpn Ⅰ图6 pNCMO2-HO-1重组菌双酶切鉴定Fig.6 Double enzyme digestion identification of pNCMO2-HO-1 recombinant bacteria
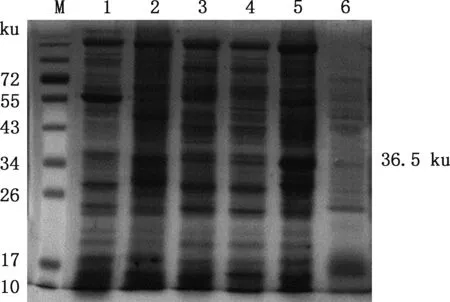
M,蛋白质分子质量标准;1,pNCMO2-BLA诱导后上清;2,pNCMO2-BLA诱导后全菌;3,pNCMO2诱导后上清;4:pNCMO2诱导后全菌;5,pNCMO2-HO-1诱导后上清;6,pNCMO2-HO-1诱导后全菌M,Protein Marker;1,The supernatant of pNCMO2-BLA after induction;2,The total bacterium of pNCMO2-BLA after induction;3,The supernatant of pNCMO2 after induction;4,The total bacterium of pNCMO2 after induction;5,The supernatant of pNCMO2-HO-1 after induction;6,The total bacterium of pNCMO2-HO-1 after induction图7 pNCMO2-HO-1表达产物SDS-PAGE结果Fig.7 Analysis of pNCMO2-HO-1 expression by SDS-PAGE

1、3,pNCMO2-HO-1诱导后上清蛋白;2、4,pNCMO2-HO-1诱导后全菌蛋白1 and 3,The supernatant protein of pNCMO2-HO-1 after incubation;2 and 4,The total bacterium protein of pNCMO2-HO-1 after induction图8 pNCMO2-HO-1表达产物Western blotting结果Fig.8 Analysis of pNCMO2-HO-1 expression by Western blotting
3 讨 论
肠黏膜屏障主要是由机械屏障、生物屏障、免疫屏障及化学屏障组成,它们可以阻止内毒素、细菌等病原物质进入动物机体[19],是影响断奶仔猪腹泻的一个重要因素。断奶仔猪因其肠道系统发育不够完善容易出现消化不良和腹泻的现象,加上环境中病原微生物的入侵及消化道酶系统的不健全,这使其更容易患上腹泻。仔猪肠黏膜损伤后会使肠道菌群失调,导致一些抗逆性强的微生物大量繁殖,阻碍仔猪的生长发育,严重的可以引起死亡。同时,一些抗生素的滥用导致这种损伤进一步加剧。因此,肠黏膜屏障的完整性对于维护仔猪的健康至关重要。
HO在进化上高度保守,可以参与多种生理和病理过程。作为其同工酶之一的HO-1因其重要的保护作用受到人们的广泛研究。在肠道疾病相关的损害方面,HO-1可以发挥细胞保护、抗凋亡、抗氧化等重要的保护作用;在炎症性肠病的小鼠模型中,可通过外源性补充血红素上调HO-1来改变单核细胞、巨噬细胞和中性粒细胞的浸润,修复肠黏膜屏障的损伤[20];在肠缺血再灌注损伤方面,HO-1的过表达可以抑制活性氧(ROS)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)的表达,提高损伤小鼠的成活率[21]。 近期研究发现,高表达量的HO-1可以通过MAPK信号通路增加紧密连接蛋白的表达及减少凋亡因子Caspase-3的表达来修复肠上皮屏障功能障碍[22]。 此外,HO-1能减轻右旋糖酐硫酸钠所致的肠道炎症,减少炎症因子TNF-α的表达,维持肠黏膜形态的完整,从而对肠黏膜屏障起到一定的保护作用[23]。基于HO-1的肠黏膜保护作用,本研究克隆出猪HO-1基因CDS序列,全长897 bp,编码298个氨基酸。 将HO-1基因片段与pMD19-T克隆载体连接,通过阳性克隆菌的筛选与鉴定后,在897 bp处发现目的条带,证明成功构建了pMD19-T-HO-1载体。
本研究采用短小芽孢杆菌表达系统来表达外源性蛋白HO-1,相较于大肠杆菌表达系统,其具有较为突出的优势。芽孢杆菌只有一层细胞膜,异源性蛋白在其系统内表达最高可以达到20 g/L以上,因此芽孢杆菌系统非常适合表达外源性蛋白[24]。此外,短小芽孢杆菌本身就是益生菌,没有致病性,且不产生内毒素[25],可以产生多种胞外酶,同时也可以分泌抑菌物质,高效地产生和分泌目标蛋白[26]。因此,许多研究都通过芽孢杆菌系统表达外源基因蛋白,如耐糖木聚糖酶[27]、IL-2[28]、环糊精葡萄糖基转移酶[29]等。本试验使用pNCMO2载体来实现HO-1在短小芽孢杆菌表达系统的外源性表达,相较于其他表达载体,它可以稳定穿梭于短小芽孢杆菌和大肠杆菌之间并稳定复制,克服了拷贝数低的问题。目前,使用pNCMO2载体实现了三叶因子3(TFF3)[30]、蔗糖异构酶[31]、嗜热脂肪芽孢杆菌WSH13-17所产生的α-淀粉酶[32]在芽孢杆菌系统内高效表达。本研究使用限制性内切酶对pMD19-T-HO-1和pNCMO2进行双酶切,在T4 DNA连接酶作用下,成功构建了pNCMO2-HO-1重组表达载体。
本研究采用IPTG诱导pNCMO2表达HO-1,IPTG作为乳糖操纵子的诱导剂,可以提高外源性蛋白的表达量并缩短表达周期[33],从而有利于获得大量的可溶性蛋白HO-1。本试验中HO-1融合蛋白在短小芽孢杆菌中经1 mmol/L IPTG、30 ℃诱导一段时间后,经SDS-PAGE和Western blotting分析,在裂解菌液的上清中鉴定到重组蛋白,大小为36.5 ku,表明重组菌诱导出来的蛋白是以可溶性蛋白的形式存在于上清之中,HO-1序列中添加了6个His标签,并没有干扰融合蛋白的结构与功能。因此,利用短小芽孢杆菌可以用于工业化生产黏膜保护因子HO-1,为治疗仔猪腹泻奠定基础。
4 结 论
本研究克隆出HO-1基因并连接到pNCMO2表达载体中,使用短小芽孢杆菌HB116作为表达载体宿主菌,诱导后经SDS-PAGE电泳和Western blotting鉴定确定有融合目的蛋白表达,且获得的融合蛋白具有良好的抗原性和特异性。

