基于AMPK通路研究葛根素对猪前体脂肪细胞成脂分化的影响
吕香州,张 琪,李 欣,于永生
(吉林省农业科学院动物生物技术研究所,公主岭 136100)
葛根素是从豆科植物野葛根部提取出来的一种异黄酮衍生物,在生物学中被广泛用于治疗代谢类疾病,在小鼠[1]、草原红牛[2]前体脂肪细胞中添加葛根素能够显著增加脂肪细胞的诱导分化和脂质沉积。在前期研究中发现,松辽黑猪前体脂肪细胞诱导液中加入40 μmol/L葛根素能够显著提高细胞甘油三酯含量,并对成脂标志基因及蛋白有显著上调作用[3]。但葛根素通过何种途径对脂肪细胞成脂分化进行调节尚未得知。
脂肪代谢是一个由多种通路和因子参与的复杂过程,其中过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT增强子结合蛋白α(C/EBPα)扮演着重要的角色,其表达量高低能够说明脂肪细胞分化程度,因此常作为成脂标志基因[2-3]。以腺嘌呤核糖核苷酸(AMP)依赖的蛋白激酶(AMPK)主导的AMPK通路也在脂肪代谢中发挥着重要的作用,AMPK蛋白是一种由3个蛋白质亚基(α、β和γ)组成的活性酶[4],该蛋白能够调节各种生理应激中的AMP和腺嘌呤核糖二磷酸(ADP)水平,从而直接调节所有能量消耗和产生途径,可通过检测AMPK各亚基(PPKAG1、PPKAG2、PPKAB1、PPKAB2、PPKAA1)的相对表达量来反映AMPK蛋白在mRNA层面的相对表达量[5-6]。AMPK蛋白作为AMPK通路核心蛋白有许多下游蛋白,其中乙酰辅酶A羧化酶(ACC)和羟甲基戊二酰辅酶A(HMG-CoA)还原酶是最早发现的AMPK的2个受体蛋白。HMG-CoA在机体催化甘油三酯(TG)合成过程中起限速酶作用,当AMPK被激活时,其下游受体蛋白HMG-CoA还原酶活性降低,肝脏中甘油三酯合成下调[7]。
脂肪酸合成酶(FAS)可催化相关酶聚合成长链脂肪酸,最终在肝细胞中以甘油三酯的形式贮存。激活的AMPK蛋白可降低FAS活性,降低游离脂肪酸(FFA)含量,从而降低甘油三酯含量[8]。下游因子ACC在AMPK作用下发生磷酸化失去活性,从而导致脂肪酸合成关键中间产物丙二酰辅酶A的合成减少[9],丙二酰辅酶A由乙酰辅酶A经ACC羧化形成,其在细胞内蓄积程度将影响脂质沉积和脂肪酸氧化[10]。过氧化物酶体增殖物激活受体γ辅激活因子-1α(PGC-1α)是一种激活线粒体脂肪酸氧化以产生热量的分子开关,其在细胞内的表达是促进棕色脂肪谱系分化的必要过程[11]。AMPK通过调节PGC-1α刺激线粒体形成,且AMPK调节线粒体相关基因表达从而通过脂肪酸氧化和肝脏糖异生促进脂质代谢[12],即AMPK可通过激活PGC-1α促进脂肪分解。吕香州等[3]研究发现,葛根素诱导的松辽黑猪前体脂肪细胞中ACC基因表达量显著上调,但ACC上调是否由AMPK的变化导致并未做深层研究。
本试验以松辽黑猪前体脂肪细胞为研究对象,通过在细胞诱导过程中添加葛根素、AMPK激活剂和抑制剂,检测分化完全的脂肪细胞中甘油三酯含量、脂肪分化基因及蛋白相对表达量,以探究葛根素对松辽黑猪前体脂肪细胞的影响以及其与AMPK通路之间的关系。
1 材料与方法
1.1 主要试剂及仪器
葛根素购自北京索莱宝科技有限公司;青-链霉素、胎牛血清(FBS)、PBS、Trypsin-EDTA、Trizol Reagent、PageRuler Prestained Protein Ladder均购自赛默飞世尔科技(中国)有限公司;胰岛素(insulin)、地塞米松(DEX)、3-异丁基-1-甲基黄嘌呤(IBMX)、油红O干粉均购自Sigma公司;4%多聚甲醛购自北京鼎国昌盛生物技术有限责任公司;AICAR、CompoundC购自MedChemExpress公司;Nonfat Dry Milk、Anti-rabbit购自CST公司;PPARγ、β-actin抗体均购自爱必信(上海)生物科技有限公司;ACC、AMPK、p-AMPK(Thr172)均购自北京博奥森生物技术有限公司;甘油三酯酶法测定试剂盒购自北京普利莱基因技术有限公司;BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;实时荧光定量PCR LightCycler 480 SYBR Green Ⅰ Master试剂盒购自罗氏(中国)有限公司;Western blotting所需PAGE凝胶快速制备试剂盒(12.5%、7.5%)购自上海雅酶生物医药科技有限公司;10×Membrane Blocking/Washing Buffer(TBST)购自北京康润诚业生物科技有限公司;PVDF免疫印迹膜均购自默克(中国)有限科技公司。酶标仪(FC)购自赛默飞世尔科技(中国)有限公司;实时荧光定量PCR仪(Roche 480)购自Roche公司。
1.2 松辽黑猪前体脂肪细胞分离、传代及诱导分化
取12日龄松辽黑猪(吉林省农业科学院畜牧所提供)腹股沟脂肪组织,用75%酒精消毒清洗后在PBS中剪碎,加入0.1%胶原酶37 ℃水浴消化30 min。将消化液反复吹打并用25 μm(100目)孔径尼龙筛网过滤,滤液1 800 r/min离心5 min,用完全培养基(DMEM+10% FBS+1%青-链霉素)清洗3次,加入完全培养基并置于37 ℃恒温培养箱。分离的前体脂肪细胞每48 h更换完全培养基。待细胞长至完全汇合后吸弃完全培养基并用PBS洗去残余培养基。加入0.25%胰酶消化2~3 min,将细胞悬液1 500 r/min离心5 min,用完全培养基吹打混匀细胞沉淀,并按1∶3进行传代。
待传代后的松辽黑猪前体脂肪细胞汇合度为90%时将完全培养基更换为诱导液Ⅰ(DMEM+10% FBS+0.5 mmol/L IBMX+1 μmol/L DEX+10 μg/mL胰岛素),记为第0天,48 h后将诱导液Ⅰ更换为诱导液Ⅱ(DMEM+10% FBS+10 μg/mL胰岛素)。 将细胞分为对照组(Con)、葛根素组(Pue)、葛根素+AMPK激活剂AICAR组(AICAR)及葛根素+AMPK抑制剂CompoundC组(CompoundC),对照组诱导液Ⅱ中不添加葛根素,Pue组添加40 μmol/L葛根素[3],AICAR组添加40 μmol/L葛根素+500 μmol/L AICAR[13],CompoundC组添加40 μmol/L葛根素+20 μmol/L CompoundC[13]。诱导液Ⅱ处理48 h后更换为完全培养基,每48 h换液,培养至第8天,收集细胞用于后续检测。
1.3 葛根素对脂质沉积的影响
1.3.1 油红O染色 培养至第8天,用PBS清洗3次各组松辽黑猪前体脂肪细胞,在37 ℃培养箱中用4%多聚甲醛固定30 min。用PBS清洗3次后加1 mL油红O染色工作液,30 min后用PBS清洗3次,在倒置显微镜下观察细胞染色情况并拍照。
1.3.2 甘油三酯浓度测定 将换液培养至第8天的各组细胞用PBS清洗2遍,用0.1%胰酶消化后将细胞收集至15 mL离心管内,1 500 r/min离心5 min,吸弃上清后加入200 μL甘油三酯裂解液,室温裂解10 min后取上清。70 ℃加热10 min后室温2 000 r/min离心5 min。PBS稀释甘油标准品为1 000、500、250 μmol/L以制作标准曲线。将不同浓度标准品、先前取得待测样品与试剂盒内的R1、R2以4∶1混合后的工作液混合后在37 ℃培养箱中孵育30 min。用FC型酶标仪检测550 nm处的吸光值,根据标准曲线方程计算样品中甘油三酯浓度。
1.4 葛根素对成脂分化的影响
1.4.1 实时荧光定量PCR检测成脂分化基因的表达 Trizol法提取培养至第8天的各组细胞的RNA,并反转录为cDNA,根据GenBank中各基因序列,用Primer Premier 5.0设计引物,引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。 以GAPDH为内参,检测脂肪细胞中C/EBPα、PPARγ、ACC以及AMPK各亚基的表达量。PCR反应体系20 μL:2×SYBR Green Ⅰ10 μL,上、下游引物各0.5 μL,cDNA 1 μL,ddH2O 8 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性10 s,退火(温度见表1) 15 s,72 ℃延伸20 s,共45个循环;95 ℃ 5 s,65 ℃ 1 min。

表1 引物信息
续表
1.4.2 Western blotting检测成脂分化蛋白的表达 将培养至第8天的各组细胞用PBS清洗2次后加入200 μL RIPA(含磷酸酶抑制剂)裂解液,吹打混匀并收集至1.5 mL离心管中,1 500 r/min离心5 min并取上清。用BCA法测定上清中蛋白浓度,取30 μg蛋白进行聚丙烯酰胺凝胶电泳,聚丙烯酰胺凝胶浓度为12.5%(ACC所用凝胶为7.5%),浓缩胶与分离胶体积之比为1∶3。80 V电压电泳至蛋白完全穿过浓缩胶后更换电压为120 V,待Marker分离完全后,将蛋白以200 mA电流湿转至PVDF膜上,裁剪膜后用5%脱脂奶粉封闭2 h。TBST洗膜3次,每次5 min。 一抗PPARγ(1∶1 000)、ACC(1∶1 000)、AMPK(1∶1 000)、p-AMPK(1∶500)、β-actin(1∶5 000) 4 ℃摇床上80 r/min孵育过夜。TBST洗膜3次后,加二抗Anti-rabbit IgG(1∶5 000)室温孵育2 h,TBST洗膜3次后用ECL超敏显色液显色。
1.5 葛根素与AMPKα分子对接预测
在NCBI上下载AMPKα氨基酸序列(登录号:NM_001167633),在SWISS网站上对其结构进行预测并保存PDB格式,通过Autodock Vina 1.20软件进行分子对接预测,用PyMol 2.2软件进行3D图绘制,用Discovery Studio 2021软件进行二维图绘制。
1.6 数据统计分析
每组试验重复3次,用SPSS 25.0进行单因素方差分析,采用邓肯检验进行组间差异分析,结果以平均值±标准差表示。用Image J V1.8.0软件对Western blotting图像进行灰度分析,用GraphPad Prism 7.0软件作图。P<0.05表示差异显著。
2 结 果
2.1 葛根素对脂质沉积的影响
由图1、2可知,与Con组相比,Pue组脂滴含量明显上升,甘油三酯浓度显著上调(P<0.05);与Pue组相比,AICAR组脂滴含量减少,甘油三酯浓度显著降低(P<0.05),CompoundC组甘油三酯浓度无显著变化(P>0.05)。
2.2 葛根素对成脂分化基因的影响
由图3可知,与Con组相比,Pue组PPKAG2、PPKAB1、PPKAB2、PPKAA1、PGC-1α表达量均显著降低(P<0.05),Pue组C/EBPα、PPARγ、ACC表达量均显著增加(P<0.05);与Pue组相比,AICAR组PPKAG1、PPKAG2、PPKAB1、PPKAB2、PPKAA1表达量显著增加(P<0.05),AICAR组C/EBPα、PPARγ、ACC表达量均显著降低(P<0.05),CompoundC组PPKAG1、PPKAG2、PPKAB2表达量均显著降低(P<0.05),CompoundC组C/EBPα、ACC表达量均显著增加(P<0.05)。
2.3 葛根素对成脂分化相关蛋白的影响
由图4可知,与Con组相比,Pue组成PPARγ、ACC蛋白表达量显著增加(P<0.05),AMPK、p-AMPK蛋白表达量显著降低(P<0.05),且p-AMPK/AMPK显著降低(P<0.05);与Pue组相比,AICAR组PPARγ、 ACC蛋白表达量显著降低(P<0.05),AMPK、 p-AMPK蛋白表达量及p-AMPK/AMPK显著增加(P<0.05),CompoundC组PPARγ、ACC蛋白表达量均显著增加(P<0.05),AMPK、p-AMPK蛋白表达量及p-AMPK/AMPK均显著降低(P<0.05)。
2.4 葛根素与AMPKα亚基对接预测
葛根素与AMPKα最佳结合模式如图5A所示。由图5A可知,葛根素与GLU281、ARG265、LYS262、GLU196、HIS133之间可形成5个氢键。由图5B可知,除5个氢键外,葛根素还可与ARG134、ILE261、PRO195之间形成5个Pi-阳离子键,与ASP130之间形成Pi-阴离子键。
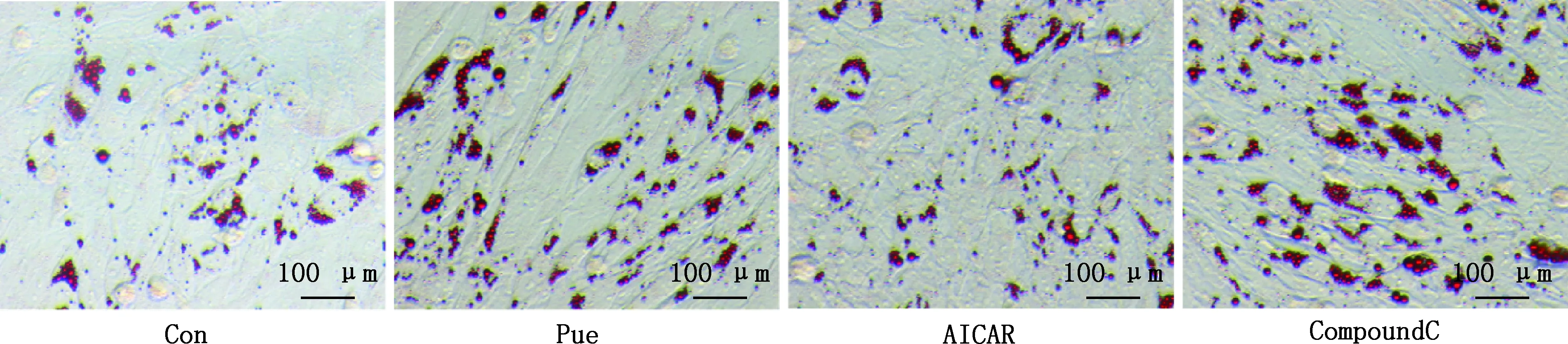
图1 不同处理组脂滴形态(200×)Fig.1 Lipid droplet morphology in different treatment groups (200×)

肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同Values with different letters superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).The same as below图2 不同处理组甘油三酯含量Fig.2 Triglyceride content in different treatment groups
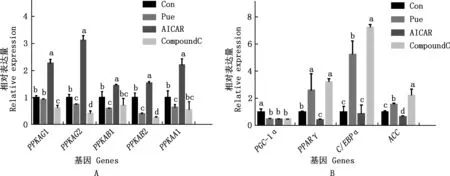
A,AMPK各亚基的表达量;B,成脂分化基因的表达量A,Expression of each subunit of AMPK;B,expression of adipogenic differentiation genes图3 不同处理组AMPK各亚基及脂肪分化基因的相对表达量Fig.3 Relative expression of AMPK subunits and adipose differentiation genes in different treatment groups
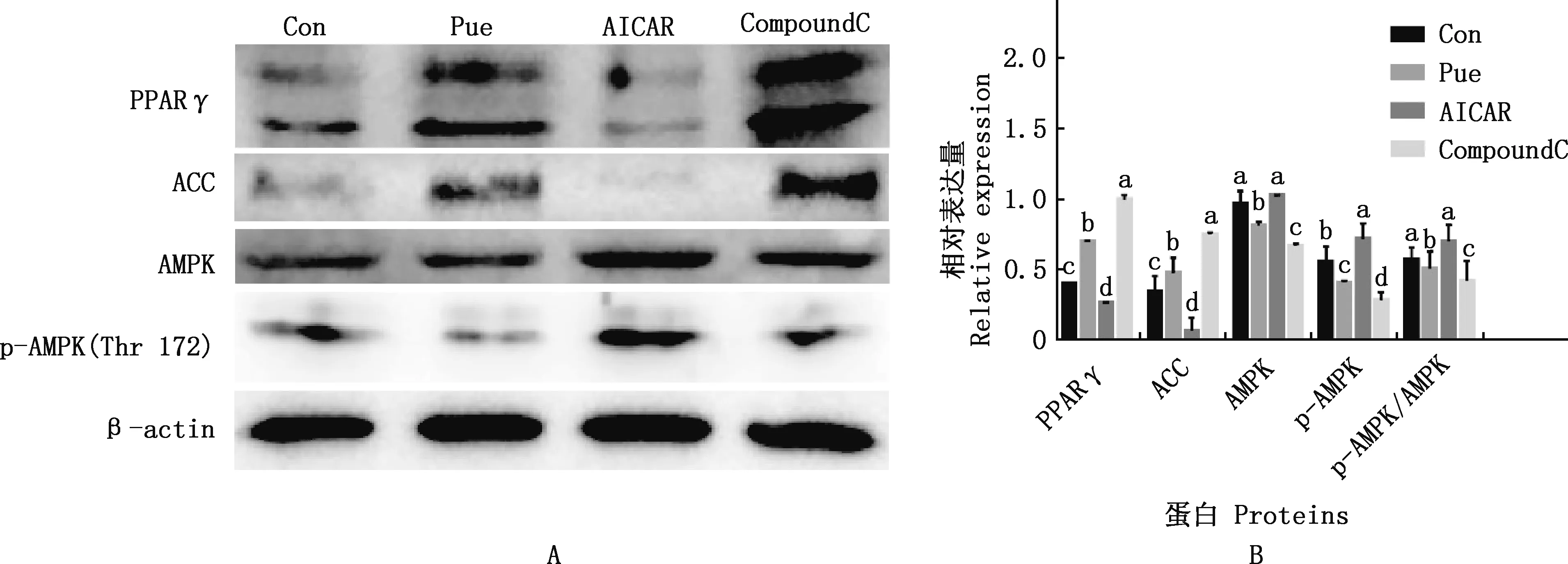
A,Western blotting检测成脂分化相关蛋白的表达;B,成脂分化相关蛋白灰度分析A,The expression of adipogenic differentiation related proteins was detected by Western blotting;B,Grayscale analysis of adipogenic differentiation related proteins图4 不同处理组成脂分化相关蛋白的表达Fig.4 Expression of lipid differentiation related proteins in different treatments

A,葛根素与AMPKα结合3D模型;B,葛根素与AMPKα结合二维模型A,3D model of puerarin and AMPKα binding;B,Two-dimensional model of puerarin and AMPKα binding图5 葛根素与AMPKα亚基对接预测结果Fig.5 Prediction results of puerarin and AMPKα subunit docking
3 讨 论
研究发现,葛根素可抑制氧化应激并改善肝线粒体呼吸功能,增加ATP的产生[14],而此时AMP/ATP比值降低,AMPK蛋白活性降低[15],即葛根素可通过调节ATP含量间接降低AMPK蛋白活性。在3T3-L细胞培养中添加葛根素发现,葛根素可通过PI3-AMPK通路降低3T3-L细胞中葡萄糖浓度,表明葛根素能增加3T3-L脂肪细胞胰岛素抵抗模型对葡萄糖的利用从而提升脂质沉积水平[16]。在本试验中,与对照组相比,葛根素组AMPK蛋白表达量显著下调,成脂标志基因PPARγ与C/EBPα相对表达量显著上调,甘油三酯浓度显著提升,而葛根素激活剂AICAR组较葛根素组效果显著减弱,此结果与杨维波等[16]的结果一致。但同时本试验发现AMPK蛋白下游基因ACC表达量显著上升,PGC-1α基因表达量显著下降,表明葛根素或可通过不同AMPK通路对脂肪细胞脂质沉积进行调节,后续将针对AMPK蛋白对ACC、PGC-1α的影响展开试验。
ACC主要通过可逆性磷酸化的共价修饰方式调控脂肪代谢[17]。研究发现,ACC的表达受AMPK蛋白的调控,共同形成AMPK-ACC调节通路[18]。研究表明,葛根素可通过AMPK-ACC信号通路降低2型糖尿病小鼠胰岛素抵抗指数(HOMA-IR),表明葛根素可改善2型糖尿病小鼠胰岛素抵抗进而提升其脂质沉积水平[19]。本试验结果显示,葛根素可通过上调ACC基因及蛋白的表达量促进松辽黑猪前体脂肪细胞脂质沉积。但小型动物无法有效反映大型家畜的真实情况,葛根素作为饲料添加剂对大型家畜有何效果仍需进一步研究。PGC-1α表达水平的改变与肥胖、糖尿病、脂代谢紊乱等代谢疾病密切相关[20],且PGC-1α可通过增加线粒体内解偶联蛋白(UCP)的表达量,从而实现白色脂肪褐色化改变[21]。最近研究发现,在2型糖尿病小鼠模型中,葛根素能通过去乙酰化酶-过氧化物酶体增殖物激活受体γ辅激活因子-1α(SIRT-PGC-1α)通路下调小鼠血糖浓度[22],而AMPK同样可作为PGC-1α上游因子调节PGC-1α的表达量[23-24]。 本试验通过对PGC-1α基因定量分析发现,葛根素能够显著下调其表达量,与徐小惠等[22]研究的结果一致,但葛根素激活剂AICAR组PGC-1α表达量与葛根素组差异不显著,葛根素是否能通过AMPK对PGC-1α进行调控仍需进一步探究。分子对接试验则显示葛根素与AMPKα之间可形成5个氢键,5个Pi-阳离子键及1个Pi-阴离子键,多种力的作用使二者的结合趋于稳定状态。目前已知葛根素可通过调节AMP/ATP比值间接调节AMPK磷酸化[16-17],葛根素是否可直接作用于AMPKα亚基从而抑制Thr-172位点磷酸化仍需进一步研究。
综上,葛根素可通过AMPK通路促进松辽黑猪前体脂肪细胞的成脂分化,该结果可为在饲粮中添加葛根素以改善猪肉肉质提供理论基础,同时,也为进一步研究松辽黑猪脂肪的代谢调节方式提供参考。
4 结 论
松辽黑猪前体脂肪细胞诱导分化时,添加40 μmol/L葛根素能够显著增加脂肪细胞中甘油三酯含量,显著上调成脂分化相关基因mRNA和蛋白的表达量,显著下调AMPK各亚基mRNA和蛋白的表达量。 在添加AMPK激活剂AIRCR(500 μmol/L)后,40 μmol/L葛根素对AMPK的影响效果被显著抑制。说明葛根素可通过抑制AMPK Thr172磷酸化位点的磷酸化改善松辽黑猪前体脂肪细胞脂质沉积与细胞分化能力。

