过瘤胃葡萄糖和缓释尿素对热应激绵羊生产性能及瘤胃发酵功能的影响
严啊妮,沈 奔,王洪荣,冯春燕,魏宗友
(1.扬州大学动物科学与技术学院,扬州 225009;2.上海美农生物科技股份有限公司,嘉定 201800;3.江苏省苏州市太仓肉羊推广示范基地,太仓 215400)
绵羊是恒温动物,在极端环境条件下都能保持接近恒定的体温[1]。在中国南方地区,夏季热应激对绵羊的影响普遍存在。热应激会引起绵羊发生一系列的生物学功能的改变,包括心率、直肠温度(RT)、呼吸频率(RR)的增加,采食效率和饲料利用率下降,水、蛋白质、能量和矿物质代谢紊乱,酶反应和激素分泌发生变化[2-3],还会导致体重、生长速度、平均日增重和体总固体含量下降[4]。绵羊在高温环境条件下,行为会发生改变,比如主动寻找阴凉地、唾液量分泌增加、饮水量增加、大口喘气、精神萎靡等[5]。在养羊生产中,怎样有效地缓解热应激对绵羊的不利影响是生产中急需解决的问题。
前人研究表明,在热应激状态下,动物需要消耗更多生理有效能和蛋白质来自我调节热应激的影响,有研究发现热应激会引起反刍动物机体出现能量负平衡,血清中葡萄糖含量减少[6]。而过瘤胃葡萄糖作为外源性葡萄糖,是一种快发酵能,可避免瘤胃发酵,顺利到达小肠,直接作为能量供应者为机体快速补充能量,提高了能量利用率,有效缓解能量负平衡[7]。蛋白质饲料短缺已成为全球性的问题,且中国豆粕价格居高不下,养殖成本增加,因此,寻找一种蛋白质饲料来代替豆粕是目前急需解决的问题[8]。尿素是一种瘤胃可降解蛋白质(RDP)的重要来源,具有较高的蛋白质当量[9]。在反刍动物饲粮中,尿素作为蛋白质的替代品具有较高的瘤胃降解率和较低的成本[10]。利用缓释技术,一方面将尿素的释放速率与瘤胃内碳水化合物的降解速率同步,可以最大限度地提高微生物蛋白的合成效率;另一方面可为机体提供足够的能量,提高动物的生产性能,维持瘤胃内环境的稳定[11]。缓释尿素和过瘤胃葡萄糖对泌乳奶牛和围产期奶牛具有积极影响,而有关缓释尿素和过瘤胃葡萄糖应用于热应激绵羊的研究却鲜有报道。本试验旨在探究饲粮中添加缓释尿素和过瘤胃葡萄糖对热应激绵羊生产性能和瘤胃发酵参数的影响,为生产实际中缓释尿素和过瘤胃葡萄糖的科学合理应用提供理论依据。
1 材料与方法
1.1 试验时间与地点
试验于2020年7-9月在江苏省苏州市太仓肉羊推广示范基地进行。
1.2 试验材料
缓释尿素和过瘤胃葡萄糖均由上海美农生物科技股份有限公司生产,其中缓释尿素:含氮量≥38%,蛋白当量≥238%。过瘤胃葡萄糖:葡萄糖含量≥50%,过瘤胃率≥80%,小肠释放率≥90%。
1.3 试验动物与分组
试验选取40只健康、体重相近的3月龄湖羊公羔,按初始体重随机分成4个处理组(n=10),依次为对照(CON)组(饲喂基础饲粮)、缓释尿素(SRU)组(基础饲粮中添加缓释尿素15 g/d)、过瘤胃葡萄糖(RPG)组(基础饲粮中添加过瘤胃葡萄糖10 g/d)和联合添加(UG)组(基础饲粮中添加缓释尿素15 g/d+过瘤胃葡萄糖10 g/d)。预饲期15 d,正饲期50 d。
1.4 试验饲粮及饲养管理
饲粮配方及营养水平见表1。试验前对羊舍及周围环境进行清理和消毒,对所有试验羔羊打耳标,并进行驱虫和防疫,使每只羔羊达到试验所需的健康标准。试验羊统一单栏饲养,每个单栏均配有水槽,确保有足够的饮水。每天7:00和16:30各饲喂1次,早上喂料前,清理并收集食槽中的剩料进行称重,记录试验羊的剩料量和饲喂量。

表1 基础饲粮组成及营养水平(干物质基础)
1.5 样品采集与指标测定
1.5.1 温湿度指数的测定 试验期间羊舍的四角在距离地面约1.5 m处各放置干湿球温湿度计(河北衡水武强佳益仪器有限公司)1个,试验期间每天8:00、14:00和20:00分别记录羊舍内干球温度和湿球温度,并计算温湿度指数(THI),计算公式为:THI=0.72(Td+Tw)+40.6。式中,Td为干球温度(℃);Tw为湿球温度(℃)。根据THI数值的大小,热应激可分为轻度(72
1.5.2 呼吸频率和直肠温度的测定 试验期间,每周连续2 d记录湖羊的呼吸频率,并于当天8:00、14:00和20:00测定呼吸频率,根据湖羊腹部和胸廓1 min的起伏次数,计算湖羊的呼吸频率,每只羊重复计数2次。试验期间,每周的最后1天14:00测定湖羊的直肠温度,用兽用体温计(成都铸盛医疗器械有限公司)用75%消毒酒精消毒后,插入试验羊肛门测定,5 min后取出,进行读数和记录。
1.5.3 生产性能指标的测定 正饲期的第1天清晨饲喂前对试验羊称重,为试验羊的初始体重;正饲第50天晨饲前称重,为试验羊的最终体重。正饲期开始后,每天饲喂前清理食槽内的剩料,称重后记录饲喂量和剩料量。平均日增重(ADG)=试验期间体重增加量(kg)/试验期间天数(d);平均日采食量(ADFI)=总采食量(kg)/试验总天数(d);料重比(F/G)=平均日采食量(kg)/平均日增重(kg/d)。
1.5.4 血清免疫指标的测定 正饲期的最后1天,每组随机抽取6只试验羊,于晨饲前用促凝真空采血管进行空腹颈静脉采血各5 mL,促凝真空采血管在室温下静置30 min后,3 000 r/min、4 ℃低温离心机离心10 min制备血清样品,分装于2 mL无酶离心管中,于-80 ℃冷冻保存用于后续血清指标的检测。血清免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)均采用酶联免疫吸附试验(ELISA)法测定,试剂盒均购于南京建成生物工程研究所,严格按照说明书要求进行测定。
1.5.5 瘤胃发酵参数的测定 正饲期的最后1天晨饲前,每组随机抽取6只试验羔羊,用口腔采样器采集瘤胃液,经4层纱布过滤后,装入50 mL的离心管。剩余瘤胃液快速分装至2 mL离心管和10 mL的离心管中,于-20 ℃冷冻保存,用于瘤胃发酵参数的测定。其中,pH采用便携式pH测定仪测定;氨态氮(NH3-N)采用苯酚-次氯酸钠比色法测定;微生物蛋白(MCP)采用嘌呤法测定;挥发性脂肪酸(VFA)采用气象色谱仪(GC-14B,shimadzu)测定。
1.6 数据统计与分析
试验原始数据采用Excel进行初步整理,采用SPSS 19.0软件进行单因素方差分析,并采用Duncan法进行多重比较;选择有重复测量值的一般线性模型进行两因素方差分析,并通过Tukey’s检验进行多重比较。P<0.05表示差异显著。
2 结 果
2.1 试验期间羊舍内THI的变化
图1为试验期间羊舍内1天中3个时间点的温度变化情况,最低温度为26 ℃,最高温度为38 ℃,14:00是一天中温度最高点。由图2可知,试验期间羊舍内THI范围在77.39~89.85之间,羊舍内早、中、晚的平均THI>72,THI最低值为77.39,最高值为89.85,说明湖羊在试验期间一直处于热应激状态,且大部分时间处于中度热应激环境范围内。
2.2 缓释尿素和过瘤胃葡萄糖对热应激绵羊直肠温度和呼吸频率的影响
由表2可知,与CON组相比,UG组热应激绵羊的直肠温度显著降低(P<0.05),SRU组、RPG组、UG组热应激绵羊的呼吸频率均显著降低(P<0.05)。

图1 试验期间羊舍内温度变化曲线Fig.1 Temperature change curve in sheep shed during the experiment
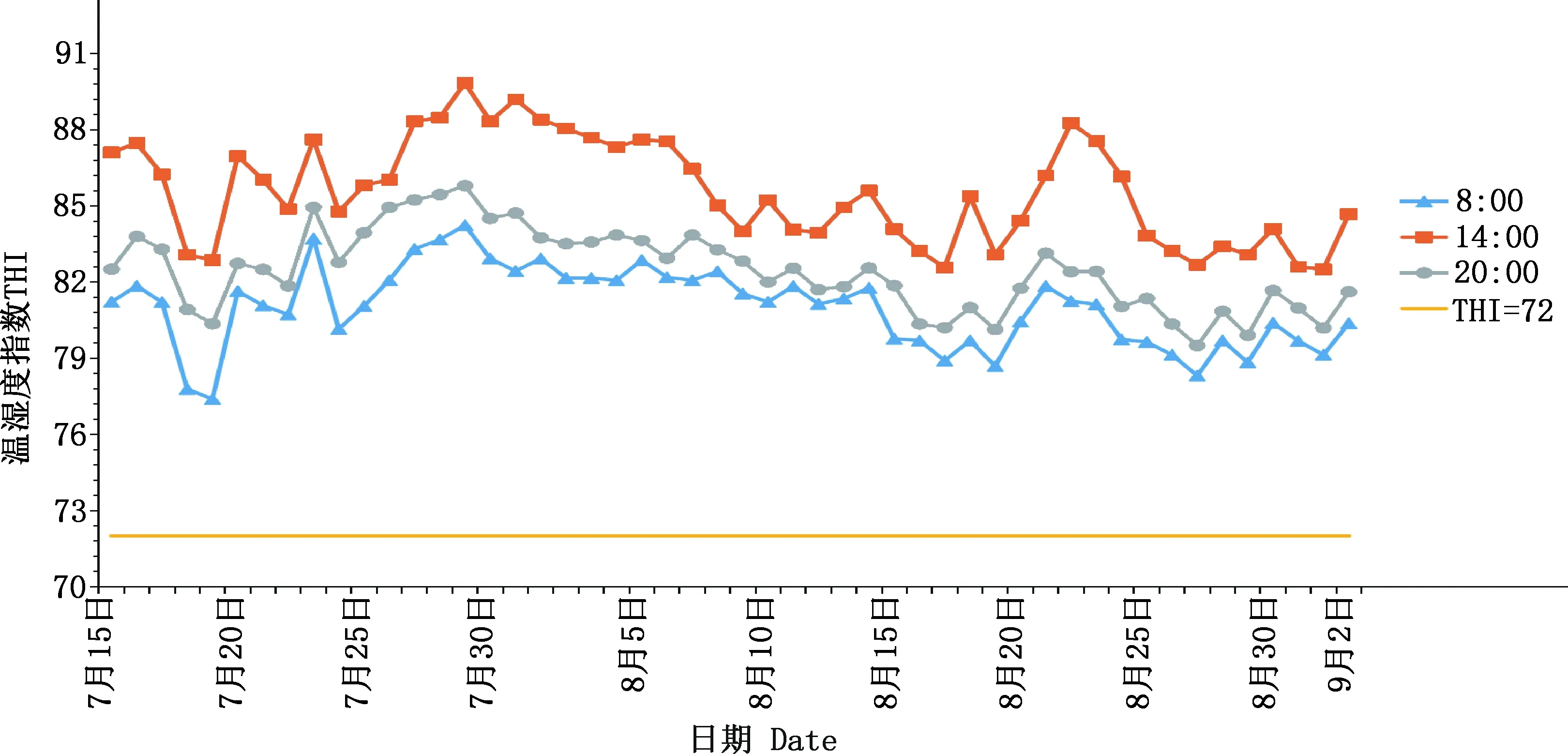
图2 羊舍温湿度指数变化曲线Fig.2 Temperature and humidity index curve of sheep shed
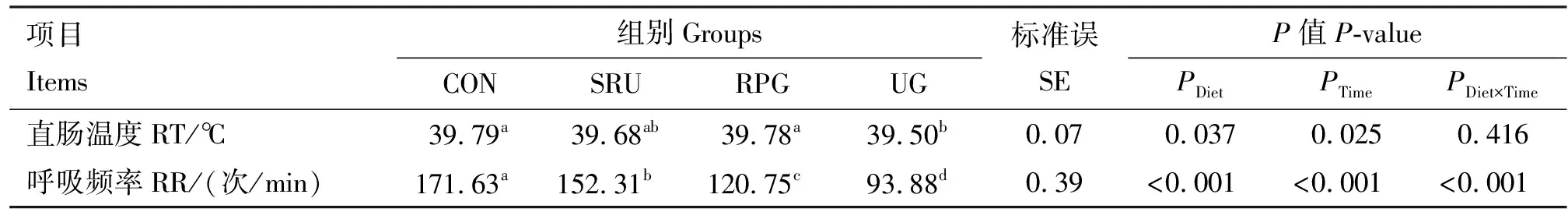
表2 各组热应激绵羊直肠温度和呼吸频率测定结果
2.3 缓释尿素和过瘤胃葡萄糖对热应激绵羊生产性能的影响
由表3可知,与CON组相比,饲粮中添加缓释尿素、过瘤胃葡萄糖显著提高了热应激绵羊的终末体重和平均日增重(P<0.05),显著降低了料重比(P<0.05)。
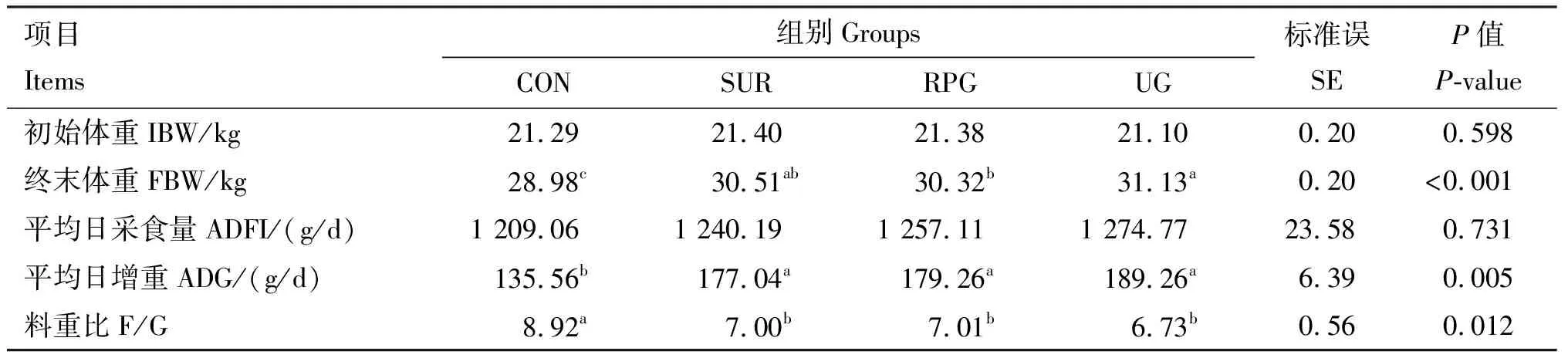
表3 各组热应激绵羊生产性能测定结果
2.4 缓释尿素和过瘤胃葡萄糖对热应激绵羊免疫指标的影响
由表4可知,与CON组相比,RPG和UG组热应激绵羊血清中IgG和IgM含量均显著提高(P<0.05),各处理组热应激绵羊血清中IgA含量均无显著差异(P>0.05)。与CON组相比,RPG和UG组热应激绵羊血清中TNF-α和IL-2的含量均显著降低 (P<0.05)。
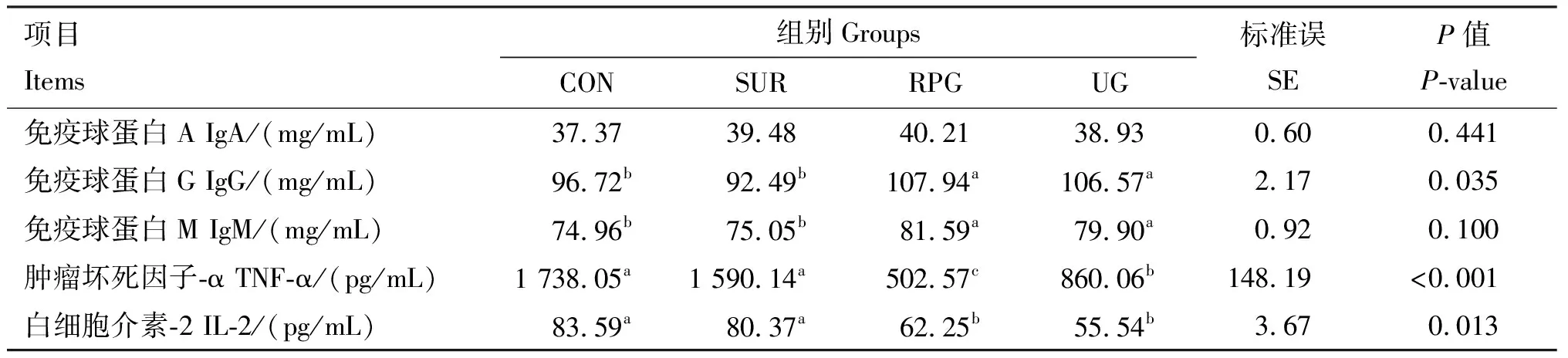
表4 各组热应激绵羊血清免疫指标测定结果
2.5 缓释尿素和过瘤胃葡萄糖对热应激绵羊瘤胃发酵指标的影响
如表5所示,与CON组相比,RPG组热应激绵羊瘤胃液pH显著提高(P<0.05),SRU组和UG组的瘤胃pH均无显著差异(P>0.05);与CON组相比,RPG组和UG组瘤胃内氨态氮的浓度显著降低 (P<0.05),各处理组瘤胃内乙酸与丙酸的比值均显著提高(P<0.05);与CON组相比,SRU组瘤胃内乙酸、异丁酸、异戊酸和总挥发性脂肪酸的比例均显著提高(P<0.05),RPG组瘤胃内异戊酸比例显著提高(P<0.05),丙酸、丁酸的比例显著降低(P<0.05),UG组瘤胃内乙酸、总挥发性脂肪酸及微生物蛋白的含量均显著提高(P<0.05)。
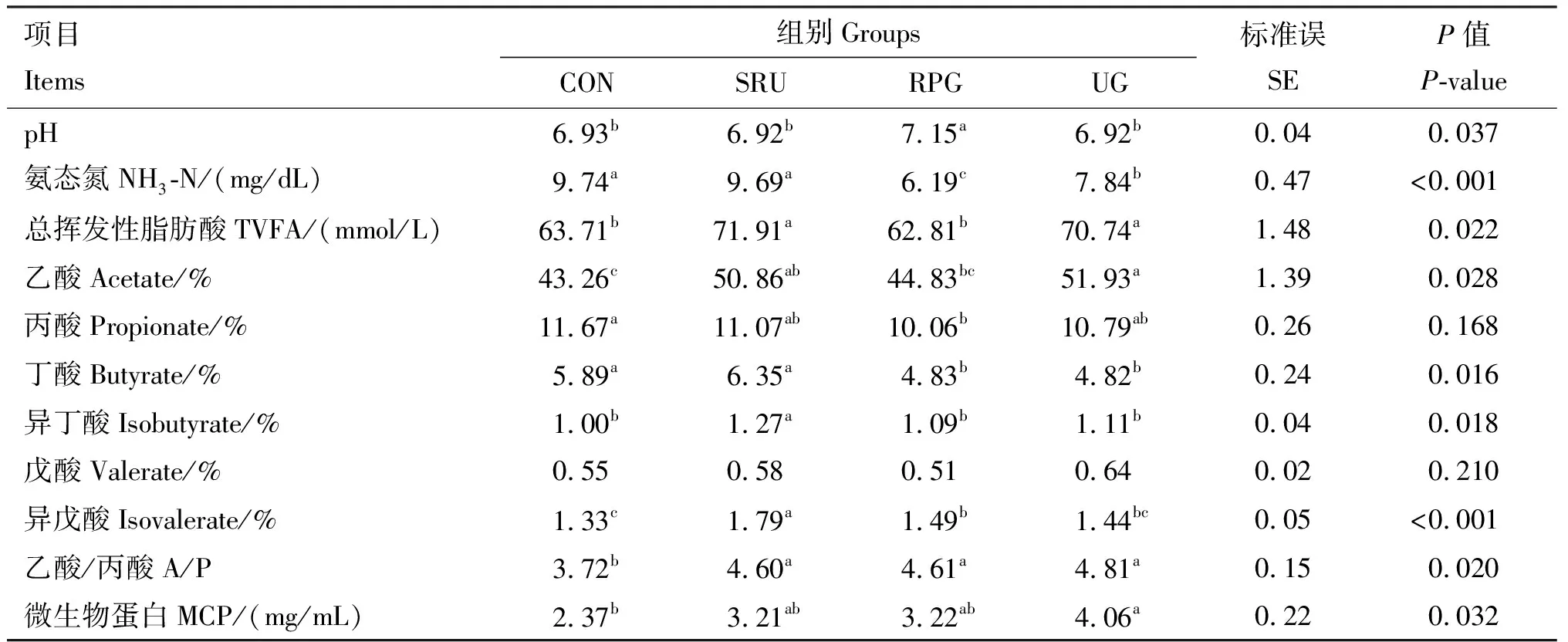
表5 各组热应激绵羊瘤胃发酵参数测定结果
3 讨 论
3.1 缓释尿素和过瘤胃葡萄糖对热应激绵羊直肠温度和呼吸频率的影响
直肠温度和呼吸频率是评价动物热应激最常见的敏感指标,反映动物受到热应激的程度以及对环境改变所作出的直观变化。绵羊的等温区均为5~25 ℃之间[13],绵羊可以通过物理调节和行为改变来维持自身产热和散热平衡。当环境温度升高到36 ℃时,动物自身的生理机制不能抵消过多的热负荷,直肠温度就会升高[2]。绵羊可以通过提高呼吸频率来增大肺部通气量,消散总热负荷的60%~90%[14]。Silvanikove等[15]根据呼吸频率对热应激的严重程度进行了分类,在绵羊中,40~60次/min为轻度热应激,60~80次/min为中度应激,80~120次/min为重度热应激,≥150次/min为极度热应激。本试验中绵羊处于重度热应激和极度热应激,饲粮中添加缓释尿素、过瘤胃葡萄糖均能显著降低热应激绵羊的直肠温度和呼吸频率。宋良荣等[16]研究表明通过调节饲粮中代谢葡萄糖水平可以降低热应激对荷斯坦奶牛生理指标的影响,缓解奶牛的直肠温度和呼吸频率出现的异常。过瘤胃葡萄糖的添加,提高了饲粮中代谢葡萄糖水平,从而降低了热应激绵羊的直肠温度和呼吸频率。据报道,绵羊主要通过呼吸和出汗分别从呼吸道和皮肤表面蒸发散热[2],缓释尿素可能引起皮肤血管舒张,通过血液循环将机体产生的热量运送到体表,进行蒸发散热,从而起到缓解绵羊热应激的作用,但其影响机制还有待进一步研究。综上,缓释尿素和过瘤胃葡萄糖可以通过降低直肠温度和呼吸频率有效地缓解热应激对绵羊造成的负面影响。
3.2 缓释尿素和过瘤胃葡萄糖对热应激绵羊生产性能的影响
长期暴露在高温环境下,会导致绵羊体重、平均日增重、生长速率、饲料利用率、繁殖率和体总固形物含量降低[17]。热应激可通过改变瘤胃的组织形态、瘤胃内的温度、pH及渗透压等降低瘤胃微生物的降解和繁殖能力,不利于养分的消化吸收,从而降低动物的生产性能和饲料转化率[18]。大量研究表明,饲粮中添加缓释尿素能显著提高反刍动物的生产性能。Sweeny等[19]发现饲粮中添加尿素可提高绵羊干物质采食量和生长性能。Khattab等[20]试验表明,当饲粮中添加的缓释尿素从0 g/kg增加到15 g/kg时,可提高绵羊对干物质、有机物和粗蛋白质的消化率,显著提高瘤胃微生物生长和瘤胃发酵功能。Ahmed等[21]试验发现,在玉米青贮饲粮中添加缓释尿素可显著提高绵羊的平均体重和羊毛品质。Zhang等[22]发现饲粮中添加缓释尿素可提高荷斯坦奶牛的平均日增重。本试验中,饲粮添加缓释尿素能显著提高热应激绵羊的平均日增重,降低料重比,这一结果与之前的研究报道相符。缓释尿素能同步瘤胃内氮和碳水化合物的利用,满足氨基酸的需要,促进瘤胃微生物对氨的吸收,提高微生物蛋白的合成。同时缓释尿素也为淀粉分解菌和纤维分解菌提供了所需的氮源,提高了瘤胃微生物分解和利用饲料养分的能力,实现瘤胃内微生态平衡,从而提高动物的生产性能[23]。
有报道称热应激降低了绵羊、荷斯坦奶牛体内的循环葡萄糖水平[24],葡萄糖具有重要的营养生理功能,当体内缺乏足够的葡萄糖时,会引起动物生产性能下降。反刍动物几乎完全依赖肝脏的糖异生来满足机体其他组织的葡萄糖需要,过瘤胃葡萄糖是良好的外源性葡萄糖,可以避免在瘤胃中被破坏,进入肠道后再完全释放出来,因此有更多的葡萄糖被运输到小肠,被小肠上皮细胞吸收,提高能量利用率[25]。李妍等[26]试验表明,过瘤胃葡萄糖能提高荷斯坦奶牛产奶量和血清中葡萄糖浓度。Li等[27]研究发现,向肉牛皱胃中注入葡萄糖能显著降低产热与代谢能的比值,提高能量沉积效率,促进体脂和蛋白质的沉积。代谢葡萄糖水平的增加还可以显著提高动物体内氮沉积及可消化氮转化为沉积氮的效率,提高蛋白质在胴体和肌肉中沉积比例[28]。本试验中添加过瘤胃葡萄糖显著提高了热应激绵羊的终末体重和平均日增重,可能是过瘤胃葡萄糖减少了内源葡萄糖的合成,节约了能量和生糖氨基酸,促进了脂质和蛋白质代谢,从而改善了动物的生产性能。综上,饲粮中添加缓释尿素和过瘤胃葡萄糖能显著提高热应激绵羊的生产性能,其中缓释尿素和过瘤胃葡萄糖联合添加对提高热应激绵羊的终末体重和平均日增重、降低料重比的效果最好。
3.3 缓释尿素和过瘤胃葡萄糖对热应激绵羊免疫功能的影响
热应激会降低动物机体的免疫力,引发炎症反应。Bernabuccid等[29]发现热应激会诱导反刍动物体内调节因子发生变化,改变了动物机体能量、脂质和蛋白质代谢,损害肝功能,免疫机能显著下降,增加感染和疾病发生的风险,严重时可导致动物死亡。同时有研究表明,绵羊在热应激条件下,体内骨骼肌中TNF-α和核因子-κB的表达量上调,机体内的炎症反应也随之发生[30]。淋巴细胞需要通过摄取葡萄糖来维持自身生存和正常功能,活化后的免疫细胞显著增加代谢需求,葡萄糖代谢会发生数量级变化,以满足生长、增殖和发挥效应所需的能量和生物合成需要。如果葡萄糖摄取受到限制,不能再维持免疫细胞生存,促凋亡B淋巴细胞瘤-2(Bcl-2)的家族成员会被激活,促进细胞的凋亡,不能产生所需的免疫效应[31]。Kvidera等[32]试验也表明,免疫细胞被激活后,会显著破坏葡萄糖的体内平衡,消耗的葡萄糖显著增加,表现为低血糖症。Zhang等[33]研究表明过瘤胃葡萄糖可参与回肠上皮代谢,调节与免疫稳态相关的基因。本试验中,添加过瘤胃葡萄糖显著提高了热应激绵羊血清中IgG和IgM含量,说明过瘤胃葡萄糖能为免疫细胞提供能量物质,促进体内葡萄糖代谢的稳定,从而提高热应激绵羊的免疫功能。Li等[27]试验发现,饲粮中添加过瘤胃葡萄糖使泌乳奶牛的产奶量提高了12%,血浆中白细胞介素-8(IL-8)和TNF-α的浓度显著降低,表明过瘤胃葡萄糖可以提高奶牛产奶量,减少机体的炎症反应。本试验中,添加过瘤胃葡萄糖显著降低了热应激绵羊血清中TNF-α和IL-2的水平,这与前人的研究报道相符。本试验中添加缓释尿素对热应激绵羊血清中的免疫指标均无显著影响,这与张娇娇[34]的研究结果一致,该研究表明在饲粮中添加不同比例的缓释尿素对同一品种肉牛血清中免疫球蛋白含量均无显著影响,但不同品种肉牛之间的血清免疫水平表现出差异,缓释尿素的添加效果可能与动物的种类和环境温度有关。
3.4 缓释尿素和过瘤胃葡萄糖对热应激绵羊瘤胃发酵参数的影响
瘤胃内环境的稳态是保证营养物质正常消化吸收的必要条件。正常情况下,瘤胃内含有大量的细菌、厌氧真菌、纤毛虫和原虫等微生物[35]。有报道称,热应激会导致绵羊瘤胃内pH、瘤胃内渗透压、纤维素分解菌及淀粉分解菌数量显著降低[36]。钟书[37]研究发现,热应激会使山羊瘤胃内微生物的种类和多样性发生显著改变,瘤胃内致病菌增加而益生菌减少。热应激会显著改变动物的采食方式,使其对粗饲料的采食量减少,而对精料的摄入量增加。摄入大量精料会导致瘤胃内有机酸产生增加,有可能引起动物发生亚急性瘤胃酸中毒[38]。
瘤胃内的微生物可以将饲粮中所含有的蛋白质降解成微生物所需的NH3,NH3不仅为微生物蛋白的合成提供氮源,在纤维素分解菌和淀粉分解菌中也具有重要的作用[39]。Goulart等[40]研究表明,反刍动物能利用非蛋白氮化合物(如缓释尿素)加快瘤胃内的微生物对氮源的摄取和利用,提高瘤胃微生物合成蛋白质的能力。Broderick等[41]报道称,在饲喂高水平可快速发酵碳水化合物的反刍动物饲粮中添加缓释尿素可提高微生物蛋白的合成能力。试验中单独添加缓释尿素提高了瘤胃内微生物蛋白的浓度,但差异不显著,而联合添加缓释尿素和过瘤胃葡萄糖显著提高了微生物蛋白的浓度,可能是缓释尿素和过瘤胃葡萄糖在瘤胃内实现了能量和氮利用的同步性,从而使微生物蛋白的合成效率显著提高。Yan等[42]向牦牛基础饲粮中分别添加10和20 g/kg的缓释尿素,结果发现添加10 g/kg缓释尿素组牦牛瘤胃细菌和真菌多样性、生物多样性均显著升高。可见缓释尿素能促进瘤胃微生物的生长和繁殖,提高氮源的利用率和代谢蛋白含量。本试验中添加缓释尿素提高了瘤胃内乙酸、异丁酸的比例,降低了丙酸的比例,这与Yang等[43]研究结果一致。尿素在瘤胃内缓慢水解释放NH3,刺激瘤胃上皮对丙酸的吸收,同时缓释尿素为纤维素分解菌提供氮源,促进纤维素降解产生乙酸,提高了乙丙比,从而改善瘤胃发酵。
葡萄糖是所有哺乳动物细胞能量代谢和合成途径的基本物质,葡萄糖及其糖酵解代谢是胚胎生长、乳汁合成的重要燃料来源[44]。李影等[45]研究表明,过瘤胃葡萄糖能通过瘤胃顺利进入到小肠内,通过小肠上皮细胞被吸收,避免了瘤胃发酵的不平衡性。Wang等[46]试验发现,过瘤胃葡萄糖可显著影响瘤胃发酵指标和瘤胃内有机酸代谢,提高瘤胃微生物的活性和瘤胃上皮功能,显著增加有益菌的丰度,从而促进瘤胃系统的发育、微生物的生长和能量代谢。毛螺旋菌科和瘤胃球菌科能够降解纤维素和半纤维素,将其转化成短链脂肪酸[47]。王亚品等[48]在早期泌乳奶牛饲粮中添加350 g/d的过瘤胃葡萄糖后发现瘤胃内乙酸、丙酸、丁酸及总挥发性脂肪酸的浓度显著提高,而本试验中添加过瘤胃葡萄糖后,乙酸的比例升高,丙酸、丁酸及总挥发性脂肪酸的比例降低,产生这一现象的原因可能与绵羊所处的热应激状态以及过瘤胃葡萄糖的添加量有关。热应激会导致绵羊瘤胃内的有益菌减少、致病菌增加,推测毛螺旋菌科和瘤胃球菌科的丰度和数量减少,从而导致瘤胃内短链脂肪酸水平的降低。添加不同剂量的过瘤胃葡萄糖对动物的影响也是不同的,本试验中过瘤胃葡萄糖的添加剂量可能过低,对调节瘤胃内短链脂肪酸的效果并不显著。
4 结 论
本试验条件下,饲粮中添加缓释尿素和过瘤胃葡萄糖可降低热应激绵羊的呼吸频率和直肠温度,有效缓解绵羊的热应激,并可显著提高热应激绵羊的生产性能,同时改善瘤胃内环境。

