蟾蜍似矛球吻棘头虫的临床病例研究
黄潇航,李诗艺,李永霞,李梦蕊,贺金峪,张 龙,刘道泉,江和基,黄志坚,殷光文
(1.福建农林大学动物科学学院(蜂学学院),福州 350002;2.福建省动物药物工程实验室,福州 350002;3.福建省农业科学院畜牧兽医研究所,福州 350013;4.福州市动物疫病预防控制中心,福州 350009)
中华蟾蜍属两栖纲蟾蜍科动物,在中国广泛分布。蟾皮、蟾酥、干蟾、蟾蜍头、蟾蜍胆、蟾蜍肝等名贵中药材均产自蟾蜍,在临床应用效果较好[1]。其中,耳后腺分泌物——蟾酥在临床中具有抗菌、消炎等功效。蟾蜍相关成分如蟾酥、蟾蜕等均具有较高的药用价值,目前国内生产的中成药中,“蟾酥注射液”、“复方蟾皮胶囊”等含有蟾蜍成分的中成药已经超过了100种[2]。
棘头虫是一类常见的蠕虫,其吻部具有倒钩小刺状结构,虫体较大,肉眼可见,生活史复杂,多见其寄生于动物肠道内,偶见其他脏器的移行性寄生,在猪和水禽中感染较常见,大量寄生易造成动物宿主的肠黏膜等组织器官机械性损伤,继发炎症。两栖动物棘头虫感染种类较为丰富,夏伟丽等[3]整理的蛙类棘头虫感染名录中指出国内在蛙体内检出棘头虫8种,隶属于1门、2纲、2目、2科、3属。此外,关于两栖动物棘头虫的感染报道及蛙棘头虫等感染情况,多数研究以形态学鉴定研究为主,分子生物学方面的研究报道相对较少。形态学鉴定对鉴定者具有较高的专业素质要求,且对于幼虫等生活史阶段鉴别难度较大。
近年来兴起的分子生物学成为了物种鉴定的一种较好的选择,线粒体细胞色素c氧化酶亚基Ⅰ(cytochrome c oxidase subunit Ⅰ,COⅠ)对物种演化研究具有重要参考价值,该基因片段具有变异频率高、种间差异性显著等特点,目前在国内线虫[4]和绦虫[5]等蠕虫、甚至节肢动物[6-7]的种类鉴定上已有了较成熟的应用。本研究解剖死亡蟾蜍,在体腔脏器上发现了大量棘头虫感染现象,采用形态学观察和分子生物学鉴定综合分析,以期为两栖类棘头虫等寄生虫的分类、鉴定和遗传变异研究提供参考。
1 材料与方法
1.1 主要试剂及仪器
10%中性福尔马林溶液(4%甲醛)购自泉州泓克生物科技有限公司;灭菌生理盐水、手术器械、苏木素-伊红(HE)染色试剂盒均购自北京索莱宝生物公司;DNA提取试剂盒(FastDNA SPIN Kit)购自MP Biomedicals公司;EasyTaqMix聚合酶购自北京全式金生物技术股份有限公司;胶回收试剂盒购自天根生化科技(北京)有限公司。正置白光拍照显微镜Eclipse Ci-L(Nikon(Japan))、扫描浏览软件CaseViewer2.4(3DHISTECH(Hungary))、全景切片扫描仪PANNORAMIC DESK/MIDI/250/1000(3DHISTECH(Hungary));SZ680连续变倍体视显微镜和SMAR显微镜均购自重庆奥特光学仪器责任有限公司。
1.2 动物检查
实验室饲养的一只体重153 g的雌性药用中华蟾蜍,形态消瘦,疑似患有寄生虫病,拒食后发生死亡,对死亡的蟾蜍进行剖检发现,多脏器及系膜处有大量棘头虫感染寄生。对病死蟾蜍的皮下肌肉、口腔、咽、食道、胃、肺脏、小肠等依次进行剖检观察,除了采集病理组织部分外,其余均做完全剖检处理,并统计感染虫数。
1.3 病理组织学观察
对感染较严重的器官进行虫体感染计数后,采集部分组织样品浸泡于10%中性福尔马林溶液,标本固定后由福州都拜特生物公司进行病理组织学标本的制备。使用HE染色方法进行病理组织切片的制备,参照病理组织学相关分析方法对组织样品进行研究。
1.4 传统方法检测
采用蠕虫剖检法、结节压片法、饱和食盐水漂浮法、水洗沉淀法进行寄生虫检测,用SZ680连续变倍体视显微镜对感染棘头虫的病变情况进行观察,并拍摄记录。采用结节压片法检查肠道结节内的棘头虫,并使用光学显微镜进行形态学观察。临床操作及形态学鉴定参照孔繁瑶[8]方法进行。在统计计数后,保存部分脏器寄生的棘头虫用于后期的分子生物学鉴定。
1.5 分子生物学鉴定
用DNA提取试剂盒对来自心脏、肝脏、胃、肠、生殖腺的5株虫体进行DNA提取,样品编号为JS-01~JS-05,以提取的DNA为模板进行PCR反应。COⅠ基因扩增引物为LCO1490:5′-GGTCAA-CAAATCATAAAGATATTGG-3′;HCO2198:5′-TAAACTTCAGGGTGACCAAAAAATCA-3′[7],引物由福州尚亚生物公司合成制备。PCR反应体系25 μL:2×FineTaqMix 酶12.5 μL,上、下游引物各1 μL,DNA模板2 μL,ddH2O8.5 μL。PCR反应条件:95 ℃预变性3 min;98 ℃变性10 s,47 ℃退火30 s,68 ℃延伸1 min,共35个循环;68 ℃总延伸7 min。PCR产物进行1.0%琼脂糖凝胶电泳鉴定。扩增获得的阳性条带切胶回收送往福州铂尚公司进行测序。测序后获得的序列使用DNAMAN和Mega 7.0软件进行生物信息学分析,选取代表株JS-01使用DNAStar 7.0软件进行相似性比对分析。用Mega 7.0软件中Neighbor-Joining(NJ)法构建基于COⅠ基因序列的系统进化树,采用Boostrad测量重复1 000次。
2 结 果
2.1 临床剖检结果
临床剖检结果发现,棘头虫寄生于蟾蜍的肺脏、肝脏、胃、卵巢、脾脏等多个脏器,未发现线虫、绦虫、吸虫等其他临床常见的蠕虫寄生,初步判断本病例中导致蟾蜍发生虚弱死亡的致病原为棘头虫。感染数量统计结果见表1。
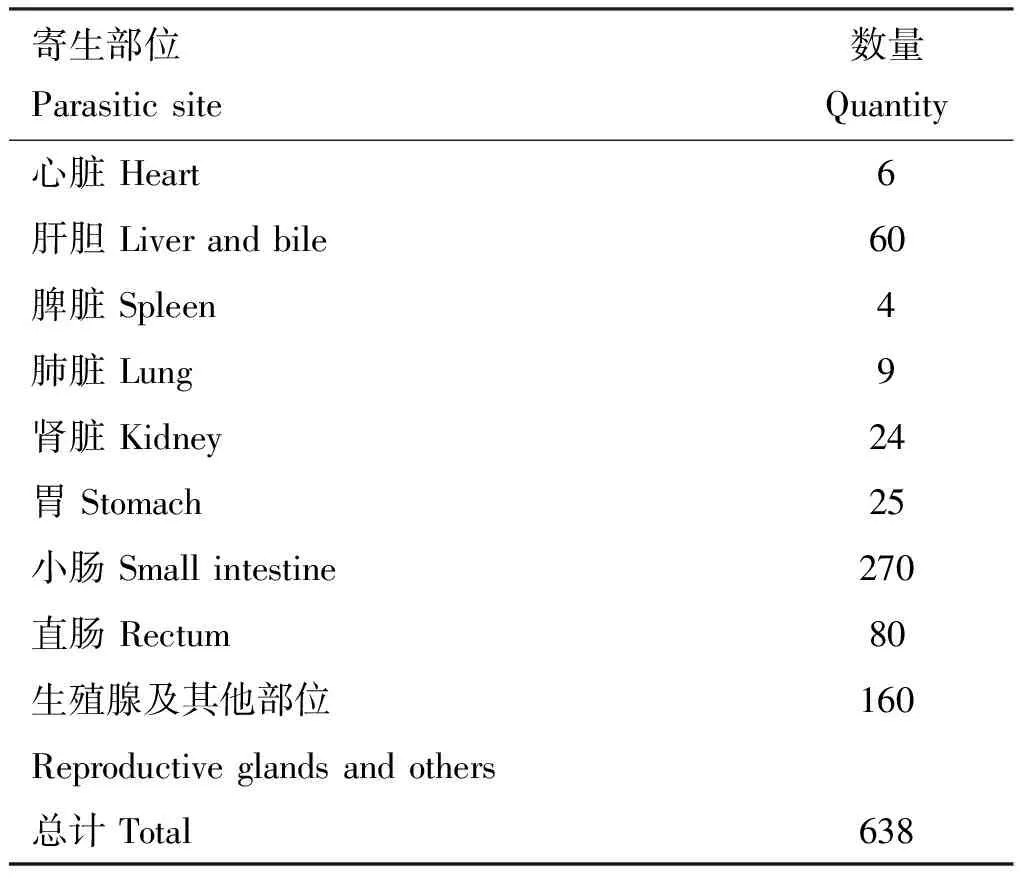
表1 棘头虫感染寄生部位及感染情况
2.2 病理组织学观察结果
采集病理组织,HE染色结果显示,在棘头虫感染寄生的部位均出现了较严重的机械损伤和炎症反应。病理组织学观察结果显示,棘头虫的感染造成了空肠黏膜机械性压迫和损伤(图1A);肺脏寄生造成了肺脏黏膜层的机械性损伤和出血(图1B);肝脏寄生造成了铁血黄素增加,充血及伴有大量的炎性反应(图1C);脾脏充血肿大,铁血黄素增加,伴有部分细胞坏死(图1D);心肌坏死,有炎性细胞浸润(图1E);胃基底层完整,但胃黏膜严重脱落,且胃壁外侧有大量虫体寄生(图1F);肠腔道内膜损伤较严重,肠绒毛完整性破坏,内部可观察到炎性细胞聚集(图1G);直肠外壁可观察到大量的虫体呈现机械性寄生,组织结构完整性大量破坏(图1H);卵巢组织内可观察到大量寄生个体,造成卵巢组织损坏严重(图1I)。
A,回肠;B,肺脏;C,肝脏;D,脾脏;E,心脏;F,胃;G,十二指肠;H,直肠;I,卵巢A,Ileum;B,Lung;C,Liver;D,Spleen;E,Heart;F,Stomach;G,Duodenum;H,Rectum;I,Ovaries图1 蟾蜍棘头虫感染病理组织学观察(100×)Fig.1 Histopathological observation on the infection of Sphaerirostris lanceoides in toad (100×)
2.3 传统方法检测结果
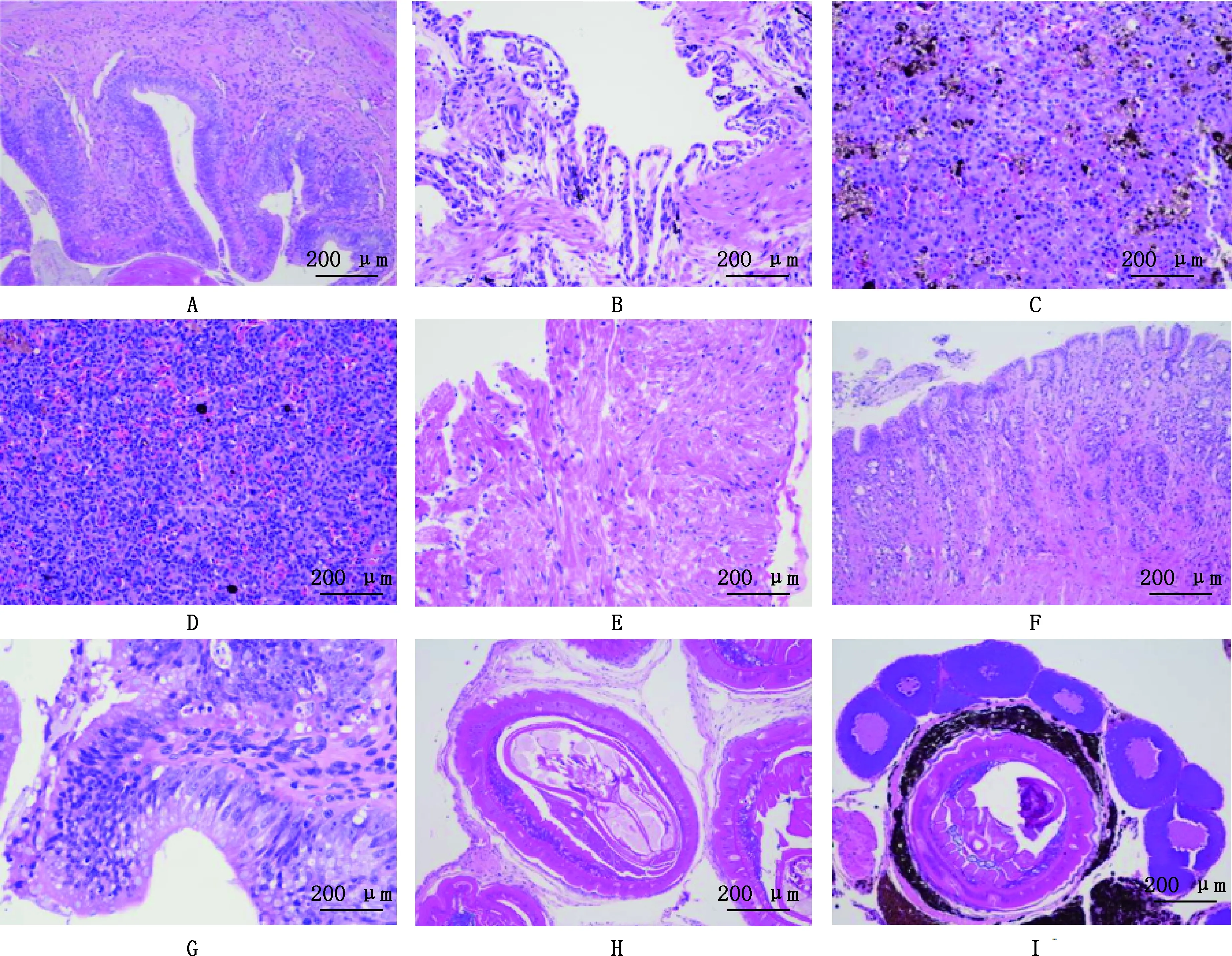
通过水洗沉淀法和饱和食盐水漂浮法对肠道内容物进行了检测,未发现虫卵。同时采集寄生组织压片进行光学形态观察,虫体具有较长的吻部,其中具有大量的钩刺结构,在虫体内未观察到虫卵,初步判断体腔内寄生的蠕虫为棘头虫(图2)。用70%酒精溶液浸泡保存部分虫体样本,统计发现棘头虫638只,其中肠、胃、膀胱、肝脏感染强度最高。形态学鉴定比对结果显示,分离的棘头虫与似矛球吻棘头虫特征相符。
2.4 分子生物学鉴定结果
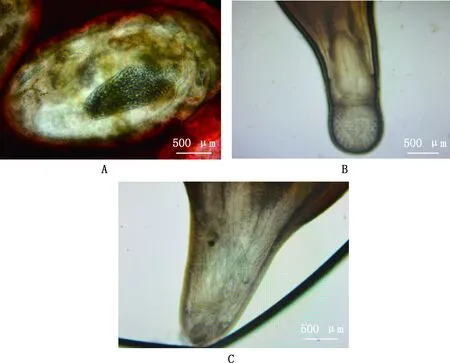
感染5个不同部位的5株棘头虫虫株COⅠ基因PCR扩增获得大小约为688 bp的目的片段(图3)。 通过拼接测序获得条带大小为690~710 bp,GC含量为40.14%~40.83%。使用DNAMAN进行相似性分析,5株目的虫株多序列比对mtCOⅠ扩增部分片段相似性在99.80%以上,这提示获得的5株棘头虫均为同一种棘头虫。通过NCBI数据库下载相关物种序列用于Mega 7.0进化树构建,选取目的株JS-01通过NCBI-BLAST数据库比对,与似矛球吻棘头虫(MG931943.1)相似性最高,为99.5%,与其他棘头虫虫种Corynosomastrumosum(LC465399.1)、Andracanthaleucocarboi(MF527023.1)mtCOI相似性分别为74.3%和73.2%。根据分子种属相似性可初步确定获得的虫株为似矛球吻棘头虫(图4)。由图5可知,JS-01~JS-05形成一独立小分支,属间树枝间数值大小>50,可信度高,测序的JS株样品序列与现有报道的似矛球吻棘头虫距离最近,在亲缘关系上接近于似矛球吻棘头虫(MG931943.1)。结合形态学观察结果,显示其为似矛球吻棘头虫。
A,组织压片法观察到的棘头虫;B,光学显微镜下观察到的棘头虫吻部;C,光学显微镜下观察到的棘头虫生殖系统结构A,Sphaerirostris lanceoides observed by tissue compression method;B,The head of Sphaerirostris lanceoides observed under optical microscope;C,The reproductive system structure of Sphaerirostris lanceoides observed under optical microscope图2 棘头虫形态学观察(40×)Fig.2 Morphological observation of the Sphaerirostris lanceoides (40×)
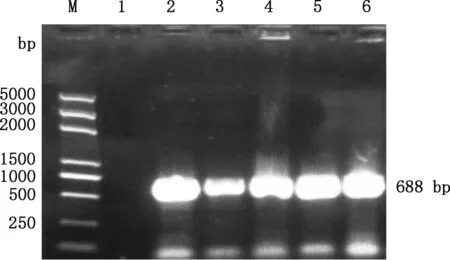
M,5K DNA Marker;1,阴性对照;2~6,分别为JS-01~JS-05M,5K DNA Marker;1,Negative control;2-6,JS-01 to JS-05,respectively图3 COⅠ基因PCR扩增电泳图Fig.3 PCR amplification electrophoresis of COⅠ gene
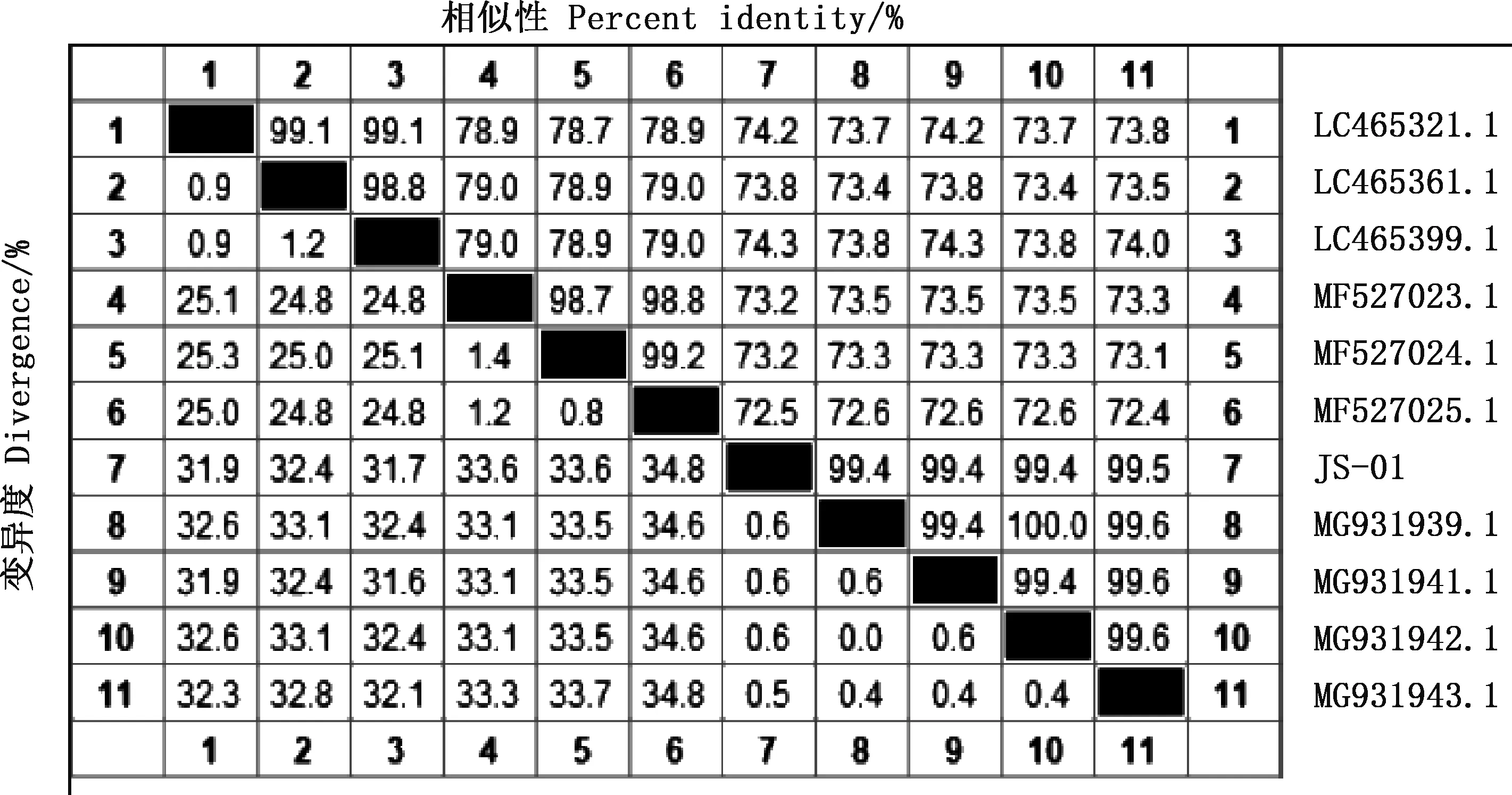
图4 基于JS-01株棘头虫COⅠ基因的相似性比对Fig.4 Similarity comparison based on COⅠ gene from Sphaerirostris lanceoides JS-01 strain
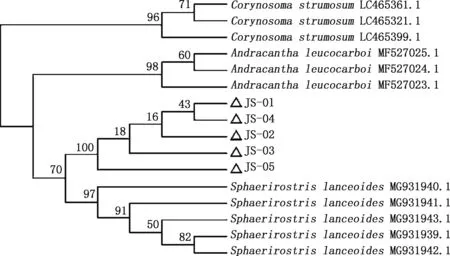
图5 基于棘头虫COⅠ基因构建的系统发育树Fig.5 Phylogenetic tree based on COⅠ gene of Sphaerirostris lanceoides
3 讨 论
鸟类被认为是似矛球吻棘头虫的终末宿主,但该虫体也有感染其他动物的报道[9]。Jing等[10]在2018年首次报道了似矛球吻棘头虫在两栖动物肠道中的寄生案例,但未见多脏器感染案例的相关报道。本次临床案例中对蟾蜍肠、肺脏、肝脏、胃、卵巢、脾脏等多个脏器进行剖检分析,发现导致蟾蜍发生虚弱死亡的寄生蠕虫为似矛球吻棘头虫,肠道和生殖腺等腺体是主要的寄生感染部位,推测全身性的感染寄生由消化道寄生虫移行导致。组织病理学观察显示,似矛球吻棘头虫在蟾蜍体内的寄生表现为机械性损伤、炎性症状等,对蟾蜍造成严重损伤,其中以肝脏机械性损伤、肠黏膜脱落、炎性增生为典型症状,与李春涛等[11]报道的黄鳝棘头虫感染的临床病理变化相近,表明该类棘头虫的感染寄生能给蟾蜍造成严重病理损伤。
现有文献表明,COⅠ基因具有较为广泛的应用,尤其在线虫[12-15]、绦虫[16-18]、吸虫[19-20]、昆虫[21]等分子生物学研究方面。本研究对感染蟾蜍优势虫种mtDNA中的COI部分片段进行了扩增鉴定,发现与似矛球吻棘头虫相似性超过了99.0%,而与Corynosoma、Andracantha等属相似性不足80.0%,在系统进化树上形成明显分支。在种内相似性方面,测定的JS-01~JS-05多序列比对,种内相似性则超过99.0%。似矛球吻棘头虫分子生物学方面的研究报道较少,本研究对COⅠ基因部分片段的扩增研究表明,COⅠ基因种内变异小,种间差异性较大,能在似矛球吻棘头虫、Corynosomastrumosum、Andracanthaleucocarboi种属间进行有效的区分。
棘头虫主要通过鼠妇等昆虫作为中间宿主,因此野鸟、昆虫等病原携带动物在养殖场的活动是圈养蟾蜍感染该类棘头虫的重要潜在途径。笔者认为,可通过采取架设天网、使用颗粒料代替昆虫等阻断方式来减少圈养蟾蜍个体的感染风险。目前在两栖动物寄生虫治疗方面研究报道较少,已知阿维菌素对虎纹蛙棘头虫的临床驱虫试验具有较好的效果[22],但也有报道发现伊维菌素类似成分阿维菌素等衍生化合物会对两栖动物生存造成负面影响[23],因此预防性驱虫时应在选药、用量等方面予以重视。该例病蟾因感染似矛球吻棘头虫而发生死亡,在两栖动物体内多脏器感染寄生未见相关临床案例和组织病理学研究,本研究结果可为药用蟾蜍棘头虫病的防控提供临床症状、病理、分子生物学等相关参考。
4 结 论
本研究报道了蟾蜍棘头虫的多脏器感染,病理学研究表明棘头虫的感染可能是造成宿主蟾蜍虚弱、死亡的重要原因;形态学和分子生物学的研究表明该案例中的棘头虫是似矛球吻棘头虫。本研究结果对蟾蜍棘头虫病的诊断和防治具有重要的参考价值。

