中国西南部分地区2020-2021年猪流行性腹泻病毒遗传变异分析
刘雨桐,姚妍婷,黎芮伶,韩文琪,石 婷,王一丹,任玉鹏
(西南民族大学畜牧兽医学院,成都 610041)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)感染引起的猪的重要腹泻类传染病,以各日龄猪的腹泻和脱水为主要特征。目前猪流行性腹泻被认为是一种跨境传播的疫病,在全球范围内广泛流行[1]。据调查显示,2012-2021年,PEDV在包括美国、加拿大、墨西哥、法国和德国等欧美国家[2-4]以及韩国[5]、越南[6]等亚洲国家持续流行。在国内,Su等[7]对2015-2018年22个省市543份样本的分子检测结果表明,PEDV总体阳性率达到66.85%(363/543),群体阳性率为100%(28/28)。周昱行等[8]在2018-2019年青藏高原地区腹泻藏猪中检测PEDV阳性率高于40%,表明其也是导致藏猪腹泻的主要病因之一。作为西南地区生猪养殖的主要省份,四川和云南地区近年来PEDV流行趋势也持续上升,如江地科等[9]对2016-2017年四川省12个地区来源的猪腹泻样本检测发现,PEDV阳性率为56.52%;张振兴等[10]对2021年引起云南曲靖某猪场10日龄仔猪死亡率达65.01%的PEDVN基因进行测序分析,结果显示,该毒株与河北 T10-HB2018 株相似性最高,与CV777和AJ1102疫苗株核酸序列存在差异,表明西南地区流行的PEDV毒株存在一定的基因多样性。因此,进一步对该地区PEDV毒株进行分子流行病学监测,了解其变异特征,对PEDV疫苗候选株的筛选和猪腹泻病的防控都具有重要意义。
PEDV基因组为不分段的单股正链RNA,由28 kb碱基组成,从基因组5′-端到3′-端依次为:5′-UTR-ORF1a/b-S-ORF3-E-M-N-3′-UTR[11]。ORF1a/b基因约占RNA全长2/3,编码复制酶多聚蛋白。在ORF1a/b基因下游有4个分别编码结构蛋白刺突糖蛋白(S)、小包膜蛋白(E)、囊膜蛋白(M)和核衣壳蛋白(N)[12]的开放阅读框。其中,S蛋白包含S1和S2两个亚结构域,分别介导细胞吸附和膜融合,还含有多个抗原表位和重要中和表位,也是诱发细胞毒性T细胞反应的主要抗原蛋白。在病毒基因组中,S基因容易变异和重组造成病毒毒力、抗原性和组织嗜性改变[13]。因此,监测S基因的遗传变异是猪冠状病毒分子流行病学研究中的重要任务。ORF3基因编码PEDV唯一辅助蛋白,与病毒的毒力强弱有关,其编码产物为离子通道蛋白,能调控病毒在宿主细胞内的增殖[14],也是PEDV分子流行病学调查中的重要靶基因[15]。
本研究拟对采自四川、云南省8个不同地区规模猪场200份腹泻猪样本进行分子检测,调查2020-2021年PEDV在西南地区的流行情况。同时,对阳性样本中PEDVS基因和ORF3基因进行克隆测序,采用生物信息学软件进行核苷酸及氨基酸序列的变异性分析和系统进化分析,以丰富中国西南地区PEDV分子流行病学资料,了解毒株遗传变异特征,为本地区猪流行性腹泻防控提供理论依据。
1 材料与方法
1.1 病料采集及处理
2020年10月-2021年2月,在四川的绵阳、乐山、南充、广元、温江和云南的昆明、临沧、保山等8个地区规模猪场采集严重腹泻的疑似PEDV感染猪的肛门棉拭子200份,按1∶1体积比加入无菌PBS(1 mol/L)充分混合后,反复冻融3次,10 000 r/min离心10 min,取上清液冻存于-80 ℃备用。
1.2 主要试剂
TRIzol RNA提取试剂盒购自赛默飞世尔科技(中国)有限公司;DL2000 DNA Marker、TaqDNA聚合酶和PCR产物纯化试剂盒均购自天根生化科技(北京)有限公司;胶回收试剂盒购自Omega Bio-Tek公司;PrimeScript®Reverse Transcriptase Kit、pMD19-T载体、大肠杆菌DH5α感受态细胞均购自宝生物工程(大连)股份有限公司。
1.3 引物设计与合成
本试验中用于检测PEDV、猪A群轮状病毒(GARV)、猪德尔塔冠状病毒(PDCoV)、猪急性腹泻综合征冠状病毒(SADS-CoV) 的引物均参照文献[16-18]合成(表1)。同时,根据GenBank中已登录的PEDV代表毒株CV777、AJ1102、DR13、LNCT2、SD-M株基因组序列(登录号分别为:AF353511、JX188454、DQ862099、KT323980.1、JX560761.1),采用Primer Premier 5.0软件设计PEDVS和ORF3基因特异性扩增引物(表2)。所有引物均由生工生物工程(上海)股份有限公司合成。

表1 检测引物信息

表2 PEDV S和ORF3基因引物信息

续表
1.4 总RNA提取与cDNA合成
用TRIzol法提取腹泻猪肛门棉拭子样本的总RNA,-80 ℃保存备用。按照PrimeScript®Reverse Transcriptase Kit说明书制备cDNA,-80 ℃保存备用。
1.5 临床样本病原检测的PCR扩增及测序
以cDNA为模板进行PCR扩增,PCR反应总体系25 μL:cDNA模板1 μL,上、下游引物各0.5 μL,2×Buffer 12.5 μL,ddH2O 10.5 μL。PCR扩增程序:94 ℃预变性2 min;94 ℃变性30 s,退火(温度见表1)35 s,72 ℃ 延伸45 s,共35个循环;72 ℃终延伸8 min。PCR产物经1.5%琼脂糖凝胶电泳鉴定后,按PCR产物纯化试剂盒说明书进行回收纯化后,送至生工生物工程(上海)股份有限公司测序。
1.6 PEDV S和ORF3基因的克隆测序
以所有PEDV阳性样本的cDNA为模板PCR扩增S和ORF3基因。 PCR反应总体系25 μL:cDNA模板1 μL,上、下游引物各0.5 μL,2×Buffer 12.5 μL,ddH2O 10.5 μL。 PCR扩增程序:94 ℃预变性2 min;94 ℃变性30 s,退火(温度见表2) 35 s,72 ℃延伸(时间见表2),共35个循环;72 ℃终延伸8 min。 PCR产物经1.5%琼脂糖凝胶电泳后,用胶回收试剂盒回收纯化,并连接至pMD19-T载体,转化大肠杆菌DH5α感受态细胞,筛选阳性克隆送至生工生物工程(上海)股份有限公司测序。
1.7 PEDV S和ORF3基因的遗传变异分析
将GenBank中已登录的中国18个省以及美国、日本、韩国、泰国和越南等不同来源的106条PEDV的S基因和68条ORF3基因序列作为参考,在MegAlign软件中使用的Clustal V计算S基因和ORF3基因核苷酸及其推导氨基酸序列的相似性;用Mega 7.0软件中Neighbor-Joining法构建系统进化树;使用Alignment Report分析S基因和ORF3基因的氨基酸变异性。
1.8 PEDV S基因的重组分析
将测序获得的PEDV S蛋白氨基酸序列提交至RDP4软件中,采用9种方法(RDP、GENECONV、Bootscan、Maxchi、Chimaera、SiSscan、PhylPro、LARD和3Seq)[19]进行基因重组分析,9种方法选用默认设置P<0.01。
2 结 果
2.1 猪腹泻病原检测
在来自四川及云南省8个地区腹泻样本中均未检出SADS-CoV;但PEDV、GARV和PDCoV群体阳性率分别为:100%(8/8)、75.00%(6/8)和62.50%(5/8),总体阳性率分别为:15.50%(31/200)、14.00%(28/200) 和7.00%(14/200)(表3),提示PEDV和GARV可能是引起2020-2021年中国西南地区猪腹泻病的主要病因。在所有8个地区来源样本中,PEDV阳性率为3.33%~32.00%,表明当前PEDV在西南地区仍持续广泛流行。此外,几种病毒还呈现不同程度的混合感染,如PEDV和GARV混合感染率为5.50%(11/200),PEDV和PDCoV混合感染率为2.00%(4/200),PEDV、GARV和PDCoV混合感染率为0.50%(1/200)。
2.2 PEDV S基因和ORF3基因相似性分析
对所有PEDV阳性样本中病毒的S和ORF3基因进行克隆测序,对测序结果进行相似性分析,最终确定获得8个PEDV毒株,分别命名为:SCGYSWUN02、SCLSSWUN02、SCMYSWUN03、SCNCSWUN01、SCWJSWUN02、YNBSSWUN01、YNKMSWUN01和YNLCSWUN01。 将8株PEDV的S和ORF3基因序列分别与GenBank上已登录的106个毒株S基因和68个毒株ORF3基因进行比对,相似性分别为90.5%~99.4%和92.9%~100%。其中,本次获得的8株PEDVS基因与经典毒株CV777、韩国疫苗株DR13及中国常用疫苗株AJ1102的相似性分别为91.7%~93.4%、91.7%~93.6%和95.8%~97.1%,ORF3基因相似性分别为93.6%~96.3%、88.3%~90.5%、93.9%~98.5%。 5株来自四川的毒株的S基因序列(SCGYSWUN02、SCLSSWUN02、SCMYSWUN03、SCNCSWUN01、SCWJSWUN02)与本地区往年流行毒株CH/SCCD/1/2018、CH/SCCD/2014、CH/SCLS/3/2019、CH/SCMY/2018、CH/SCMZ/2017、CH/SCQL/1/2018、CH/SCXM/2019、CH/SCZY103/2017、SC-YB73、SNJ-P和swun/H1/CH/SCYA/2019的S基因相似性为94.6%~99.4%;3株来自云南毒株的S基因序列(YNBSSWUN01、YNKMSWUN01、YNLCSWUN01)与云南往年流行毒株(YnP1、YnP2、YnP6和YnP9)的S基因相似性为95.6%~97.7%。
此外,5株四川来源的PEDV中,SCMYSWUN03、SCNCSWUN01和SCGYSWUN02S基因与四川CH/SCLS/3/2019株的相似性分别为98.1%、99.4%和99.2%,而SCWJSWUN02和SCLSSWUN02则分别和福建CH/FJXM/1/2012株、江苏PED/JS/2016/05/5株S基因更相似(相似性分别为98.0%和98.5%)。3个云南毒株 (YNBSSWUN01、YNKMSWUN01、YNLCSWUN01)则分别与新疆(XJ-DB2株)、云南(YnP2株)和越南(TG5株)毒株S基因相似性最高(相似性分别为97.9%、97.1%和97.7%)(表4)。

表3 临床样本病原检测结果

表4 8个毒株S和ORF3基因核苷酸相似性比对
从ORF3基因来看,SCWJSWUN02、SCMYSWUN03和SCLSSWUN02株与四川毒株(CH/SCCD/2014、CH/SCMY/2018和SNJ-P)的相似性均较高。而SCNCSWUN01株则与福建XM2-4株相似性最高(相似性为98.4%)。
2.3 PEDV S基因和ORF3基因的系统进化分析
将此8株 PEDVS和ORF3基因序列分别与参考毒株进行比对,并绘制进化树。结果显示,本次测序的8株PEDV均属于G2群(图1),5株四川源PEDV中,SCMYSWUN03、SCNCSWUN01和SCGYSWUN02 株属于G2-c亚群,与多个四川近年流行毒株共同聚为一大支,其中与CH/SCLS/3/2019 株的距离最近;SCLSSWUN02株单独与PED/JS/2016/05/5株聚为一小支;SCWJSWUN02株属于G2-b亚群,与HUA/14PED96、ZJCZ4和CH/FJXM/1/2012株 3个毒株可能存在演化关系。3株云南源PEDV中YNLCSWUN01株属于G2-a亚群,与新疆XJDB2株的亲缘关系最近;YNKMSWUN01和YNBSSWUN01株属于G2-b亚群,与云南近年流行毒株YnP2、YnP6和YnP9株的距离较近。其中YNKMSWUN01株又与TG5和BT3株聚为一支,与越南PEDV毒株存在密切演化关联。
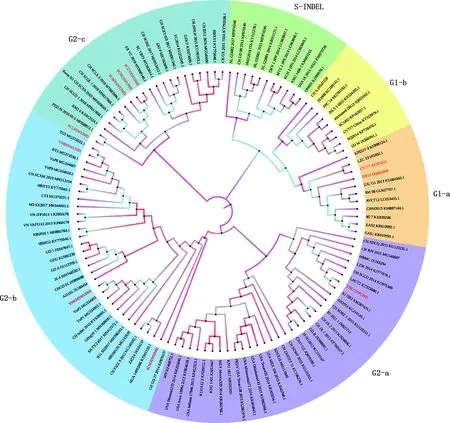
图1 基于PEDV S基因构建的遗传进化树Fig.1 Genetic evolutionary tree based on PEDV S gene
根据PEDVORF3基因构建进化树可以将所有毒株分为G1、G2a和G2b 3个亚群,G1群主要包含了经典毒株CV777、DR13、LZC和其他弱毒疫苗株。本次测序的8个PEDV毒株均属于G2群(图2),其中SCNCSWUN01、YNBSSWUN01和YNKMSWUN01属于G2-a亚群;SCGYSWUN02、SCWJSWUN02、YNLCSWUN01、SCLSSWUN02、SCMYSWUN03株属于G2-b亚群。来自四川省的5个毒株中,SCNCSWUN01与福建 CH/FJZZ/9/2012株单独聚为一小支;SCGYSWUN02和SCWJSWUN02 株聚为一支,与LZW株距离最近;SCLSSWUN02和SCMYSWUN03 株分别与SNJ-P株和CH/SCMY株进化关系最近。3个云南毒株中,YNLCSWUN01与LNCT2 株ORF3基因可能存在演化关系,而另外2株(YNKMSWUN01和YNBSSWUN01株)的关系较近,且与1个越南株HUA PED68和1个湖北株CH/hubei/2016聚为一支。
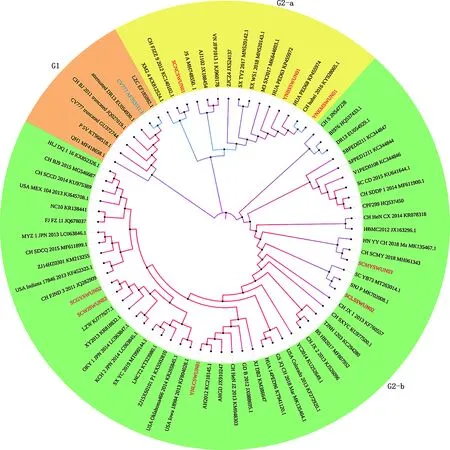
图2 基于PEDV ORF3基因构建的遗传进化树Fig.2 Genetic evolutionary tree based on PEDV ORF3 gene
2.4 PEDV S和ORF3蛋白的变异分析
将本次测序的8个PEDV毒株S和ORF3基因推导的氨基酸序列与其他在GenBank上登录的106个S蛋白和68个ORF3蛋白氨基酸序列毒株比对发现,本次测序的8个毒株存在多个氨基酸位点的变异,如表5所示。SCGYSWUN02、SCLSSWUN02、SCMYSWUN03、SCNCSWUN01和SCWJSWUN02 株S蛋白分别存在5、9、14、6和25个氨基酸突变,YNBSSWUN01、YNKMSWUN01、YNLCSWUN01株S蛋白分别存在26、29和26个氨基酸变异;SCMYSWUN03 株S蛋白在59-62位氨基酸处还存在4个氨基酸的缺失(QGVN),YNKMSWUN01 株在78-82位氨基酸处有5个氨基酸的插入(RRLCI),在84-88位氨基酸处有5个氨基酸的缺失(GIFVS)。部分毒株在已鉴定的S蛋白受体结合区域(249-529位氨基酸处)有2~6个氨基酸的变异,如SCGYSWUN02株的第274位(V→C)和第488位(S→C);SCLSSWUN02株的第351位(N→R)、第353位(S→R)和第358位(A→T);SCMYSWUN03株的第318位(A→P)和第379位(T→N);YNBSSWUN01 株的第247位(N→K)、第346位(S→P)、第347位(F→S)、第457位(A→V)、第461位(V→A)和第463位(Y→N);YNKMSWUN01 株的第235位(I→P)、第337位(L→R)、第356位(P→A)、第396位(R→S)和第247位(E→Q);YNLCSWUN01 株的第458位(T→Q)、第464位(C→S)、第472位(K→N)、第478位(F→D)和第482位(G→T)。
此外,在SCLSSWUN02、SCMYSWUN03、SCNCSWUN01、SCWJSWUN02 4个四川毒株ORF3蛋白分别发现6、5、8和6个氨基酸变异,3个云南毒株YNBSSWUN01、YNKMSWUN01和YNLCSWUN01的ORF3蛋白分别存在4、8和6个氨基酸变异,但未发现氨基酸缺失或插入。

表5 PEDV S和ORF3蛋白氨基酸变异分析
2.5 PEDV S基因的重组分析
基于遗传进化分析结果进一步对PEDV毒株S基因进行重组分析,结果显示,8个毒株中的4株S基因可能出现重组事件,概率分别为:SCLSSWUN02株67.3%(P<0.01),SCMYSWUN03株98.2%(P<0.01),SCWJSWUN02株60%(P<0.01),YNKMSWUN01 株62.7%(P<0.01)。其中SCMYSWUN03 株发生重组的概率最高,为98.2%,其主要亲本为G2-c亚群的SCGYSWUN02株,次要亲本为G2-b亚群的CH/SCXM/2019株,推测重组区域为150~270 nt (图3)。

图3 SCMYSWUN03株S基因的重组分析Fig.3 The genetic recombination analysis of SCMYSWUN03 S gene
3 讨 论
近年来,PEDV在中国西南地区的流行呈上升趋势。如杨丹娇等[20]对四川省部分地区猪腹泻样本中检测PEDV阳性率达43.06%;Zuo等[21]发现云南省部分地区猪腹泻样本中PEDV总体阳性率达17.47%。本研究对2020-2021年四川及云南8个地区的疑似样本检测结果表明,PEDV检出率为15.50%(31/200),在所有腹泻病毒中占比最高。表明PEDV仍是引起中国西南地区猪群腹泻的主要病毒。此外,PEDV与GARV、PDCoV常呈现不同形式的混合感染,加剧腹泻,给猪腹泻病防控带来困难。因此,还需持续对几种主要腹泻病毒的感染分布进行调查,进一步加强对上述病原的检疫和净化,为制定更具针对性的防控措施提供依据。
S蛋白是PEDV的主要毒力和抗原蛋白,在病毒与宿主细胞的结合、毒株抗原性和致病性方面发挥重要的作用,也是基因分型的主要依据[22]。基于S基因构建进化树一般将PEDV分为S-INDEL毒株、G1型和G2型等3个主要基因型[23]。G1型包含CV777、DR13、SD-M株等早期经典毒株;G2型又分为G2a、G2b和G2c亚型,是近年来中国主要流行的PEDV毒株[24]。本研究测序的8株PEDVS基因测序分析结果表明,与GenBank上已登录的106个毒株S基因相似性为90.5%~99.4%;与G1型经典毒株CV777的相似性较低,但与G2型疫苗株AJ1102的S基因相似性为95.8%~97.1%,提示AJ1102疫苗株可能对西南地区流行的PEDV毒株具有更好的保护效果。结合S基因的核苷酸相似性分析结果,可推测目前四川地区流行的PEDV毒株除与本地区往年流行毒株存在亲缘关系外,部分毒株还可能与福建源PEDV发生基因重组或重配,形成了新的PEDV毒株。 同样的现象在3个云南毒株中也存在。 如YNBSSWUN01和YNKMSWUN01 2个云南毒株ORF3基因更接近于湖北毒株(CH/hubei/2016和M3/SX2017),但其S基因又分别与云南YnP2株和越南TG5株相似性最高,这表明不同毒株间的基因重配现象是PEDV基因组变异的重要方式之一。
对S基因系统进化分析显示,8个毒株包含了G2a、G2b和G2c 3种亚型,表明当前西南地区流行的PEDV毒株基因组具有遗传多样性。这与Tian等[25]对2014-2018年四川地区流行的 PEDV基因型调查结论相符,并进一步提示近年来该地区流行的PEDV持续表现出较高的变异性。在5株四川源PEDV中,SCMYSWUN03、SCNCSWUN01、SCGYSWUN02和SCLSSWUN02株属于G2-c亚群。与多个四川近年流行毒株距离较近,存在演化关联。而SCWJSWUN02株属于G2-b亚群,与福建CH/FJXM/1/2012株亲缘关系较近,表明四川地区当前流行的PEDV毒株存在省际间相互传播的可能。此外,在3个云南源PEDV毒株中,YNLCSWUN01株为G2-a亚群,与新疆XJDB2株的亲缘关系最近;YNKMSWUN01和YNBSSWUN01株为G2-b亚群,与云南近年流行毒株YnP2、YnP6和YnP9的距离较近。尤其是YNKMSWUN01株与2个越南毒株(TG5和BT3株)单独聚为一支,可能存在密切演化关联。这提示,PEDV在中国西南地区的流行不仅存在区域内传播的特征,也存在区域间(如省际、国际间) 传播的可能。尤其云南省地处边陲,更易于在同周边国家生猪及其相关制品贸易往来的过程中导致病毒相互传播,需加强对PEDV的检疫。
进一步对S基因推导的氨基酸序列进行了变异性分析和重组分析。结果表明,8个PEDV毒株S蛋白氨基酸序列与已登录的参考序列相比都存在不同数量的氨基酸位点突变,尤其是SCMYSWUN03、YNBSSWUN01、YNLCSWUN01株在已经证实的PEDV S蛋白中和抗原表位(499-638位氨基酸处)[26]上存在氨基酸的突变。部分毒株还出现了连续的氨基酸插入或缺失。此外,还发现上述毒株氨基酸突变多集中于S1区(1-789位氨基酸)。研究表明,PEDV S蛋白S1区包含了主要的中和表位和受体结合域,在介导中和抗体产生过程中发挥重要作用,同时S1区也决定了PEDV的组织嗜性及病毒对宿主细胞的感染能力[27]。所以,这些氨基酸变化是否对病毒毒力或抗原性造成影响有待于进一步证实。
此外,基因重组分析结果表明,8株PEDV中有4株发生了重组事件,重组概率均>60%。主要由本地区往年流行的毒株为亲本发生重组,同时也出现了不同区域间流行毒株的重组现象,如SCLSSWUN02株亲本株分别为江苏 PED/JS/2016/05/5株和越南的TG5株;YNKMSWUN01株亲本株为G2/b亚群的湖北CH/hubei/2016株和G1/b亚群的江苏JSLS/1/2015株,为跨群重组。进一步验证了相似性分析和遗传进化分析的结论,即当前西南地区流行的PEDV毒株存在较高的基因多样性,不同地区毒株存在相互传播和密切的演化关联。
PEDVORF3基因是PEDV唯一的辅助蛋白,也与病毒毒力的强弱有关,在病毒增殖过程中起重要调控作用[28]。本研究对检出的8株PEDVORF3基因也进行了相似性分析和系统进化分析。结果显示,本次获得的8株PEDVORF3基因相较于S基因更为保守。另外,基于ORF3基因的进化分析同样将所有PEDV毒株分成G1和G2两个大群,本次测序毒株均为G2群。但基于ORF3基因构建的进化树与基于S基因的又有所不同。如在ORF3基因的进化树中,SCNCSWUN01株ORF3基因与福建 CH/FJZZ/9/2012株单独聚为一小支,但在S基因构建进化树中其与CH/SCLS/3/2019四川流行株距离更近,由此推测目前四川地区流行的PEDV毒株,除与本地区往年流行毒株存在演化关联外,部分毒株还可能与福建源PEDV发生基因重配,形成了新的PEDV毒株。
4 结 论
本研究在四川和云南部分地区获得8个PEDV毒株,经过生物信息学分析表明,8株PEDV的S和ORF3基因序列分别与GenBank上已登录的106个毒株S基因和68个毒株ORF3基因进行比对,相似性分别为 90.5%~99.4%和92.9%~100%。部分毒株S蛋白存在连续氨基酸的插入或缺失,如SCMYSWUN03株S蛋白在59-62位氨基酸处存在4个氨基酸的缺失;YNKMSWUN01株在78-82位氨基酸处有5个氨基酸的插入,在84-88位氨基酸处有5个氨基酸的缺失。8株PEDV毒株与其他省份地区的毒株存在演化关联,在基因重组分析中SCMYSWUN03株重组概率为98.2%,提示四川地区流行的PEDV毒株可能与其他地区发生了基因重配,形成了新的PEDV毒株。本研究为本地区猪腹泻病的防控和净化提供了理论依据,也为新型疫苗候选株的筛选提供了参考数据。

