栝楼桂枝汤通过调节脊髓NMDA受体/KCC2通路改善脑缺血再灌注大鼠肢体功能
邹俊, 张继州, 蒋畅, 韩静
当前,许多疾病都严重危害人类的健康,缺血性脑卒中就是其中之一,此类疾病的特点十分显著,发病率、致残率以及术后复发率均居高不下[1],是世界人口死亡的第2个主要因素,是导致长期残疾的首要因素[2]。肢体痉挛在缺血性脑卒中引起的肢体功能障碍中发生率较高,极大地干扰患侧肢体所进行的行为[3],其发病的主要机制与脊髓运动中枢过度兴奋导致的牵张反射亢进有关[4]。当前世界上已经确认用于临床的抗痉挛药物有巴氯芬、替扎尼定和丹曲林3种。这些药物虽然能够缓解部分肢体痉挛,但随着治疗时间延长,效果均显著降低[5],同时存在较多毒副作用,如嗜睡、认知障碍、静脉血栓等[6]。
《金匮要略》中首次提到栝楼桂枝汤并用来治疗外感热病引起的痉挛等病症。福建省第二人民医院运用该方剂治疗脑卒中后的肢体痉挛,显示出较好疗效,明确了该方剂柔润筋脉、解肌止痉等功用[7-8],并已开发院内制剂。但目前尚未有针对该方剂对卒中后脊髓牵张反射亢进的调节作用以及相关分子机制的研究,缺少作用机制相关资料。据相关研究报道[9],K+- Cl-共转运体(KCC2)下调引起细胞内氯离子浓度升高可能是导致运动神经元过度兴奋从而引起脑卒中后肢体痉挛发生的重要机制之一;且脊髓运动神经元过度兴奋时N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体出现上调。为探究该方剂是否通过NMDA受体/KCC2相关通路参与发挥抗卒中后肢体痉挛的作用,本研究采用神经行为学评价方法,观察给予栝楼桂枝汤后脑缺血再灌注大鼠肢体功能的康复状况,采用免疫组织化学染色方法观察栝楼桂枝汤对脊髓运动神经元的兴奋作用,并采用qRT-PCR方法研究栝楼桂枝汤对NMDA受体/KCC2通路蛋白转录的影响,探讨栝楼桂枝汤调控脊髓相关通路改善肢体痉挛的相关机制,为明确该方调节肢体痉挛的作用机制提供科学依据。
1 材料与方法
1.1 材料
1.1.1 动物 健康雄性SD大鼠36只,体质量(290±10)g,SPF级[上海斯莱克实验动物有限责任公司,许可证号:SCXK (沪)2020-0003],明暗条件为每日各12 h(光照时间8:00—20:00),自由饮食饮水。本研究经福建省中医药科学院动物伦理委员会审核批准(FJATCM-IAEC2020012),动物实验操作严格遵循动物相关规定。
1.1.2 试剂 中药配方颗粒天花粉(200605)、桂枝(200311)、芍药(200123)、甘草(200104)、大枣(200104)(北京康仁堂药业有限公司);兔抗KCC2抗体(货号:ab49917)、兔抗c-fos抗体(货号:ab190289)、兔抗NMDAR1抗体(货号:ab68144)、兔抗NMDAR2A抗体(货号:ab169873)、兔抗NMDAR2B抗体(货号:ab73001)(英国Abcam公司);即用型快捷免疫组化MaxVision 2 HRP试剂盒(鼠/兔)(货号:2009175920D,福州迈新生物技术开发有限公司);分子生物级超纯水(货号:SH30538.02,美国HyClone公司);RNA提取液(货号:G3013)、Servicebio®RT First Strand cDNA Synthesis Kit(货号:G3330)、2×SYBR Green qPCR Master Mix (none ROX)(货号:G3320)(武汉赛维尔生物科技有限公司);异氟烷(R510-22-16,深圳瑞沃德生命科技有限公司)。
1.2 方法
1.2.1 大鼠局灶性脑缺血再灌注模型 采用线栓法制作大脑中动脉缺血再灌注模型[10]。动物在异氟烷气体吸入麻醉下进行手术,对其颈部的正中心切口,钝性分离颈内动脉(internal carotid artery,ICA)、颈外动脉(external carotid artery,ECA)和颈总动脉(common carotid artery,CCA);分别电凝甲状腺上动脉和枕动脉。距CCA分叉约10 mm处结扎ECA近心端,电凝阻断远心端。暂时性封闭CCA,将MCAO线栓从ECA残端相距CCA叉口约5 mm处暴露的小切口插入ICA,线栓首端距CCA分叉处约20 mm时,进栓出现轻微的阻力,此时为线栓刚好进入大脑的前动脉,封堵大脑中动脉的开口,MCAO模型制作完成。造模2 h后,动物在异氟烷气体麻醉下拔出线栓并结扎ECA残端。术后20~25 ℃条件下饲养大鼠,自由饮食饮水。假手术组除去ICA进线栓步骤外,其余步骤和上述均一致。模型制作后按照Longa神经功能缺失标准(五分制)[11]进行神经功能评分,1~3分代表建模成功。具体细则制定如下:神经缺陷所导致症状不明显或没有,行为正常为0分;抬起大鼠尾部时,左前肢缺少伸展动作为1分;大鼠整个躯体活动时出现偏好患侧旋转为2分;大鼠出现无法控制的躯干倾斜为3分;无法进行自主行走或处于重度昏迷状态为4分。
1.2.2 中药颗粒配制及动物分组给药 采用天花粉30 g、桂枝9 g、芍药9 g、甘草6 g、生姜9 g和大枣9 g标准配方颗粒配制栝楼桂枝汤。量取120 mL去离子水加热至沸腾,加入一剂栝楼桂枝汤颗粒剂,用玻璃棒搅拌均匀,在100 ℃沸水浴中冲泡混合作用30 min,缓慢冷却至室温。根据动物体表面积等效剂量换算,大鼠灌胃剂量是成人临床剂量的5倍[12],即生药量6 g/kg。按照1.2.1的方法对SD大鼠进行造模,术后第1天进行Longa法评分。选取造模成功的大鼠36只,利用随机数字进行完全随机分组,模型组、栝楼桂枝汤组及假手术组各12只。栝楼桂枝汤组于分组后,立刻进行灌胃,每只均依照体质量给予等量汤剂(1 mL/100 g),持续给药7 d,每日1次,其余组别均给予等量生理盐水。
1.2.3 动物神经行为学评价 在第3天和第7天对分组后的大鼠进行神经行为学评分,具体标准分以下两个部分:改良型神经缺损等级评分(modified neurological severity score,mNSS)和平衡木测试(beam balance test,BBT)。
1.2.3.1 mNSS 评分 参照文献[13],通过包含感觉、反射、运动以及平衡标准的改良型神经缺损等级进行评分。重度神经功能缺失为10~14分;普通神经功能缺失为6~9分;轻微神经功能障碍为1~5分;表现正常为0分。
1.2.3.2 BBT评分 主要考察动物在特定运动下的协调和平衡功能,取一根长45 cm、宽2 cm、距离实验台面40 cm的特质塑料条,将动物放在上面,检测动物的活动情况并计时。具体评分细则[14]如下:有较强的平衡感并持续保持为0分;平衡感稍好但始终保持紧张并抓紧塑料条为1分;可抓紧塑料条但出现一爪无力垂下状态为2分;可抓紧塑料条但出现二爪无力垂下状态或出现旋转(t>60 s)为 3分;努力尝试保持稳定但落下(40 s≤t≤60 s)为4分;努力尝试保持稳定但落下(20 s≤t<40 s)为5分;努力尝试保持稳定但落下或无法抓稳(t<20 s)为6分。大鼠的神经功能缺失越多则评分越高。
1.2.4 免疫组织化学染色及图像分析 在第7天行为学评价结束后,每组各取6只动物,用10%水合氯醛进行腹腔注射麻醉,经心脏灌注4%多聚甲醛和生理盐水固定;待固定完全,断头取出脊髓的颈膨大部位,以20%、30%蔗糖进行梯度脱水,OTC包埋后进行厚度为30 μm的连续冠状冰冻切片。采用漂片法对脊髓冰冻切片进行c-fos、KCC2及NMDA受体各亚型染色。切片经PBS漂洗,在3%的过氧化氢中,进行10 min的室温孵育,后再次经PBS漂洗,在兔多克隆c-fos抗体(1∶5 000)、兔多克隆KCC2抗体(1∶3 000)、兔多克隆NMDAR1抗体(1∶400)、兔多克隆NMDAR2A抗体(1∶1 000)、兔多克隆NMDAR2B抗体(1∶250)中4 ℃过夜孵育。经PBS漂洗,随后在新型酶标聚合物(羊抗小鼠/兔IgG)中室温孵育15 min,洗片;后在DAB显色液中显色10 min。最后将切片在玻片中铺平,在二甲苯中透明,用中性树胶封片,在倒置显微镜20倍下进行观察并拍照。每只动物均拍摄2张脊髓片,选取2个不重复的随机连续视野,采用Image J 1.50图像分析软件进行半定量计算分析测定脊髓前角目的标记物。
1.2.5 qRT-PCR检测及定量分析 在第7天行为学评价结束后,每组各取6只动物,采用10%水合氯醛对其腹腔注射麻醉,取出脊髓的颈膨大部位。采用TRIzol法提取总RNA,先用Servicebio®RT First Strand cDNA Synthesis Kit逆转录得到cDNA,然后用2×SYBR Green qPCR Master Mix(none ROX)试剂盒,采用qRT-PCR检测NMDA受体各亚型(NMDAR1、NMDAR2A、NMDAR2B)以及KCC2 mRNA的表达水平。通过2-ΔΔCT法进行相对定量并分析。引物序列见表1。

表1 qRT-PCR的引物
2 结 果
2.1 栝楼桂枝汤对缺血再灌注大鼠神经行为学评分的影响 脑缺血再灌注3 d开始,与假手术组比较,模型组大鼠的肢体功能发生障碍,mNSS评分显著升高(P<0.01);给予栝楼桂枝汤治疗7 d后,与模型组比较,栝楼桂枝汤组mNSS评分显著降低,肢体功能明显改善(P<0.05,图1A)。独立观察平衡木测试(图1B),模型组较假手术组评分升高,差别有统计学意义(P<0.01),给予栝楼桂枝汤治疗 7 d 后评分降低,与模型组比较,差别有统计学意义(P<0.01)。
2.2 栝楼桂枝汤对缺血再灌注大鼠脊髓神经细胞c-fos及KCC2表达水平的影响 免疫组织化学染色观察,神经细胞兴奋性标记物c-fos集中于脊髓前角,模型组双侧神经细胞兴奋性标记物免疫阳性染色在患侧较健侧显著加深,表达水平的比值(患侧/健侧)模型组较假手术组升高,差别有统计学意义(P<0.01),患侧较健侧免疫阳性染色显著加深;给予栝楼桂枝汤后脊髓前角c-fos表达水平比值较模型组降低,差别有统计学意义(P<0.01,图2A,图3A)。模型组KCC2的免疫阳性染色在患侧较健侧显著淡化,与假手术组比较,其表达水平的比值(患侧/健侧)降低,差别有统计学意义(P<0.01);给予栝楼桂枝汤后表达水平较模型组升高,差别有统计学意义(P<0.01,图2B,图3B)。
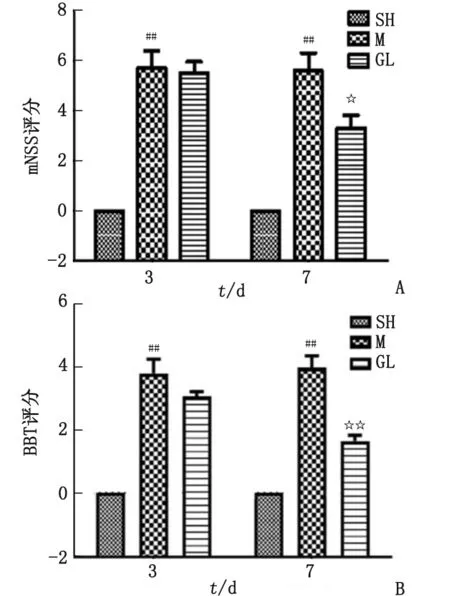
n=12。SH:假手术组;M:模型组;GL:栝楼桂枝汤给药组;mNSS评分:改良型神经缺损等级评分;BBT:平衡木测试。A:mNSS评分;B:BBT评分。与假手术组比较,##:P<0.01;与模型组比较,☆:P<0.05,☆☆:P<0.01。图1 栝楼桂枝汤对大鼠mNSS和Beam Balance的影响Fig.1 Effects of Gualou Guizhi Decoction on mNSS and Beam Balance in rats

SH:假手术组;M:模型组;GL:栝楼桂枝汤给药组。A:c-fos;B:KCC2。图2 各组大鼠脊髓双侧c-fos和KCC2表达水平的差异( ×20)Fig.2 Differences in the expression levels of bilateral c-fos and KCC2 in the spinal cord of rats in each group( ×20)

n=6。SH:假手术组;M:模型组;GL:栝楼桂枝汤给药组。A:c-fos;B:KCC2。与假手术组比较,##:P<0.01;与模型组比较,☆☆:P<0.01。图3 栝楼桂枝汤对大鼠脊髓双侧c-fos和KCC2表达水平比值的影响Fig.3 The effect of Gualou Guizhi Decoction on the expression ratio of bilateral c-fos and KCC2 in rat spinal cord
2.3 栝楼桂枝汤对缺血再灌注大鼠脊髓NMDA受体各亚型表达水平的影响 免疫组织化学染色观察,模型组NMDA受体各亚型的免疫阳性染色在患侧较健侧显著加深,与假手术组比较,其表达水平的比值(患侧/健侧)升高,差别有统计学意义(P<0.01);给予栝楼桂枝汤后表达水平较模型组降低,差别有统计学意义(P<0.01,图4,图5)。

SH:假手术组;M:模型组;GL:栝楼桂枝汤给药组。A:NMDAR1;B:NMDAR2A;C:NMDAR2B。图4 各组大鼠脊髓双侧NMDA受体各亚型表达水平的差异( ×20)Fig.4 Differences in the expression levels of various subtypes of NMDA receptors in bilateral spinal cords of rats in each group( ×20)
2.4 栝楼桂枝汤对缺血再灌注大鼠脊髓NMDA受体各亚型及KCC2 mRNA表达水平的影响 qRT-PCR结果显示(图6A),模型组较假手术组脊髓NMDA受体的各亚型(NMDAR1、NMDAR2A、NMDAR2B)的mRNA表达水平上升,差别有统计学意义(P<0.01),给予栝楼桂枝汤后mRNA表达水平较模型组降低,差别有统计学意义(P<0.01);模型组较假手术组KCC2的mRNA表达水平降低,差别有统计学意义(P<0.01),给予栝楼桂枝汤后mRNA表达水平较模型组显著升高(P<0.01,图6B)。
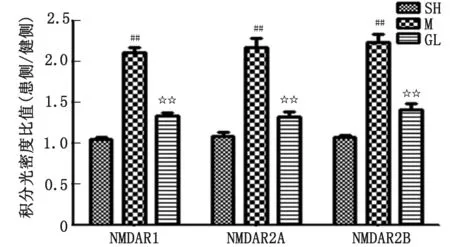
n=6。SH:假手术组;M:模型组;GL:栝楼桂枝汤给药组。与假手术组比较,##:P<0.01;与模型组比较,☆☆:P<0.01。图5 栝楼桂枝汤对大鼠脊髓双侧NMDA受体各亚型表达水平比值的影响Fig.5 Effects of Gualou Guizhi Decoction on the ratio of expression levels of various subtypes of NMDA receptors in the bilateral spinal cord of rats

n=6。SH:假手术组;M:模型组;GL:栝楼桂枝汤给药组。A:NMDA受体各亚型mRNA表达水平;B:KCC2 mRNA表达水平。与假手术组比较,##:P<0.01;与模型组比较,☆☆:P<0.01。图6 栝楼桂枝汤对大鼠NMDA受体各亚型mRNA及KCC2 mRNA表达水平的影响Fig.6 Effects of Gualou Guizhi Decoction on the expression levels of NMDA receptor subtype mRNA and KCC2 mRNA in rats
3 讨 论
本研究采用mNSS和BBT等神经行为学测定方法对脑缺血再灌注大鼠进行行为活动和肢体功能的评价[15]。从神经行为学的表现分析,给予栝楼桂枝汤的第3天开始,肢体功能逐渐恢复;于第7天出现显著性差异,大鼠的肢体痉挛症状和躯干协调性出现明显好转。结果表明栝楼桂枝汤可显著改善脑缺血所致的神经功能障碍,对肢体痉挛起到较好的缓解作用。
缺血性脑卒中发生后,脊髓上部中枢(锥体束等)受损,导致脊髓运动中枢的抑制作用消失,引起α运动神经元过度兴奋从而导致牵张反射亢进,这是卒中后肢体痉挛发生的主要原因[4]。c-fos是一种即刻早期基因,在神经细胞的发育、分化、再生修复等情况下均有表达,可作为神经细胞兴奋性标记物[16]。研究表明[17-18],在大鼠出现缺血再灌注损伤后,脊髓运动神经元中c-fos表达增加,在一定程度上反映了脊髓运动神经元异常激活的情况。本研究对神经细胞兴奋性标记物c-fos进行免疫组织化学染色,结果显示,与假手术组比较,大鼠发生脑缺血损伤后脊髓前角c-fos的表达显著升高,给予栝楼桂枝汤治疗后,c-fos的表达出现显著降低,提示该方对卒中后脊髓运动神经元兴奋性产生抑制作用,对卒中后肢体痉挛起到缓解作用。
近年,相关研究表明,有一类阳离子-氯离子共转运体参与了脊髓前角运动神经元兴奋性调节[19];且在整个神经系统中,细胞内氯离子浓度发生变化时,神经传递(γ-氨基丁酸介导)的方向和强度都会受到影响[20],其中促进氯离子外排的转运体KCC2是研究的重点和方向。KCC2的免疫染色及mRNA表达水平检测结果显示,模型组较假手术组KCC2下降;提示脑缺血再灌注大鼠出现神经兴奋性增强及脊髓牵张反射功能亢进同时伴随KCC2的下调相关。在给予栝楼桂枝汤治疗后,发现脑缺血损伤导致的KCC2下调明显恢复;表明栝楼桂枝汤可作用于脊髓前角,参与调控KCC2。
研究表明,在脑缺血再灌注损伤的大鼠中,NMDA受体激活将导致KCC2功能下调[21]。本研究进一步探究NMDA是否参与了栝楼桂枝汤调节卒中后肢体痉挛的相关机制,与KCC2的表达是否存在联系。本研究进行了脊髓前角NMDA受体各亚型免疫组织化学染色和mRNA表达水平的检测,结果显示,模型组NMDA受体各亚型的表达较假手术组显著升高,给予栝楼桂枝汤后显著降低,表明NMDA受体参与栝楼桂枝汤缓解脑缺血后肢体痉挛的机制;结合KCC2免疫组织化学及mRNA表达水平的检测结果,NMDA受体的上调和KCC2表达水平的下调共同参与了卒中后肢体痉挛产生的机制,与文献报道一致;给予栝楼桂枝汤后NMDA受体发生下调,KCC2的下调得以恢复,两者的变化存在一定关联。但在栝楼桂枝汤的作用下,NMDA受体是如何调控KCC2并共同参与调节卒中后肢体痉挛等问题还有待进一步研究。
近年来,栝楼桂枝汤对脑缺血损伤的神经保护作用机制的基础研究主要集中在对脑组织神经炎症的抑制[22-23]、抑制凋亡促进轴突及功能的重塑[1, 24]等机制的探讨,同时,相关研究还显示,该方降低了脑组织AMPA和NMDA谷氨酸受体蛋白的表达[25],增加GABA受体mRNA和蛋白表达[26]。然而,这些研究均未涉及对脑缺血后脊髓牵张反射亢进的调节作用以及分子机制的研究。本研究首次报道了栝楼桂枝汤调控脊髓NMDA受体及其下游KCC2蛋白,降低脊髓前角运动神经细胞兴奋性的作用,从新的视角为栝楼桂枝汤应用于临床肢体痉挛提供一定的理论依据;但本研究尚未确定不同剂量栝楼桂枝汤对缺血再灌注损伤大鼠肢体功能的影响,具体量效关系仍需进一步探究,后续将进一步补充实验,研究该问题。

