不同成熟度桑叶分区位置的叶绿素荧光参数与叶绿素相对含量分析
李韬 林强 陆晓媚 邱长玉 唐燕梅 刘丹 卢德 张朝华 朱光书 曾燕蓉
(1. 广西壮族自治区蚕业技术推广站, 南宁 530007;2. 广西壮族自治区蚕业科学研究院, 南宁 530007)
绿色植物能利用外界的无机营养制造自身所需要的有机营养物质,其中95%以上的有机物质来自光合作用。植物的光合作用主要发生在叶片,其中最重要的细胞器就是叶绿体,叶绿体内部的类囊体膜上分布有叶绿素,它们是植物叶片光合作用的主要色素。研究植物的叶绿素和光合作用,对提高农林生产中的光能利用率具有重要意义[1]。
常见的植物叶绿素含量测定方法主要有3种。第1种方法是将叶片带回实验室利用分光光度计进行测定。第2种方法是使用便于携带的叶绿素计(Soil and Plant Analyzer Development,SPAD),在室外直接按钮操作对叶片进行无损测定获取叶绿素的相对含量(SPAD值)[2-7],这种方法也早已应用于桑树光合作用的研究[8-10]。利用叶绿素计(SPAD)可以适时地判断作物当前的氮素营养状况,从而及时施肥改善作物的氮素供应[11-16];还可以用于优良作物种质资源的筛选,提高作物育种效率[17-18]。第3种方法是叶绿素荧光分析方法,其利用被誉为植物内部光合作用与外部环境关系之间的内在探针的叶绿素荧光信号,反映植物光合作用过程中非常丰富的变化信息[19],该方法使用的检测仪器灵敏度高,检测操作简便、快速且对叶片无损伤,目前已在包括桑树等多种植物逆境时的光合响应机制研究中广泛应用[20-36]。水稻[37-38]、紫花苜蓿[39]等作物已有同时利用叶绿素荧光特征参数与SPAD值开展研究的报道,而且叶绿素荧光特征参数与SPAD值二者之间的相关性在小麦叶片叶绿素相对含量估算方法的研究中已有涉及[40]。
关于植物不同成熟度叶片及叶片不同位置的叶绿素荧光参数与SPAD值研究,徐照丽等[5]认为叶片基部是叶绿素计(SPAD-502)的最佳测量部位,不同叶位、不同成熟度烟叶的叶绿素计读数与叶绿素含量之间呈显著相关;邱长玉等[41]发现大部分桑树其最大叶片近尖区的SPAD值较高,其次为中央区,桑树第13位叶或第14位叶的SPAD值相对较高,与其他叶位的差异达显著水平,第3位叶的SPAD值显著低于大部分叶位,第3~14叶位的SPAD值总体上呈递增趋势。由此可见,叶绿素荧光分析技术与叶绿素计用于研究时,测量叶片的成熟度及叶片的部位可选择性太大。为了更准确、快速地测定桑树叶片的叶绿素荧光参数与SPAD值,我们拟选择不同成熟度的桑叶再将叶片细分成若干区域测定叶绿素荧光参数和SPAD值,并分析其相关性,期望能为推进桑树的光合作用机制研究以及肥培管理和优良育种材料选拔等提供更好的技术支持。
1 材料与方法
1.1 供试材料
2020年12月选择广西壮族自治区蚕业技术推广站桑树资源圃内保存桑品种“2172”1年生的健康枝条作为接穗,以桑品种“桂桑优12”的1年生优质实生苗作为砧木,用冬季根接的方法进行嫁接育苗,嫁接苗假植于资源圃中,按常规进行肥水管理,自然条件下生长1年。2021年11月初,将假植成活的嫁接苗移植于基质消毒后的花盆内,枝条保留基部的2~3个芽,将多余部分减掉,正常浇水管理。2021年12月,桑树的每根枝条长出7~12片叶,选择健康、无病虫害、叶形完整舒展的将成熟叶片(叶色浅翠绿色,编号Ⅰ)、刚成熟叶片(叶色翠绿色,编号Ⅱ)、已成熟叶片(叶色为饱满绿色,编号Ⅲ)各1片,进行叶片测量的区域划分后用于测定叶绿素荧光参数和SPAD值。
1.2 主要仪器
MINI-PAM-II超便携式调制叶绿素荧光仪(德国WALZ),Chlorophyll Meter SPAD-502叶绿素计(日本KONICA MINOLTA公司)。
1.3 测定方法
供试桑叶平铺沿主叶脉两侧对称划分成A、B、C、D、E、F 6个区域(图1)。
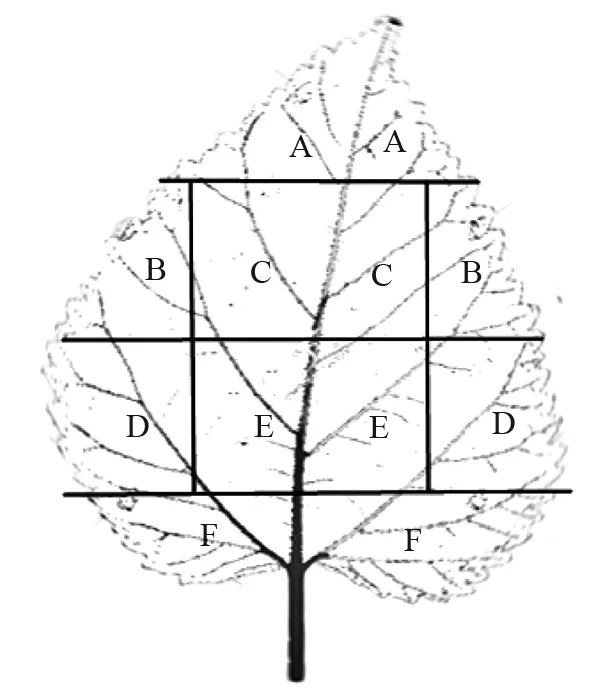
图1 桑树叶片的叶绿素检测区域划分示意图
将供试桑叶置于黑暗条件下暗适应20 min以上,参照文献[42]的方法,利用超便携式调制叶绿素荧光仪进行叶绿素荧光诱导曲线测定,每个测量分区测定3个位点,获得其叶绿素荧光参数Fv/Fm(最大光合效率)、Y(II)(实际光能转换效率)、qL(光化学淬灭系数)、NPQ(非光化学淬灭系数)等数据,取平均值作为该区的Fv/Fm、Y(II)、qL、NPQ值;利用叶绿素计SPAD-502测定各分区的SPAD值,每个测量分区测定10个位点,取平均值作为该区的SPAD值。
1.4 数据分析
运用SPSS 25.0软件将供试桑叶分区与全叶、全叶与全叶之间的测定值进行T检验方差分析,并对分区进行聚类分析,明确桑叶叶绿素荧光参数之间以及其与SPAD值之间的关系,确定桑叶测定叶绿素荧光参数与SPAD值的最佳成熟度和叶片区域。
2 结果与分析
2.1 不同成熟度桑叶分区测定的叶绿素荧光参数及方差分析
2.1.1 叶绿素荧光参数Fv/Fm
Fv/Fm代表被检测桑叶的潜在最大光能转换效率,是研究光抑制或环境胁迫对光合作用影响的重要指标。测定及分析结果见表1。
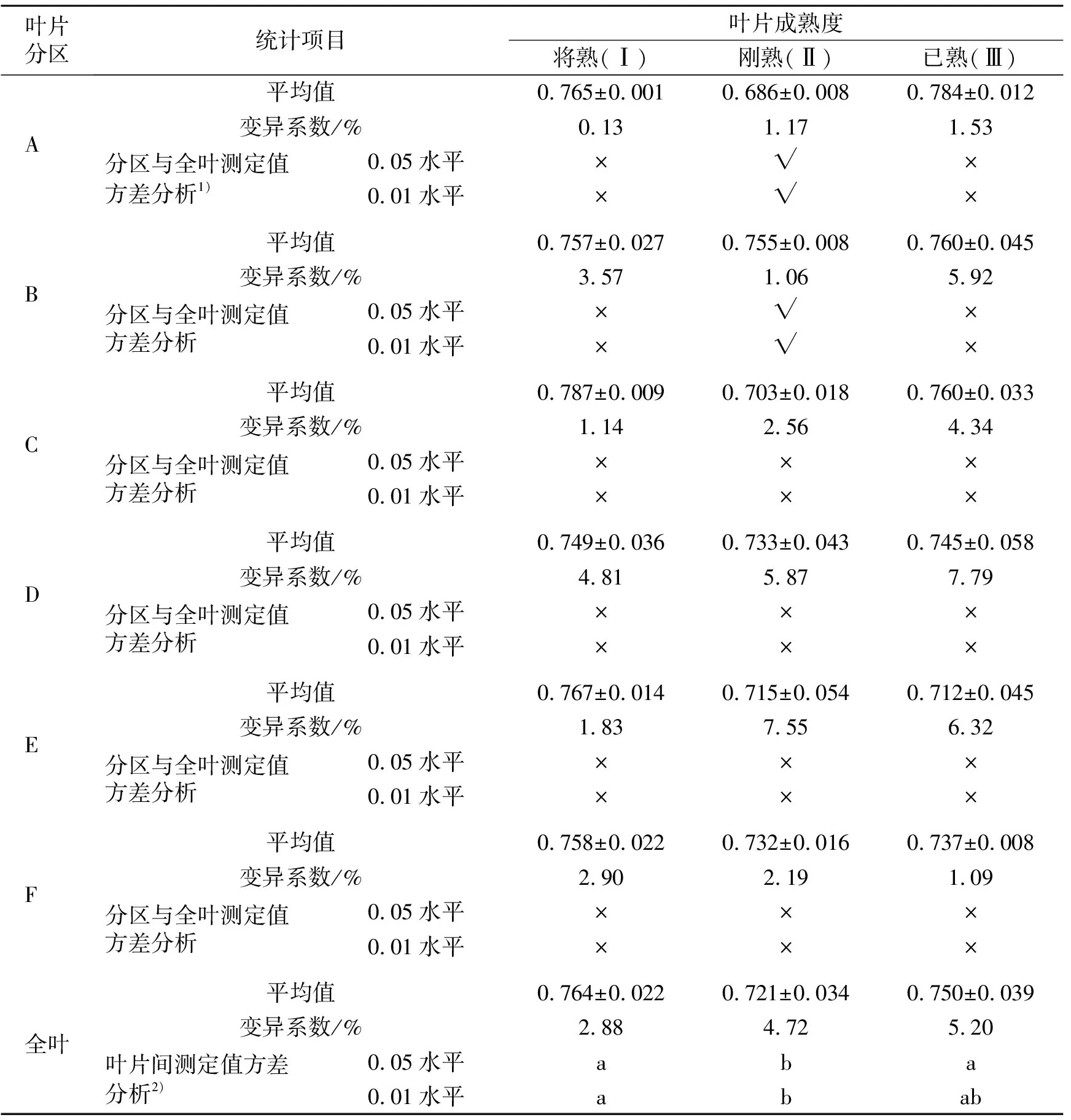
表1 不同成熟度桑叶分区测定叶绿素荧光参数Fv/Fm的数据统计分析
从表1可见,供试桑树叶片Ⅰ、Ⅱ、Ⅲ各分区除了叶片Ⅱ的A区Fv/Fm为0.686以外,其余均达到0.700以上,分布区间为0.703~0.787,均略低于健康植物叶片的Fv/Fm正常范围;叶片全叶的Fv/Fm从大到小依次排序为叶片Ⅰ、叶片Ⅲ、叶片Ⅱ,将成熟叶片Ⅰ的Fv/Fm最高,和Ⅲ没有显著差异,刚成熟叶片Ⅱ的Fv/Fm极显著低于叶片Ⅰ、显著低于叶片Ⅲ。
分析认为:叶片Ⅰ即将进入成熟状态,叶细胞的生长、分化全部处于活跃期,叶片的最大光合效率达到一个高峰期,且各分区与全叶差别不显著;叶片Ⅱ处于刚成熟状态,细胞为了使叶片达到成熟状态,刚经历了一段活跃生长发育期,耗费了较多的光合底物和能量,尚未来得及通过光合作用进行补充、积累,因此最大光合效率处于最低位;叶片Ⅰ各分区细胞成熟时间稍有不同,分区间Fv/Fm存在不同程度的差异,C、D、E、F区与全叶没有显著差异,但是A区则极显著低于全叶,B区极显著高于全叶;叶片Ⅲ的细胞成熟度较高且稳定,可能通过光合作用补充、积累了一定的光合底物和能量,使其光合效率得到恢复并达到相对稳定的状态,分区间差距逐渐变小,各分区与全叶的差异未达到显著水平。
将供试叶片Ⅰ、Ⅱ、Ⅲ6个区的Fv/Fm测定值以分区为变量进行聚类分析,结果见图2。若将6个区分为2大类,一类包括A区和B区,另一类包括C、D、E、F 4个区;如果分为3大类,一类包括A区和B区,第2类包括C区和D区,第3类包括E区和F区。据此可推测位置相邻的A区和B区、C区和D区、E区和F区,二者间的Fv/Fm相关性较强,桑叶各分区的Fv/Fm分布具有明显的规律性。
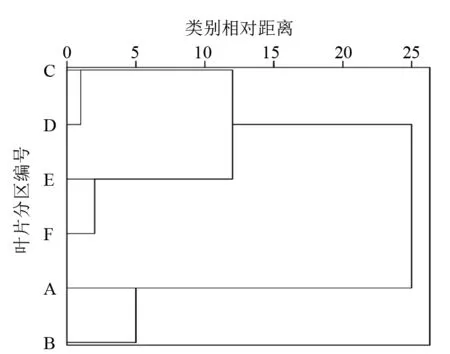
图2 桑叶各分区基于叶绿素荧光参数Fv/Fm的聚类分析树形图
2.1.2 叶绿素荧光参数Y(Ⅱ)
桑叶的实际光能转换效率用Y(Ⅱ)指标来表示,反映了桑叶在当时稳定态下的实际光合能力,测定结果见表2。供试叶片Ⅰ、Ⅱ、Ⅲ的全叶叶绿素荧光参数Y(Ⅱ)值不存在显著水平差异。全叶的变异系数叶片Ⅰ最小,为4.87%,说明全叶数据较为集中;叶片Ⅱ则达到11.00%,全叶数据分散范围最大;叶片Ⅲ为7.28%,全叶数据分散度居中。分区与全叶的Y(Ⅱ)进行比较,除了叶片Ⅰ的C区和叶片Ⅲ的A、E区与全叶相比,存在极显著差异外,其余分区与全叶均不存在显著差异。
将供试桑叶Ⅰ、Ⅱ、Ⅲ6个区的Y(Ⅱ)测定值以分区为变量进行聚类分析,结果见图3。若将6个区分为2大类,一类包括B区和D区,另一类包括A、C、E、F 4个区;如果分为3大类,一类包括B区和D区,第2类包括C、E、F区,第3类只包括A区。据此可推测位置相邻的B区和D区、E区和F区的Y(Ⅱ)相关性最强,位置稍远的C、E、F区的Y(Ⅱ)相关性较强,A区位于离其他分区位置较远的叶尖末端,Y(Ⅱ)相关性最弱。上述聚类分析结果显示叶片的Y(Ⅱ)分布具有一定的规律性。
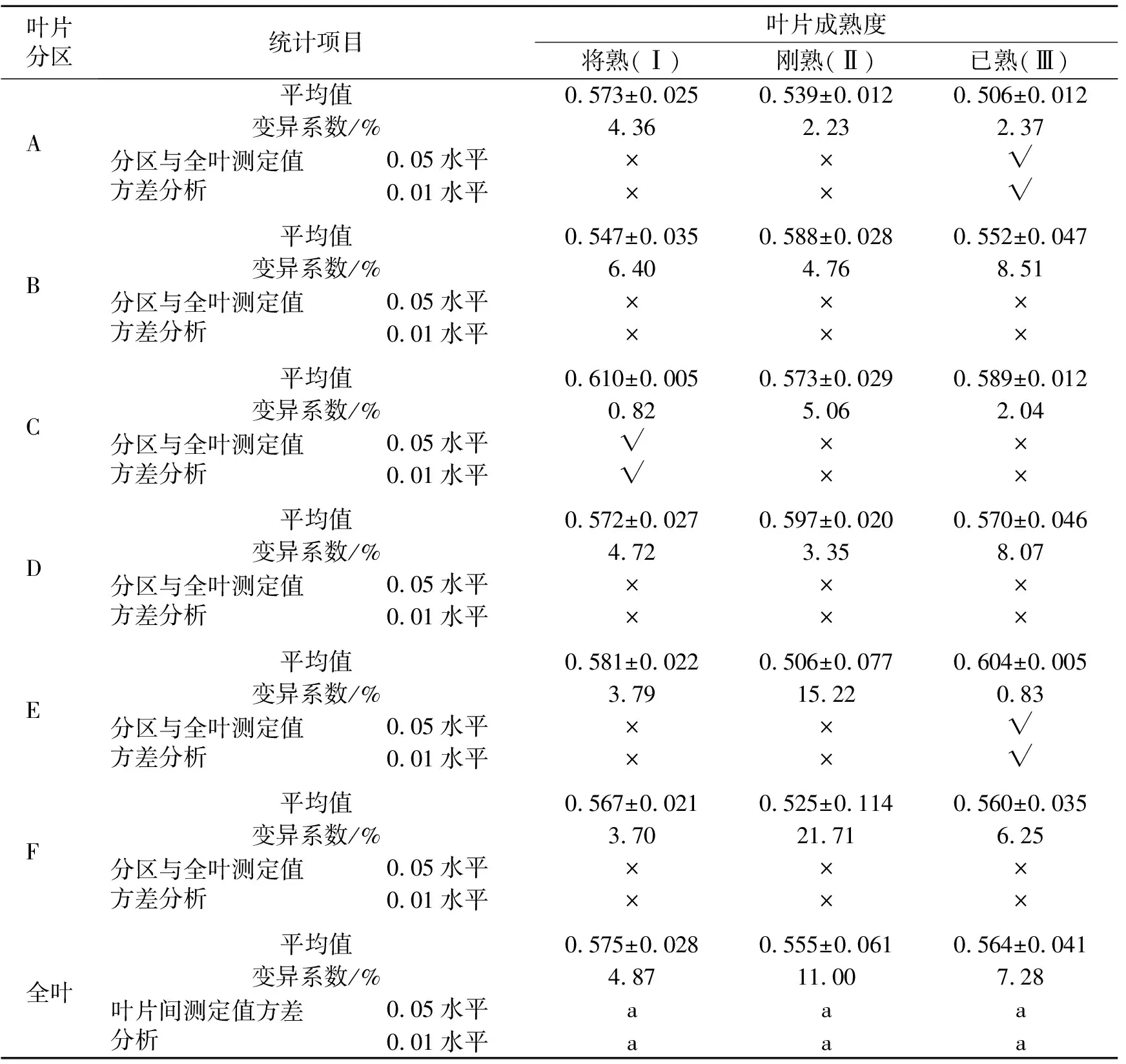
表2 不同成熟度桑叶分区测定叶绿素荧光参数Y(Ⅱ)的数据统计分析
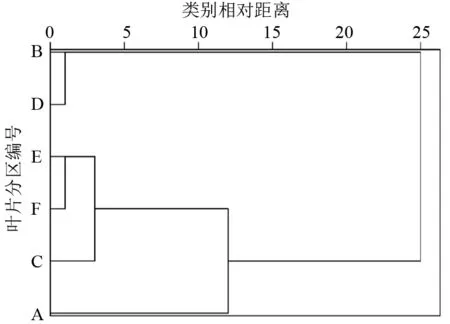
图3 桑叶各分区基于叶绿素荧光参数Y(Ⅱ) 的聚类分析树形图
2.1.3 叶绿素荧光参数qL
qL是桑叶的光化学淬灭指标之一,光化学淬灭是指由光合作用引起的荧光淬灭,反映了桑叶光合活性的高低,测定结果见表3。供试叶片Ⅰ、Ⅱ、Ⅲ的全叶叶绿素荧光参数qL不存在显著水平差异,叶片Ⅰ、Ⅱ、Ⅲ的全叶qL变异系数为12%~15%。叶片分区与全叶的qL进行比较,除了叶片Ⅰ的F区与全叶、叶片Ⅱ的D区与全叶存在显著差异、叶片Ⅱ的A区与全叶存在极显著差异外,其余分区与其全叶均不存在显著差异。
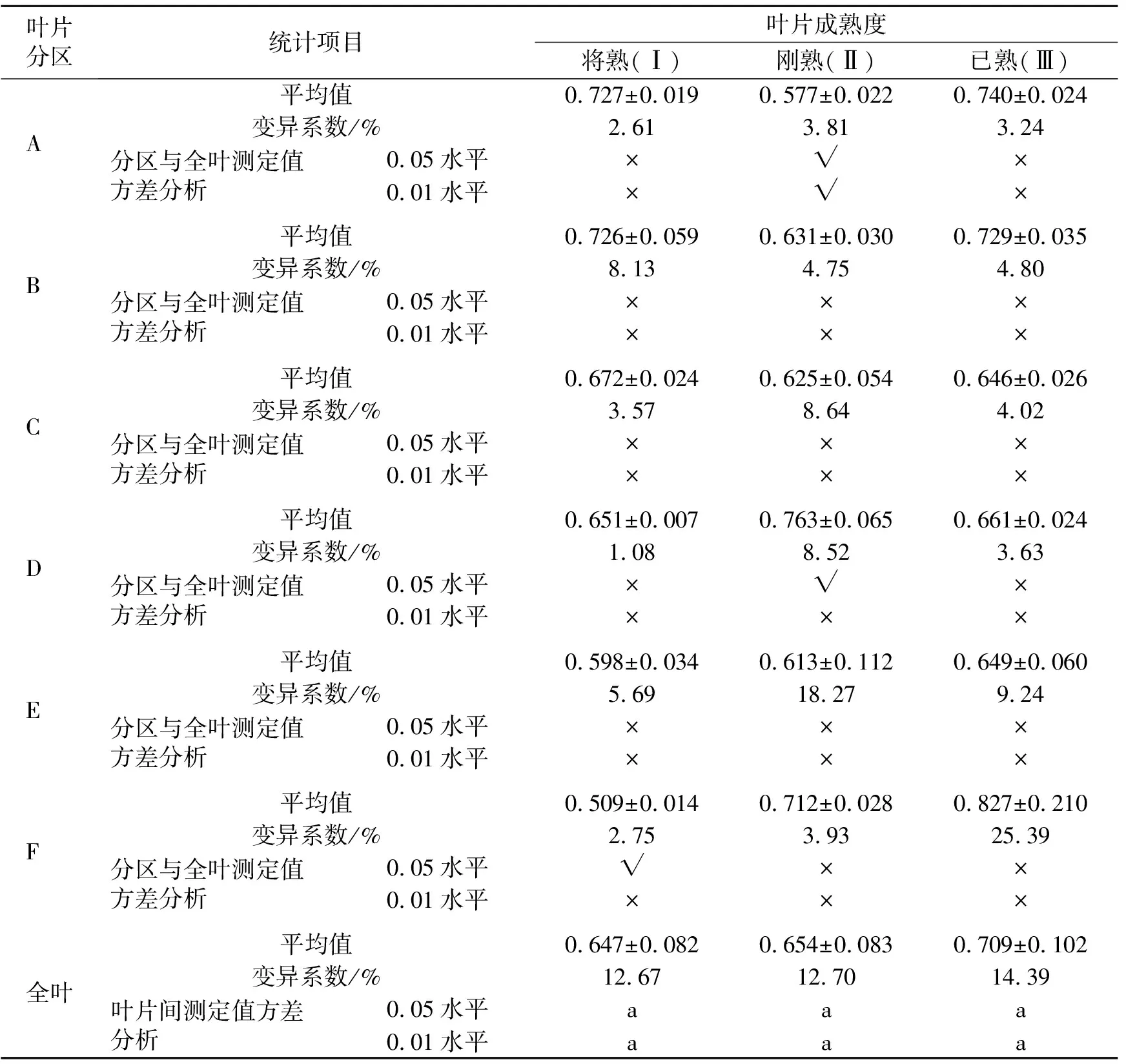
表3 不同成熟度桑叶分区测定叶绿素荧光参数qL的数据统计分析
将供试桑叶Ⅰ、Ⅱ、Ⅲ6个区的qL测定值以分区为变量进行聚类分析,结果见图4。若将6个区分为2大类,一类包括A、B、C区,另一类包括D、E、F区;如果分为3大类,一类包括A、B、C区,第2类包括E、F区,第3类只包括D区。由此推测位置相邻的A区和B区、E区和F区的qL相关性最强,位置稍远的A、B、C区的qL相关性较强,靠近叶柄成熟度较高的叶基部D、E、F区的qL相关性一般,叶尖端的A、B、C区与叶基部的D、E、F区之间的类间距离最远,qL相关性最弱。

图4 桑叶各分区基于叶绿素荧光参数qL的聚类分析树形图
2.1.4 叶绿素荧光参数NPQ
桑叶的光保护能力是其光合作用时耗散过剩光能转化为热能的能力,以非光化学淬灭(由热耗散引起的荧光淬灭)的指标来表示,NPQ就是其中之一。桑叶不同位置的NPQ测定结果见表4。
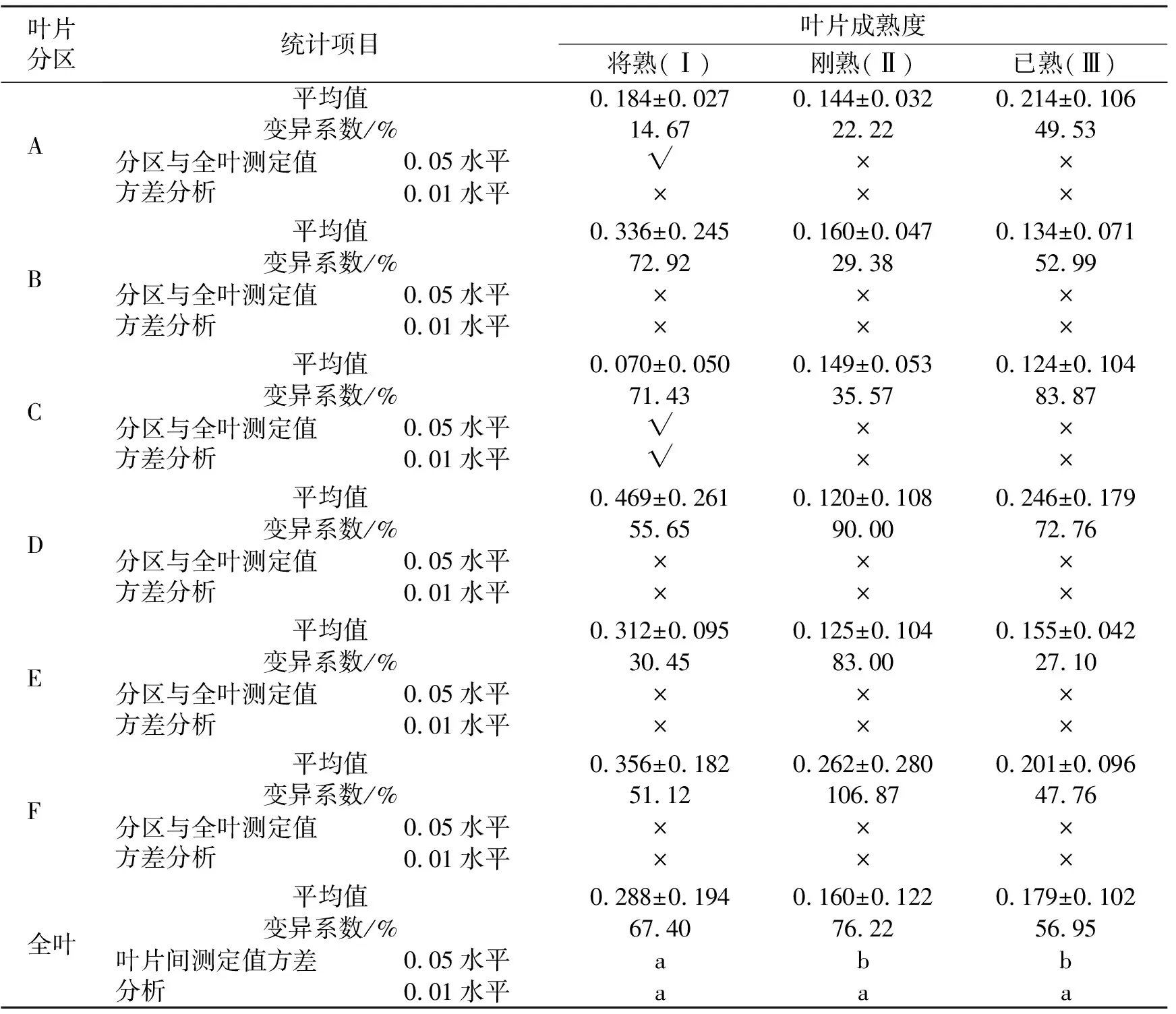
表4 不同成熟度桑叶分区测定叶绿素荧光参数NPQ的数据统计分析
由表4可见,供试桑叶的全叶NPQ从大到小依次排序为叶片Ⅰ、叶片Ⅲ、叶片Ⅱ,与全叶Fv/Fm相一致。将成熟叶片Ⅰ的NPQ显著高于叶片Ⅱ和Ⅲ,已成熟叶片Ⅲ略高于刚成熟叶片Ⅱ,但差异不显著。叶片Ⅰ、Ⅱ、Ⅲ的各分区NPQ变异系数为14.67%~106.87%,且有不少分区达50%以上,数据分布范围广、差异大,分散度太高,数据极不稳定。
将供试桑叶Ⅰ、Ⅱ、Ⅲ6个区的NPQ测定值以分区为变量进行聚类分析,结果见图5。若将6个区分为2大类,一类包括A、B、D、E、F区,另一类只包括C区;如果分为3大类,一类包括B、D、E、F区,第2类只包括A区,第3类只包括C区。推测位置相邻的D区和E区、位置较远的B区和F区的NPQ相关性最强,叶尖末端的A、C区与其他分区的NPQ相关性较弱,叶片的NPQ分布规律性较差。
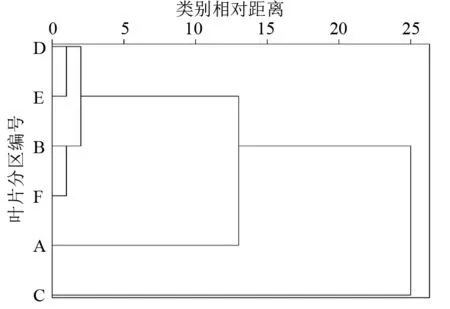
图5 桑叶各分区基于叶绿素荧光参数NPQ的聚类分析树形图
2.2 不同成熟度桑叶分区测定的SPAD值及方差分析
SPAD值可判断作物的光合状况和生理损伤现状[43]。桑叶不同位置的SPAD值测定结果见表5。
供试桑叶的全叶SPAD值从大到小依次排序为叶片Ⅲ、Ⅱ、Ⅰ,与叶片的成熟度一致。在3份供试叶片中,叶片Ⅲ的SPAD值极显著高于叶片Ⅰ和Ⅱ,而叶片Ⅰ和Ⅱ间的差异不显著;叶片Ⅰ、Ⅱ、Ⅲ的全叶SPAD值变异系数为4.19%~6.41%,数值较低,数据整体较集中。叶片Ⅰ各分区的SPAD值为35.267~40.467,最高的是A区,其次是C区,最低的是F区;叶片Ⅱ各分区的SPAD值为36.867~40.067,最高的是E区,其次是C区,最低的也是F区;叶片Ⅲ各分区的SPAD值为37.700~44.867,最高的是A区,其次是C区,最低的也是F区。总的来说,靠近叶尖部的分区SPAD值高于靠近叶基部的分区,基本上表现为叶尖端A区最高,叶基部F区最低。
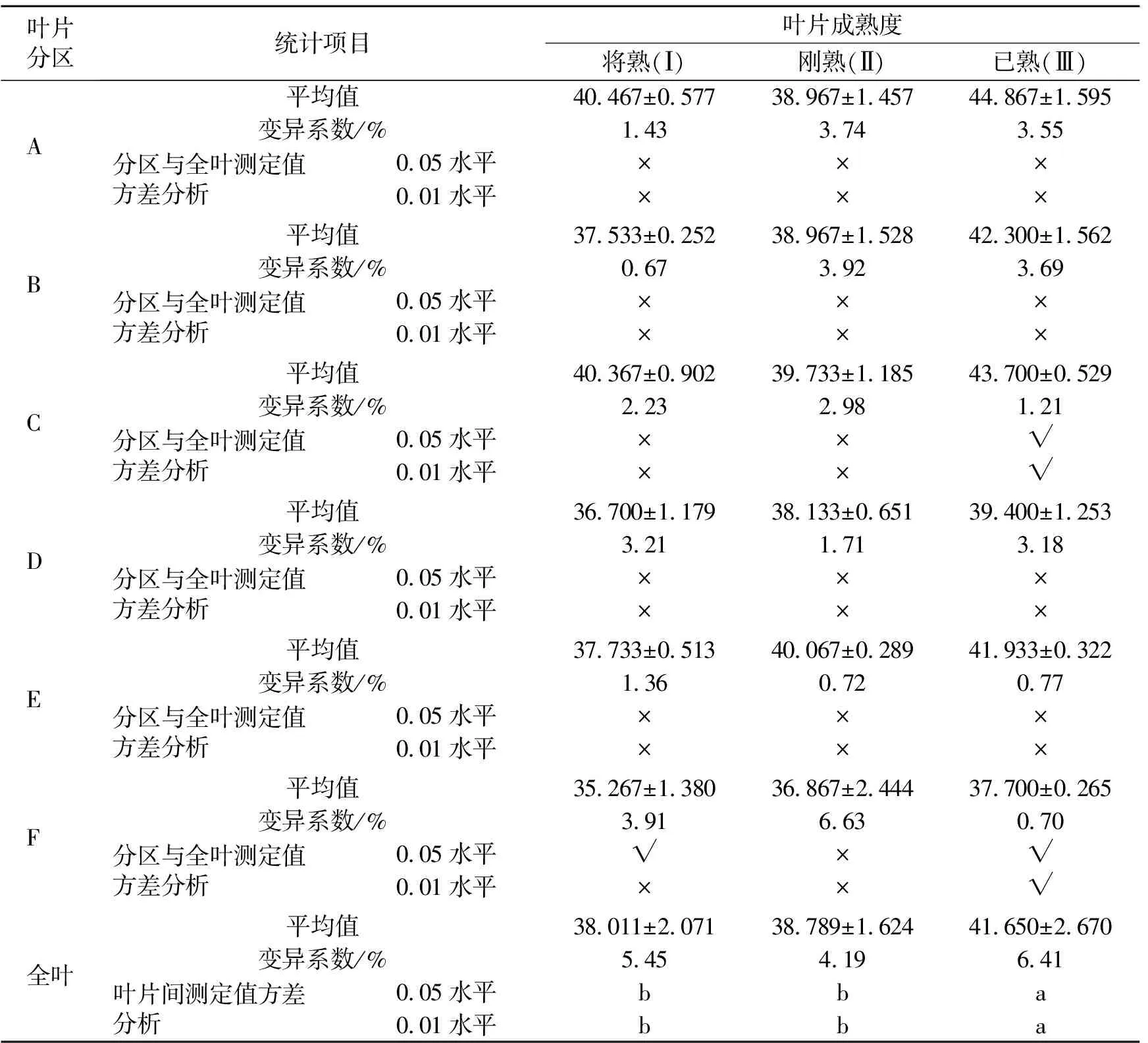
表5 不同成熟度桑叶分区测定SPAD值的数据统计分析
将供试桑叶Ⅰ、Ⅱ、Ⅲ 6个区的SPAD测定值以分区为变量进行聚类分析,结果见图6。若将6个区分为2大类,一类包括A、C区,另一类包括B、D、E、F区;如果分为3大类,一类包括A、C区,第2类只包括B区,第3类包括D、E、F区。推测位于叶尖端的A、C区之间以及位于叶基部相邻的D、E、F区之间的SPAD值相关性最强,B区与D、E、F区的SPAD值相关性次之,A、C区与B、D、E、F区之间SPAD值相关性较弱,叶片SPAD值分布的规律性较明显。
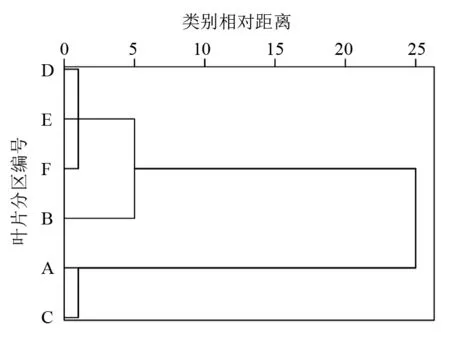
图6 桑叶各分区基于SPAD值的聚类分析树形图
2.3 不同成熟度桑叶分区测定SPAD值与叶绿素荧光参数的综合分析
2.3.1 SPAD值与叶绿素荧光参数间的聚类分析
基于供试桑叶Ⅰ、Ⅱ、Ⅲ全叶的SPAD值和叶绿素荧光参数Fv/Fm、Y(Ⅱ)、qL、NPQ测定值(表1~5),利用SPSS 25.0软件进行指标之间的聚类分析,结果表明若将全叶的SPAD值、Fv/Fm、Y(Ⅱ)、qL、NPQ 5项指标划分为2大类,一类包括了SPAD值、qL,另一类包括了Fv/Fm、Y(Ⅱ)、NPQ;如果将以上5项指标划分为3类,一类包括SPAD值、qL,第2类包括了Fv/Fm、Y(Ⅱ),第3类只包括NPQ(图略)。
由于供试桑叶Ⅰ、Ⅱ、Ⅲ的叶绿素荧光参数NPQ的变异系数分布范围广,分散度高,数据极不稳定,故剔除NPQ指标后对全叶的SPAD值、Fv/Fm、Y(Ⅱ)、qL 4项指标再次进行指标间的聚类分析,结果见图7。4项指标聚类分为2大类,一类包括SPAD值、qL,另一类包括Fv/Fm、Y(Ⅱ),同一类2个指标间的相关性较强,而2大类之间的分类距离较远,相关性较弱。
综上所述,桑叶的SPAD值与叶绿素荧光参数qL之间的关系密切,说明桑叶光合活性的高低(qL)与叶绿素相对含量(SPAD值)有较强的相关性。同样,叶绿素荧光参数Fv/Fm、Y(Ⅱ)之间关系密切,表明桑叶的最大光合效率(Fv/Fm)与实际光能转换效率[Y(Ⅱ)]之间存在着较强的相关性。Fv/Fm、Y(Ⅱ)与NPQ存在着一定的相关性,说明桑叶的光保护能力(NPQ)受到光合效率的影响。
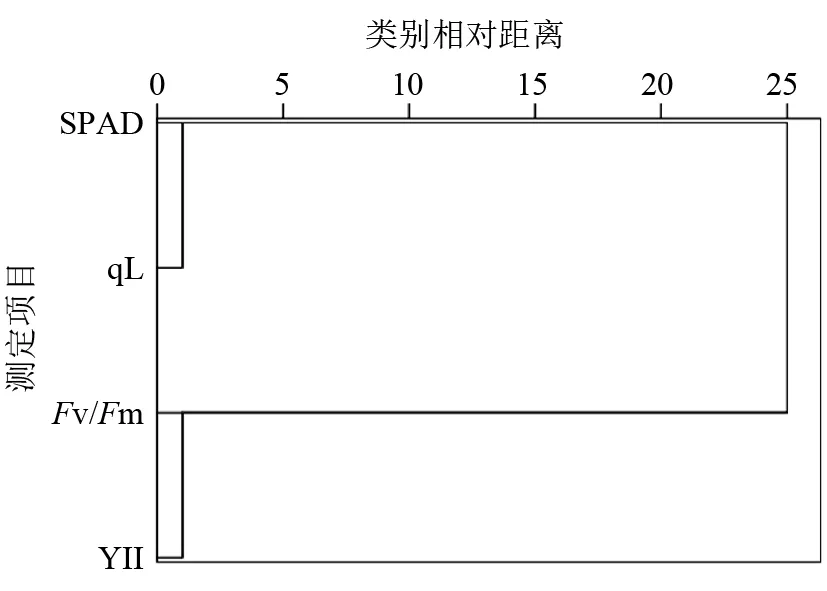
图7 桑叶叶绿素基于测定的4项指标数据的聚类分析树形图
2.3.2 叶绿素荧光参数与SPAD值测定的最佳叶片位置
将桑叶的A、B、C、D、E、F 6个分区分为2大类,每一类中若选择1个或2个具有代表性的分区进行桑叶叶绿素荧光参数的测定,则能简化测定程序,减少工作量。综合以上聚类分析结果(图2~5),若将桑叶的6个分区分为2大类(表6),则4项叶绿素检测指标的第1类分区都有B区,即选择B区测定能代表4项指标的第1类;第2类分区中4项指标没有同时分布有同一个分区,但是其中有3项指标均有C区,有3项指标均有E区,选择C、E 2个分区能代表4项指标的第2类。因此,测定桑叶叶绿素荧光参数的最佳测定位置应该为叶片的B+C+E区域。

表6 桑叶不同分区叶绿素荧光参数测定值的聚类分析结果统计
结合“2.2”节的聚类分析结果(图6)可知,B+C+E区域不仅是桑叶测定叶绿素荧光参数的最佳测定位置,同时也是测定SPAD值的最佳位置,即桑叶中部主叶脉两侧区域(C、E区)和桑叶中后部叶缘附近区域(B区)是测定叶绿素荧光参数与SPAD值的最佳分区位置。
3 讨论
3.1 桑叶的光合效率
绝大多数高等植物在健康生理状态下,叶片的最大光合效率指标Fv/Fm的检测值为0.800~0.850,若Fv/Fm检测值偏小,表示被测植物可能处于光抑制生长状态或遭受某种环境胁迫[42]。本实验测定供试桑叶Ⅰ、Ⅱ、Ⅲ的全叶叶绿素荧光参数Fv/Fm分别为0.764、0.721、0.750,与最佳的Fv/Fm之间存在一定距离;测定Y(Ⅱ)分别为0.575、0.555、0.564,同一供试桑叶的光系统最大光合效率Fv/Fm均明显大于其实际光合效率Y(Ⅱ),即实际光合效率值离潜在最大光合效率还有一定的差距,桑叶的光合能力仍有较大的提升空间。
分析原因,可能是供试桑树移栽于花盆的时间较短,生长发育还没有达到最佳状态,并且受到花盆中的基质面积和体积限制,水肥管理欠佳,导致植株本身的生长受限,同时也可能受到测定当天的光强、温度等因素综合影响[44],因此桑叶的光合效率未达到最理想的状态。
3.2 桑叶叶绿素荧光检测的叶片成熟度及测定区域选择
在3份桑叶材料中,将成熟叶片Ⅰ的Fv/Fm最高,其次为已成熟叶片Ⅲ,刚成熟叶片Ⅱ的Fv/Fm最低。而桑叶的最大光合效率(Fv/Fm)与实际光能转换效率[Y(Ⅱ)]之间关系密切;Fv/Fm、Y(Ⅱ)与NPQ存在一定的相关性,桑叶的光保护能力(NPQ)受光合效率的影响。桑叶成熟度不同,6个测定分区的叶绿素荧光参数分布也不相同。因此,今后如果需要用叶绿素荧光测定方法检测桑树全株叶片时,选择光合效率达到较高水平且状态稳定的成熟叶片,即叶色饱满、叶位偏中下部的成熟叶片(例如叶片Ⅲ)最具代表性。桑叶同时测定叶绿素荧光参数与SPAD值时,其最佳测定位置为B+C+E区域,即桑叶中部主叶脉两侧区域(C、E区)和桑叶中后部叶缘附近区域(B区)。
综上,叶色饱满、叶位偏中下部的成熟叶片是检测桑树植株叶绿素的最佳材料,具体测定位置应选择叶片中部主叶脉两侧区域和中后部叶缘附近区域为宜,检测位点也应尽量避开各级叶脉。
3.3 今后研究的方向
本研究只是以1个桑树品种供试,即只是以1种叶形(全叶)及3个具代表性的叶位(桑叶成熟度分界明显)取材供试,而我国的桑树种质资源非常丰富,桑叶的叶形也有全叶、裂叶与全裂混生叶等多种类型[45],因此,今后将以更多品种及叶形、叶位的桑叶作为检测材料,从而建立起更加科学、完善、高效的桑叶叶绿素荧光分析技术与叶绿素计测量方法。
本研究表明桑叶的SPAD值与叶绿素荧光参数qL之间关系密切,桑叶光合活性的高低(qL)与叶绿素含量(SPAD值)有较强的相关性。邱长玉等[41]研究发现,桑叶的SPAD值与其作为养蚕饲料收获蚕茧的各项指标之间具有显著的相关关系,桑叶SPAD值不仅可用于桑叶品质评价,而且可作为优良桑品种选育的参考指标。因此,今后可深入开展不同桑品种桑叶叶绿素荧光参数与SPAD值的相关性研究,探索二者在桑叶叶质鉴定、桑园施肥指导等方面的应用,以及二者与桑叶养蚕成绩的关联度等,为桑园生产管理和桑树优良品种选育提供新的试验技术与方法支持。

