不同溶解氧水平对鳜呼吸代谢酶及其基因表达量的影响
宋银都,曾萌冬,周昊天,周云红,张成硕,赵金良
( 上海海洋大学,农业农村部淡水水产种质资源重点试验室,水产动物遗传育种中心上海市协同创新中心,水产科学国家级试验教学示范中心,上海 201306 )
养殖池塘溶解氧主要来源于浮游生物光合作用[1]。由于光合作用的周期循环,当池塘生物体(如细菌、动物和植物)的耗氧率超过浮游植物光合产氧率时,池塘的溶解氧开始消耗[2]。夜晚池塘溶解氧水平随时间的推移而逐渐降低,达到一定溶解氧水平时鱼类面临低氧胁迫[3-4]。在实际的养殖中,水体缺氧是一个动态的过程。目前低氧对鱼类呼吸代谢的研究一般停留在特定溶解氧条件下的耐受性研究,如黄颡鱼(Pelteobagrusfulvidraco)在溶解氧水平0.7 mg/L下胁迫6.5 h[5],大口黑鲈(Micropterussalmoides)分别在溶解氧水平3.5 mg/L、1.2 mg/L下胁迫24 h[6],大黄鱼(Larimichthyscrocea)在溶解氧水平1.5 mg/L下胁迫48 h[7]。试验中呼吸代谢的变化与低氧持续时间和设置的低氧水平有关,静态试验设计很难反映现实养殖过程中的动态变化[8]。
鳜(Sinipercachuatsi)是我国重要淡水经济鱼类,喜欢在昏暗的环境下捕食[9-10],夜间高强度活动,加大了池塘溶解氧的消耗。且鳜夜间耗氧率大于白天[11],鳜窒息点为0.56~0.75 mg/L[11-13],与常规养殖鱼类相比窒息点较高,如鲫(Carassiusauratus)为0.1 mg/L[14],鲢(Hypophthalmichthysmolitrix)为0.51 mg/L,鳙(Aristichthysnobilis)为0.46 mg/L,草鱼(Ctenopharyngodonidellus)为0.39 mg/L[12]。因此,在夜间池塘溶解氧变化过程中鳜发生低氧的可能性会增加。笔者在溶解氧水平持续下降的过程中测定不同溶解氧含量下鳜呼吸代谢相关酶[乳酸脱氢酶(LDH)活性、丙酮酸脱氢酶(PDH)]活性变化及相关基因(LDH-A、PDH-E1α)的表达量,旨在进一步探讨低氧条件下鳜进行有氧呼吸、无氧呼吸的作用机理。
1 材料与方法
1.1 试验用鱼
试验鱼来自安徽省滁州市长江水产良种场。体质量(10.2±2.2) g、体长(9.5±1.0) cm。在试验室内水族箱暂养7 d以适应环境,投喂体质量(0.40±0.06) g,体长(2.8±0.2) cm的草鱼鱼苗。每日早晚各投喂1次,投喂量为鱼体质量的5%。
1.2 试验设计及样品采集
试验前24 h停止投喂,尽量排空粪便并吸出。试验在硅胶密闭的塑料箱(55 cm×40 cm×31.5 cm,试验水体为55 L)中进行,试验前将塑料箱注水倒置,不渗水则表示密封性好。试验设置5个处理组,溶解氧质量浓度分别为5、4、3、2、1 mg/L,每组3个平行,每个箱内随机放入10尾鱼,共计150尾。试验用水为充分曝气的自来水,水温(25.3±0.2) ℃,溶解氧质量浓度为(7.36±0.52) mg/L。本试验采用静态呼吸室法,通过试验鱼呼吸作用逐渐消耗水中氧气,每隔30 min测量箱中的溶解氧质量浓度,试验持续时间为12 h,整个试验过程中鳜行为正常且无死鱼;试验所用仪器为梅特勒托利特公司 S9 Seven2GoTMpro便携式溶解氧仪(饱和空气校正)。
当5 mg/L处理组箱中溶解氧降至该水平时立即停止试验,每箱随机取出3尾共9尾用1%间氨基苯甲酸乙酯甲磺酸盐麻醉后,立即解剖,采集心脏、脑、肝脏、肌肉组织,并用液氮迅速冷冻,放入-80 ℃保存。当4、3、2、1 mg/L处理组箱中溶解氧水平降至该质量浓度时用相同方法采集样品。
1.3 耗氧率计算
试验过程中计算每个溶解氧水平的耗氧率[R,mg/(g·h)]。
式中,ρ0、ρ1为试验前后水体的溶解氧质量浓度(mg/L),V为水体体积(L),t为试验持续时间(h),m为鱼体总质量(g)。
1.4 生化指标测定
取试验鱼心脏、脑、肝脏和肌肉组织,用预冷的磷酸缓冲盐溶液(0.01 mol/L,pH 7.4)冲洗组织,去除残留黏液,取适量组织按1∶9质量比加入磷酸缓冲盐溶液,各组织冰浴匀浆5 min,4 ℃下2000 r/min(离心半径8.86 cm)冷冻离心20 min,取离心上清液用于生化测定。丙酮酸脱氢酶、乳酸脱氢酶活性和乳酸含量采用酶标仪(Synergy H1,BioTek)测定,试剂盒购自上海酶联生物科技公司,按照试剂盒说明书检测方法操作。
1.5 实时荧光定量PCR
用Trizol法提取各组织总RNA,用1%的琼脂糖凝胶电泳检测RNA的完整性,用OD-1000+分光光度计(Onedrop)检测RNA浓度和纯度。测定RNA在260 nm和280 nm的吸光度[D(260 nm)、D(280 nm)],取D(260 nm)/D(280 nm)为1.9~2.1的样本,用反转录试剂盒(PrimeScript RT reagent Kit With gDNA Eraser,TaKaRa)将RNA反转录为cDNA,-20 ℃保存。
根据本实验室鳜转录组数据,用Primer Express 5.0 软件设计LDH-A、PDH-E1α引物序列,引物由金维智(苏州)生物科技有限公司合成。
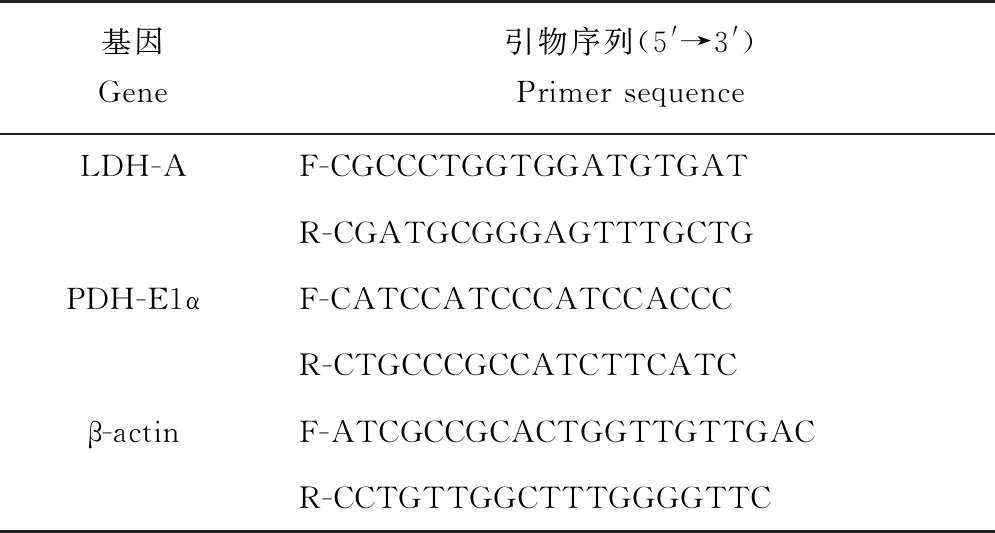
表1 呼吸代谢相关基因的引物序列
根据所设计的引物,以β-actin为内参基因进行荧光定量PCR。反应体系为20 μL:TB Green Premix Tap Ⅱ 10 μL;正、反引物各0.8 μL;cDNA模板1.6 μL;无菌水6.8 μL。反应程序:95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,40个循环;95 ℃ 10 s,65 ℃ 5 s。以β-actin为内参,用2-△△Ct计算不同溶解氧水平下各组织mRNA的相对表达量。
1.6 数据分析
试验数据结果均使用平均值±标准差表示,数据分析用SPSS 18.0软件进行单因素方差分析,用GraphPad Prism 8.01作图。
2 结 果
2.1 不同溶解氧水平下呼吸代谢酶活性及基因的表达水平
2.1.1 呼吸代谢酶活性及乳酸变化
随着溶解氧水平的降低,鳜心脏、脑、肝脏、肌肉组织中丙酮酸脱氢酶活性呈下降趋势(图1)。其中,心脏和脑组织中丙酮酸脱氢酶活性在溶解氧下降期间无显著变化(P>0.05),溶解氧质量浓度为1 mg/L时,组织中丙酮酸脱氢酶活性相较于5 mg/L时分别下降3.06%、5.82%;溶解氧3 mg/L时,肝脏和肌肉中丙酮酸脱氢酶活性显著下降(P<0.05),分别下降12.92%、23.44%,1 mg/L时肝脏和肌肉中丙酮酸脱氢酶活性最低,分别下降21.73%、28.79%(P<0.01)。
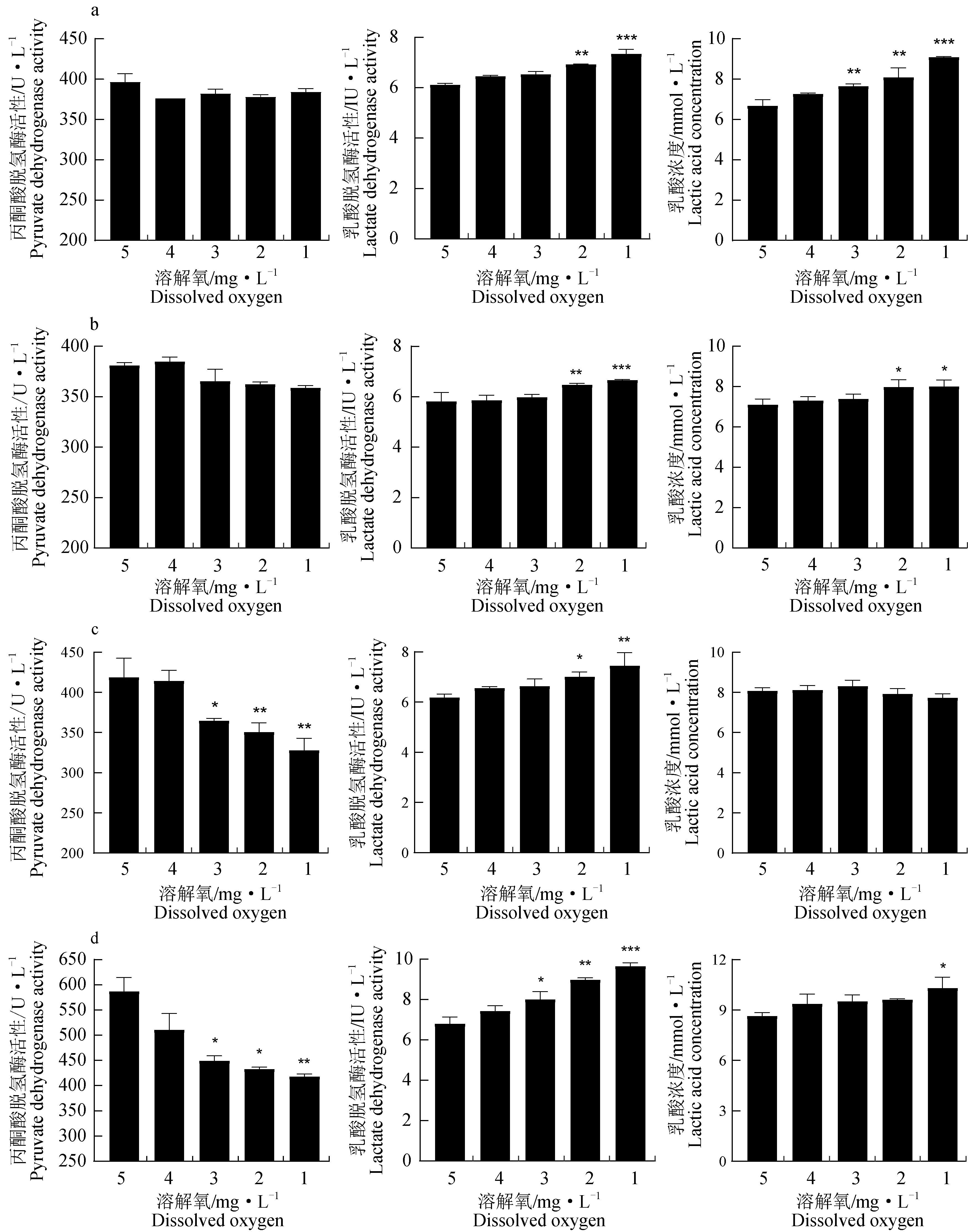
图1 不同溶解氧水平下鳜心脏(a)、脑(b)、肝脏(c)、肌肉(d)呼吸代谢酶活性和乳酸含量的变化
心脏、脑、肝脏、肌肉中乳酸脱氢酶活性随溶解氧下降而上升,肌肉中乳酸脱氢酶活性在溶解氧质量浓度为3 mg/L时上升13.23%(P<0.05),心脏、脑、肝脏在2 mg/L时分别上升14.43%、20.19%、17.65%(P<0.01)。各组织活性在溶解氧为1 mg/L时最高(P<0.01)。
心脏、脑和肌肉乳酸浓度随溶解氧下降而逐渐上升,溶解氧质量浓度为1 mg/L时,乳酸浓度达最高值(P<0.05),而肝脏中乳酸浓度无显著变化(P>0.05)。
2.1.2 呼吸代谢酶基因的表达水平
随着溶解氧水平降低,各组织中的PDH-E1α基因相对表达量均呈下降趋势(图2),心脏中的相对表达量无显著变化(P>0.05),脑和肌肉中的相对表达量在溶解氧质量浓度为3 mg/L时变化显著(P<0.001),肝脏中的PDH-E1α基因相对表达量在2 mg/L时显著下降(P<0.05)。脑和肝脏中的PDH-E1α基因相对表达量在溶解氧2 mg/L时降至最低,肌肉中的相对表达量在溶解氧1 mg/L时降至最低,分别为5 mg/L组的44.70%、56.58%、62.49%。
各组织中的LDH-A基因相对表达量呈上升趋势,溶解氧质量浓度为3 mg/L时,心脏、肝脏和肌肉中的LDH-A基因相对表达量有显著变化(P<0.01);溶解氧质量浓度为1 mg/L时,心脏、脑、肝脏、肌肉中的LDH-A基因相对表达量较高,分别为5 mg/L时的12.68、1.33、10.97、8.37倍。
2.2 不同溶解氧水平下鳜耗氧率变化
随着溶解氧质量浓度的下降,鳜耗氧率表现为逐渐下降趋势(表2)。溶解氧质量浓度降至3 mg/L时耗氧率与5 mg/L时相比减少30.95%(P<0.01);溶解氧继续降至1 mg/L时耗氧率减少57.14%(P<0.001)。
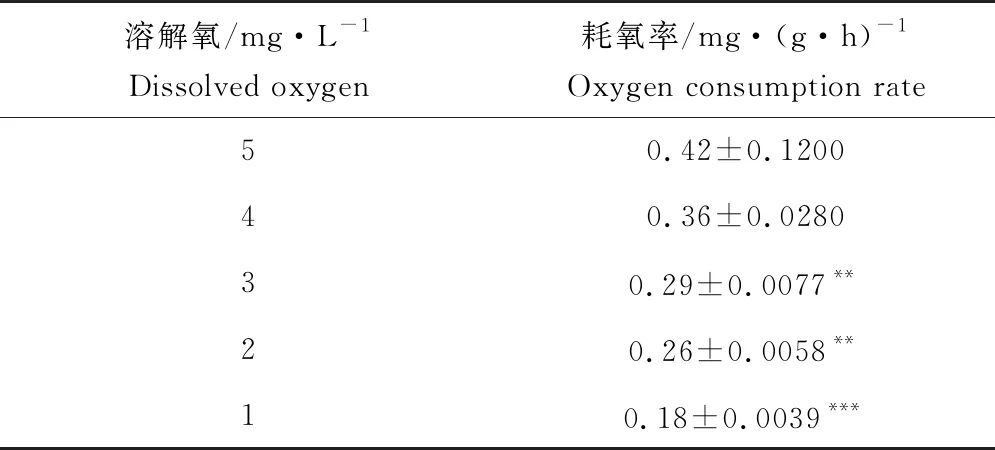
表2 不同溶解氧水平下鳜的耗氧率
3 讨 论
3.1 不同溶解氧水平对鳜呼吸代谢酶及基因相对表达量的影响
机体从有氧呼吸到无氧呼吸的转变是鱼类低氧耐受的关键适应机制[15-16],通常,丙酮酸进入线粒体,经丙酮酸脱氢酶复合体后才能进行有氧呼吸,其中,丙酮酸脱氢酶是丙酮酸脱氢酶复合体中的主要成员[17],是机体有氧呼吸关键酶之一,所以丙酮酸脱氢酶活性的下降标志着机体有氧呼吸的减少[18]。乳酸脱氢酶是无氧呼吸的关键酶,其活性变化可以反映无氧呼吸的水平,乳酸为无氧呼吸的产物[19]。
本试验中,设置的溶解氧最低质量浓度为1 mg/L,接近于鳜窒息点0.66~0.75 mg/L[11-13]。从正常溶解氧质量浓度降至1 mg/L过程中,丙酮酸脱氢酶活性逐渐下降,而乳酸脱氢酶活性逐渐上升,呼吸代谢酶基因相对表达水平与之类似,同时无氧呼吸产物乳酸的浓度也逐渐上升。这些结果表明,从常氧水平降至低氧水平的过程中,鳜根据环境溶解氧水平变化增加无氧呼吸,抑制有氧呼吸,逐渐调整机体的呼吸代谢水平,呼吸方式由有氧呼吸为主过渡到以无氧呼吸为主。无氧代谢能快速提供能量,降低机体耗氧量,因此,呼吸方式的转变是鱼类面对缺氧环境,特别是急性低氧环境的适应机制。
在溶解氧质量浓度为3 mg/L时,肝脏和肌肉中的PDH-E1α和LDH-A基因相对表达水平有明显的上升和下降,同时丙酮酸脱氢酶活性较溶解氧质量浓度为5 mg/L时分别下降12.92%、23.44%,乳酸脱氢酶活性较5 mg/L时上升13.23%、17.65%。表明此溶解氧阶段对鳜呼吸代谢水平影响较大,在此溶解氧水平下,鳜可能已经处于低氧胁迫状态;肌肉中LDH-A mRNA水平及其酶活性的升高导致乳酸的积累,但肝脏中乳酸浓度一直处于稳定水平,这可能与肝脏中糖异生作用有关[20]。鳜心脏中的PDH-E1α基因表达相对稳定且丙酮酸脱氢酶活性在整个试验中仅下降了3.06%,而罗非鱼(Oreochromis)在低氧暴露4 h后心脏中丙酮酸脱氢酶活性下降30%~35%[21];同时心脏中的LDH-A基因相对表达水平和乳酸脱氢酶活性依然升高,表明鳜心脏中丙酮酸脱氢酶活性不受溶解氧水平的影响,有氧呼吸不变的同时又增强了无氧呼吸。在脑中,PDH-E1α基因的相对表达量显著下降,但丙酮酸脱氢酶活性仅下降5.82%。LDH-A基因相对表达量、乳酸脱氢酶活性和乳酸浓度相对稳定,这与Yang等[6]的结果相似,这可能由于脑为机体中枢神经器官,氧优先供应给这些关键的需氧组织,虽然鳜脑中有氧呼吸酶基因相对表达下降,但丙酮酸脱氢酶仍然有较高活性,维持有氧呼吸以避免无氧呼吸,规避大量的乳酸积累[22]。
3.2 不同溶解氧水平对鳜耗氧率的影响
溶解氧质量浓度在5 mg/L以上,有利于鱼的生长和提高饲料利用效率,随着溶解氧水平的下降,鱼呼吸和摄食活动也随之降低,低氧会对鱼的生理或代谢活动产生不利影响[23]。低氧通常指水体溶解氧质量浓度低于2 mg/L的现象,但由于耗氧率和窒息点因鱼种类而异,因此鱼类低氧含量不能定义为统一的数值。李泽健等[24]指出,当水体溶解氧水平高于某个临界值,水生生物的耗氧率不再随着溶解氧水平的下降而变化,该数值就可以作为判断该生物是否受到低氧胁迫的指标。中华绒鳌蟹(Eriocheirsinensis)[25]在20~35 ℃时的溶解氧临界值为1.92~3.47 mg/L,瓦氏黄颡鱼(Peltebagrusvachelli)[26]的为1.16 mg/L。也有其他学者将鱼类低氧水平定义为鱼类的行为或者生理变化受到显著影响时的溶解氧水平[27]。耗氧率既可反映生物的生理状态,又能体现生物体生理活动受环境条件的影响[28]。耗氧率的减少表明生物体已受到环境的影响[29-30]。本试验中每个阶段的耗氧率随溶解氧质量浓度的下降而降低,试验结果与呼吸代谢酶的结果相符,表明有氧呼吸酶与无氧呼吸酶的变化影响机体的耗氧率,水中溶解氧质量浓度下降时,鳜改变呼吸代谢类型减少耗氧率从而降低机体的需氧量。当溶解氧质量浓度降至3 mg/L时,鳜耗氧率显著降低,说明这一阶段鳜受溶解氧水平影响较大。
4 结 论
当水体溶解氧逐渐下降,鳜根据溶解氧质量浓度的变化抑制有氧呼吸酶,增加无氧呼吸酶,以调整机体呼吸方式来降低耗氧率。溶解氧质量浓度降至3 mg/L时,鳜呼吸代谢酶及相关基因的相对表达量有显著变化,对鳜呼吸代谢影响较大,表明此溶解氧质量浓度下鳜可能已受低氧胁迫。

