恩诺沙星诱导溶藻弧菌耐药和交叉耐药的研究
张 凯,张明明,谢 曦,王 蓉,胡文婷
( 1.海南大学 药学院,热带生物资源教育部重点实验室,海南 海口 570228; 2.康芝药业股份有限公司,海南 海口 570311 )
溶藻弧菌(Vibrioalginolyticus)数量居海水类弧菌之首,是海洋环境中和海洋动物体内的正常菌群[1]。然而,溶藻弧菌作为条件致病菌可引起海水养殖鱼类、虾蟹类和贝类暴发性疾病,给海水养殖业造成巨大的经济损失[2-4]。对海水养殖动物流行病调查结果表明,溶藻弧菌是凡纳滨对虾(Litopenaeusvanname)、点带石斑鱼(Epinepheluscoioides)、鲑点石斑鱼(E.fario)、杂色鲍(Haliotisdiversicolor)等养殖品种的主要致病菌之一[5-9]。
恩诺沙星是国家批准使用的一种喹诺酮类渔用药物,由于其杀菌谱广、可以人工合成、抗菌力强、价格低廉,成为水产养殖动物弧菌感染症防治常用药物之一[10]。细菌产生喹诺酮耐药多发生在药物使用过程中,药物诱导是形成耐药的重要原因之一。调查显示,水产养殖中喹诺酮类药物的过量使用甚至滥用导致多省区水域交叉耐药弧菌的种类和数量增加[11-14]。渔用药物恩诺沙星在海水养殖动物中的不规范使用加大了水产动物疫病的防控难度,严重影响养殖产品质量和养殖区生态环境。深入探究恩诺沙星使用中引起溶藻弧菌耐药性的问题,对预防耐药菌的产生和合理有效使用抗生素具有重要意义。笔者以海水养殖源的致病性溶藻弧菌为研究对象,对恩诺沙星敏感野生株进行短期体外诱导,研究其耐药性和交叉耐药性的形成,为弧菌病防控及抗菌药物合理使用提供理论参考。
1 材料与方法
1.1 试验菌株
30株溶藻弧菌从海南省水产养殖基地患病水产动物体内、池塘水和底泥中分离获得。药敏试验质控菌株大肠杆菌(Escherichiacoli)ATCC25922 购自苏州达麦迪生物医学科技有限公司。
1.2 主要试剂
恩诺沙星(纯度≥98%)、诺氟沙星(纯度≥98%)、环丙沙星(纯度≥98%)、氟苯尼考(纯度≥98.5%)购自中国药品生物制品检定所。磺胺嘧啶(纯度≥99%)、硫酸新霉素(纯度≥98%)、四环素(纯度≥98%)购自生工生物工程(上海)股份有限公司。
胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)购自Oxoid公司,MH肉汤、MH琼脂培养基购自青岛海博生物技术有限公司。
1.3 方法
1.3.1 药物敏感性检测
将溶藻弧菌接种于TSA琼脂平板,于28 ℃培养 12 h 后挑选单菌落接种于50 mL的TSB培养基,于28 ℃以120 r/min 转速振荡培养24 h。将菌液稀释成0.5麦氏比浊的菌悬液,用MH培养液对菌悬液稀释100倍,采用微量肉汤稀释法测定药物最低抑菌质量浓度,以大肠杆菌ATCC 25922作为质控菌株。
药敏试验结果判定标准参考美国临床与实验室标准化协会药敏试验标准,每个菌株3个平行。恩诺沙星敏感、中介和耐药判定折点分别为≤4 μg/mL、8 μg/mL和≥16 μg/mL。
1.3.2 体外诱导和遗传稳定性试验
依次采用1/4最小抑菌质量浓度、1/2最小抑菌质量浓度、最小抑菌质量浓度等逐步两倍提高药物剂量,当细菌生长抑制时可用同一质量浓度或降低其质量浓度再次进行培养。同时将受试菌株在不含药液的培养基中同步传代培养作为对照,每隔5代测定诱导菌株的最小抑菌质量浓度,调整诱导药物质量浓度,连续诱导30代,并将每代菌株-80 ℃低温保藏。
将恩诺沙星诱导产生的各耐药菌株在无抗菌药物的培养基中传代培养20次,测定菌株的最小抑菌质量浓度。
1.3.3 交叉耐药性
测定诱导得到的各耐药菌株对非诱导药物的最小抑菌质量浓度,并比较诱导前后的最小抑菌质量浓度变化。交叉耐药的判定标准为药物诱导后菌株对非诱导药物的最小抑菌质量浓度比诱导前升高逾4倍。以交叉耐药比率表示某一溶藻弧菌菌株对全部所测试抗生素的耐药情况,以耐药比率表示全部溶藻弧菌菌株对某种抗生素的耐药情况。
2 结果与分析
2.1 溶藻弧菌恩诺沙星敏感株的筛选
利用肉汤倍数稀释法,测定自海南省水产养殖基地分离的30株溶藻弧菌对恩诺沙星的最小抑菌质量浓度,结果见表 1 。参照美国临床与实验室标准化协会药敏试验标准,筛选出对恩诺沙星敏感菌株24株,中介菌株3株,耐药菌株3株。将敏感菌株依次命名为HNVA01、HNVA02、HNVA03……HNVA24。
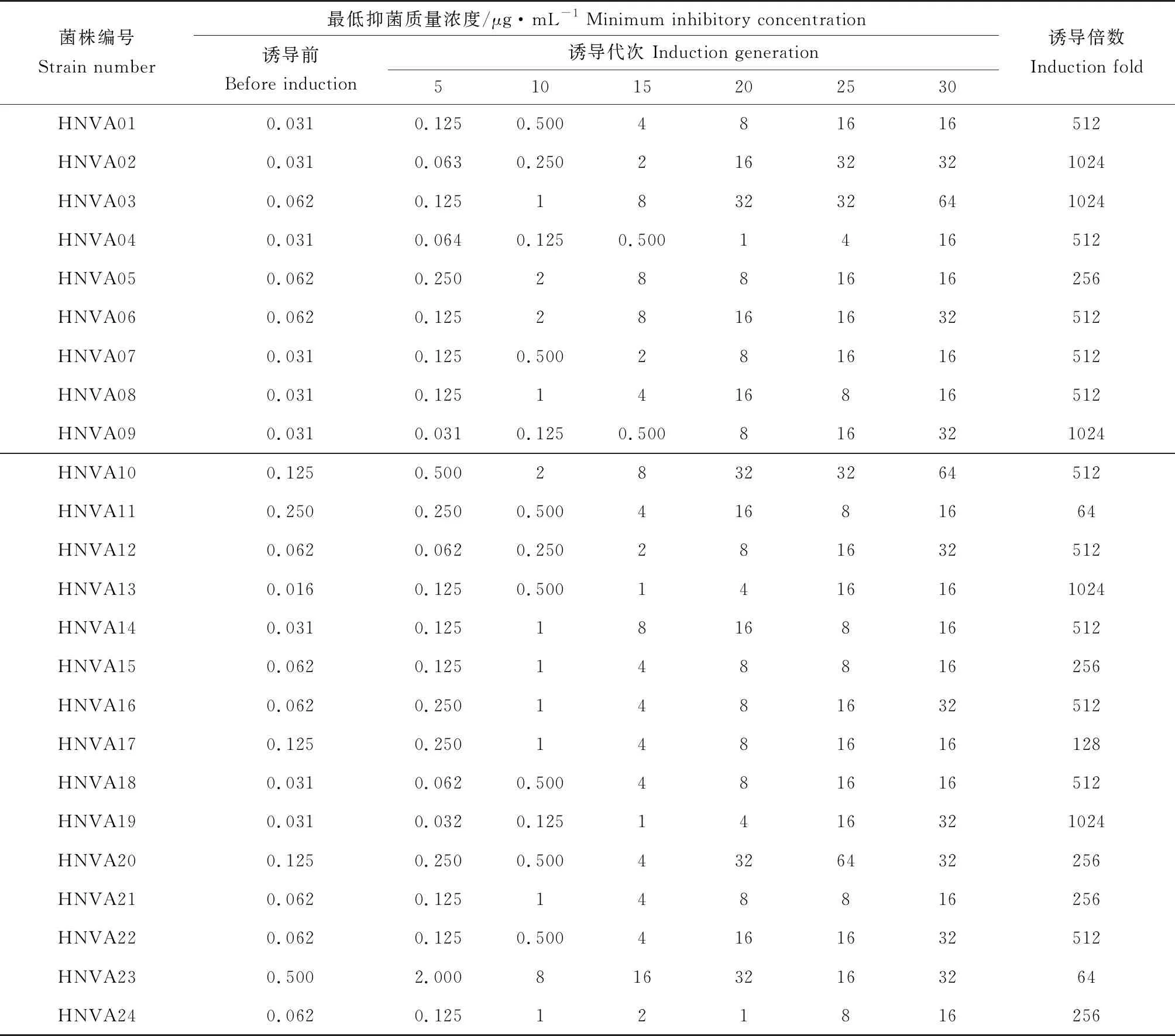
表1 溶藻弧菌敏感菌株经恩诺沙星诱导传代的最小抑菌质量浓度
2.2 溶藻弧菌耐药株的诱导和遗传稳定性
采用亚抑菌质量浓度药物诱导24株溶藻弧菌恩诺沙星敏感菌株,供试菌株在药物中连续传代培养30次,随传代次数增加耐药性逐步增加,结果见表2。传代5次时,多数菌株耐药性出现增加;传代至10次时,所有菌株耐药性均表现为明显增强;传代15至20次时,多数菌株的耐药性大幅度增加;传代至20次后,耐药性增长速率减慢。最终所有敏感株经诱导均获得了耐药性,共得到24株耐药株,最低抑菌质量浓度是诱导前的64~1024倍,将诱导获得的耐药株依次命名为HNVA01R、HNVA02R、HNVA03R……HNVA24R。所有对照组在未加药物的培养基中经过30代培养后最小抑菌质量浓度未发生变化,未产生耐药。
诱导耐药株在无药物的TSA 固体培养基中培养20代后,其中21株对恩诺沙星的最小抑菌质量浓度值无明显改变,仅有HNVA11、HNVA15、HNVA17 3株菌的耐药性降低为诱导后的1/2,表明诱导菌株具有较好的遗传稳定性。
2.3 交叉耐药
诱导产生的耐药株对非诱导药物的最小抑菌质量浓度变化见表 2,对各药物的耐药比见图1。菌株耐药后对同为喹诺酮类药物的环丙沙星和诺氟沙星耐药性提高较大。各诱导株对诺氟沙星和环丙沙星均出现了交叉耐药现象,耐药性至少为原来的32倍,交叉耐药率达到100%。非喹诺酮类的药物中,大多数菌株对四环素耐药性提高较大,耐药性为原来的4~16倍,耐药比为66.67%;对氟苯尼考和磺胺嘧啶耐药性提高幅度较小,部分菌株耐药性为原来的2~4倍,表现出一定的耐药性增强,耐药比分别为12.50%和16.67%;对硫酸新霉素的耐药性影响不明显,个别菌株出现耐药性下降。恩诺沙星诱导耐药株的交叉耐药现象明显,各菌株对6种非诱导药物的交叉耐药比见图2,14株溶藻弧菌诱导耐药株的交叉耐药比逾50%,其中菌株HNVA21的交叉耐药比最高,达83.3%。

表2 菌株诱导前/后对几种非诱导药物的最小抑菌质量浓度
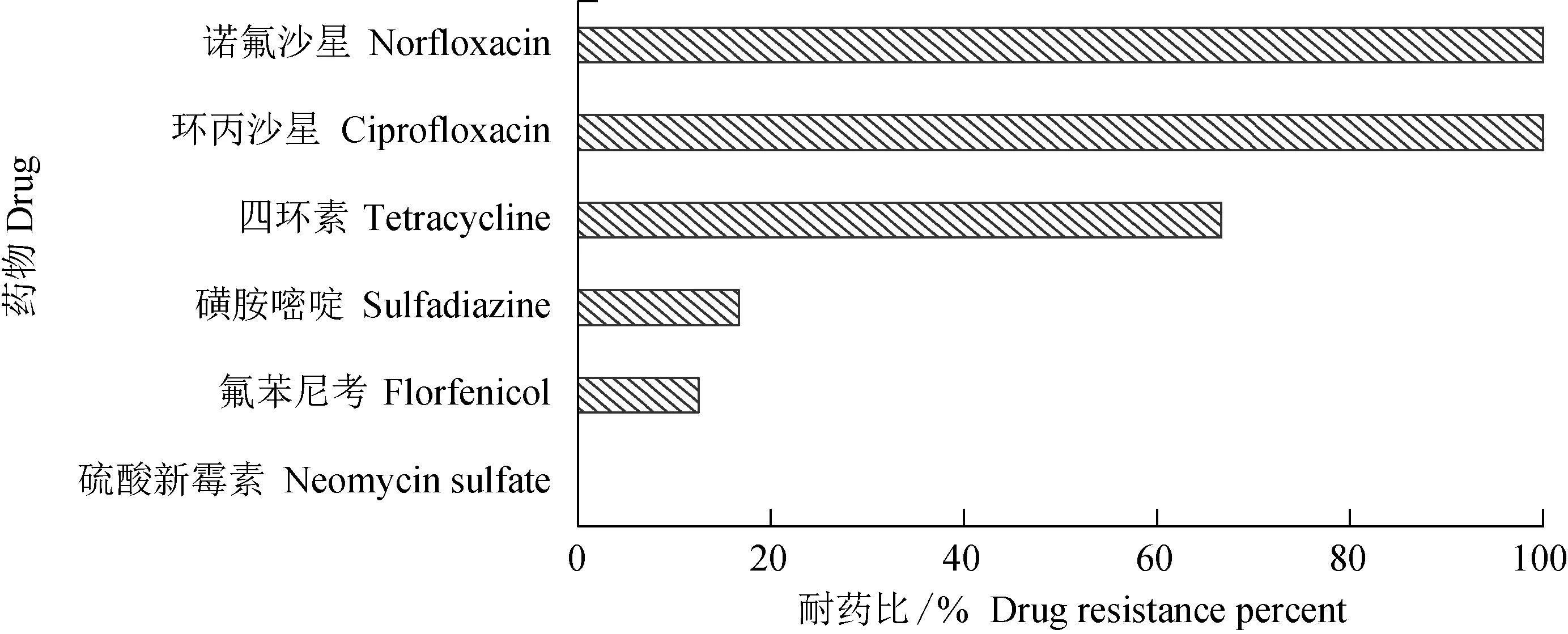
图1 诱导产生的耐药株对非诱导药物的耐药比
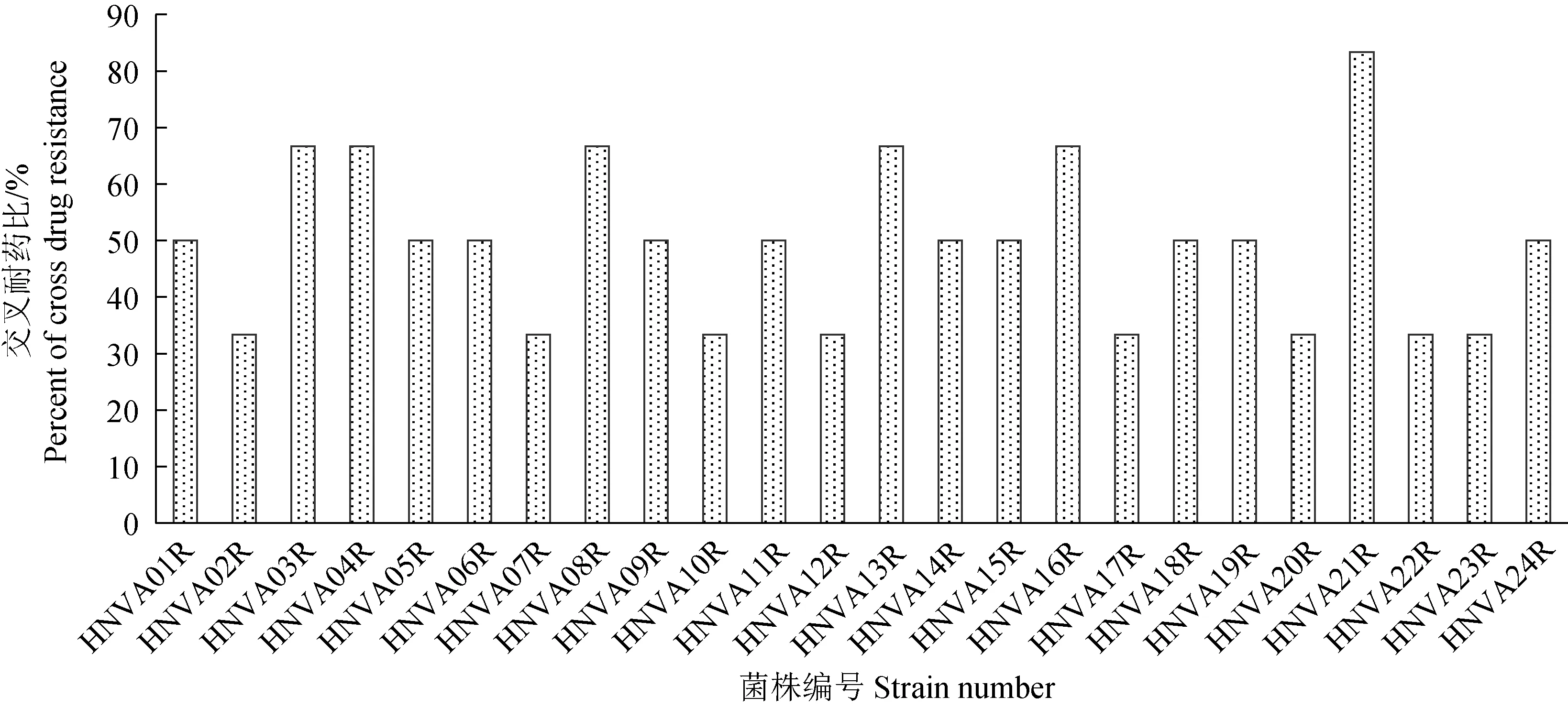
图2 诱导获得的各耐药株对非诱导药物的交叉耐药比
3 讨 论
3.1 恩诺沙星体外诱导溶藻弧菌耐药
耐药是微生物对环境胁迫产生的适应性机制,临床发现的耐药菌可能是药物在体内不断作用于细菌而诱导产生的[15]。研究表明,肺炎克雷伯菌(Klebsiellapneumoniae)、大肠杆菌、嗜水气单胞菌(Aeromonashydrophila)、鲍曼不动杆菌(Acinetobacterbaumannii)等多种细菌在喹诺酮药物的诱导下耐药水平均得到快速提升,美国临床与实验室标准化协会文件规定葡萄球菌属(Staphylococcus)使用喹诺酮类药物治疗3~4 d后需要分离细菌重新进行药敏试验[16-19]。恩诺沙星是常用的喹诺酮类渔药,致病性弧菌对喹诺酮类药物易产生适应性耐药,导致水产动物弧菌病治疗失败。笔者通过梯度质量浓度的恩诺沙星以体外连续诱导方式获得的耐药株均表现为随诱导时间的延长耐药程度逐渐提高。周维[20]对哈维氏弧菌(V.harveyi)的喹诺酮类药物体外诱导研究表明,在获得高度耐药性的过程中,首先表现为喹诺酮耐药决定区靶基因gyrA 和 parC 逐渐产生突变。本试验中,溶藻弧菌在被恩诺沙星诱导的初期耐药提升较快,随后逐渐减缓。获得的诱导耐药株在无药物的培养基中进行多次传代培养,耐药性无明显的下降趋势,表明环境中药物诱导产生的耐药性在一定时间内具有遗传稳定性。因此,推测耐药决定区的基因突变是溶藻弧菌早期耐药性迅速增强的主要原因,突变的基因位点和形成的顺序仍需进一步研究。
3.2 恩诺沙星诱导溶藻弧菌交叉耐药
由于药物主体结构相似,长期使用任何一种喹诺酮类药物可引起细菌对其他药物的敏感性降低,诱发交叉耐药和多重耐药[21-22]。溶藻弧菌诱导耐药株对诺氟沙星和环丙沙星呈现严重的交叉耐药现象,说明可在长期持续接触低剂量同类药物时产生高度耐药株,甚至多重耐药菌株。弧菌经诱导对喹诺酮类药物的耐药机制非常复杂,除了经典的喹诺酮耐药决定区突变外,还包括膜通透性降低、主动外排系统、双组分系统与鞭毛组装等调节机制,耐药性的形成往往是同时两种或两种以上方式综合作用的结果[20,23-24]。这与本试验中诱导的耐药株对喹诺酮类药物诺氟沙星和环丙沙星显著增强结果相一致,也与菌株间交叉耐药性的改变差异较大现象相吻合。
由于外排泵和膜蛋白的选择性不强,适应性耐药的产生往往不仅使细菌对同类药物产生耐药和交叉耐药性,对其他类药物的耐药性也经常出现增强的现象[25]。诱导后的溶藻弧菌耐药株对四环素的交叉耐药性与对恩诺沙星的耐药性之间呈现出相关性,提示耐药株对这两类抗生素可能存在着相似的耐药途径。诱导产生的溶藻弧菌耐药株对磺胺嘧啶和氟苯尼考耐药性表现出一定程度的增强。细菌对磺胺类和喹诺酮类的耐药质粒可被多种抗生素所诱导, 这可能是造成耐药株交叉耐药现象产生的原因之一[26]。氟苯尼考的交叉耐药结果与冯世文等[27]对猪源大肠杆菌的诱导结果一致,可能与质粒介导和细胞膜表面蛋白的改变有关。在本试验中,溶藻弧菌的诱导耐药株对硫酸新霉素未出现交叉耐药现象,表明对这两类药物存在不同的耐药方式。
3.3 体外诱导耐药分析的意义
溶藻弧菌是海水环境中常见菌,是海水养殖动物弧菌病中危害最大的病原菌之一,常给水产养殖业造成巨大的经济损失[2,28]。恩诺沙星在海水动物养殖中的大量不规范使用可造成水环境污染,导致溶藻弧菌产生适应性耐药,耐药溶藻弧菌感染的问题将愈加突出[29]。溶藻弧菌是人畜共患病的病原菌,对弧菌造成的人类严重创面感染,喹诺酮类药物是仅有的几种可用药物之一[30]。环境和水产品中的耐药溶藻弧菌可以感染人体或通过水平传播将耐药基因转移至人体病原菌,会给临床抗感染治疗带来巨大的困难[31]。通过药物体外诱导构建耐药菌株模型是预测临床上细菌对药物耐药性产生、发展和研究耐药机制的一种常用手段[32]。笔者采用人工体外诱导耐药的方法,实现溶藻弧菌菌株由敏感向耐药的转变,从而成功获得了体外诱导耐药菌株,为探讨耐药机制奠定了基础。后期仍需结合分子生物学和组学技术等方法继续进一步研究其产生过程,以期能够采取有效措施干预耐药的发生与传播,寻求安全高效的耐药弧菌感染控制方法。
4 结 论
长时间低于抑菌剂量的恩诺沙星刺激可诱导溶藻弧菌产生对该抗生素的耐药性,并对一些非诱导药物产生交叉耐药性,体外获得性耐药具有较好的稳定性。基于上述研究结果,建议在养殖过程中发生弧菌病害时,用药应尽量避免恩诺沙星长疗程、低剂量的使用。若恩诺沙星治疗溶藻弧菌感染无效,不应再使用另一种同类抗生素。在使用四环素、磺胺嘧啶和氟苯尼考时,应及时关注细菌的耐药变化,合理选择和使用抗菌药物避免产生耐药而造成治疗失败。

