miR-155在过氧化氢诱导晶状体上皮细胞氧化应激损伤中的作用及靶向SIRT1调控机制
牛艳桃 张丽 谢文芳
山西省人民医院眼科,太原030012
白内障是临床常见致盲眼病,以晶状体进行性混浊为主要特征,是导致老年人视力降低及盲的主要原因。动物模型及体外细胞实验均证实,氧化应激与白内障发生和发展密切相关。晶状体上皮细胞(lens epithelial cells,LECs)凋亡是白内障发生的细胞学基础,氧化应激状态下细胞代谢产生的活性氧簇(reactive oxygen species,ROS)异常积累,诱发LECs凋亡,导致晶状体混浊。目前白内障主要通过手术进行治疗,尚缺乏预防或延缓白内障进展的有效手段。因此,寻找安全、有效的干预手段延缓白内障进展具有重要意义。微小RNA(microRNA,miRNA)能特异性调控靶基因,在眼部组织生长、功能维持及蛋白表达方面具有重要调控作用。miR-155是一种多功能miRNA,在炎症、肿瘤及免疫过程中发挥关键作用。既往研究显示,miR-155参与视网膜变性、葡萄膜炎等多种眼部疾病的发生和发展过程。抑制miR-155的表达可减轻脑缺血后海马炎症反应和氧化应激损伤,改善神经功能。但miR-155在LECs氧化应激损伤中的作用尚不清楚。本研究拟探讨miR-155在过氧化氢(hydrogen peroxide,HO)诱导人LECs HLE-B3氧化应激损伤中的作用及其可能的机制,为临床治疗白内障提供一定实验依据。
1 材料与方法
1.1 材料
1.1.1
细胞来源 HLE-B3细胞株购于美国ATCC公司。1.1.2
主要试剂及仪器 体积分数30% HO(10011218)(上海国药集团化学试剂有限公司);miR-155拟似物(miR-155 mimics)及其对照(miR-155 mimics-NC)、miR-155抑制剂(miR-155 inhibitor)及其对照(miR-155 inhibitor-NC)(上海吉玛制药技术有限公司);二氯二氢荧光素-乙酰乙酸酯(2',7'-dichlorofluorescein diacetate,DCFH-DA)ROS荧光探针(CA1410)、超氧化物歧化酶(superoxide dismutase,SOD)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(BC0170)、丙二醛(malondialdehyde,MDA)ELISA试剂盒(BC0025)(北京索莱宝科技有限公司);双荧光素酶报告基因检测试剂盒(GM-040502A,美国Genomeditech公司);兔抗人沉默信息调节因子相关酶1(silment information regulator factor related enzymes 1,SIRT1)单抗(sc-74465,美国SantaCruz公司);兔抗人B细胞淋巴瘤/白血病-2基因(B-cell lymphoma/leukemia-2 gene,bcl-2)单抗(ab32124)、bcl-2相关X蛋白(bcl-2 assaciated X protein,bax)单抗(ab104156)、活化的半胱氨酸天冬氨酸蛋白酶3(cleaved-cysteine aspartase 3,cleaved-Caspase-3)多抗(ab2302)、αA晶状体蛋白多抗(ab4632)、HRP标记的山羊抗兔二抗(ab150077)(英国Abcam公司)。IX53倒置荧光显微镜(日本Olympus公司);流式细胞仪(美国FALS CALIBAR BD公司);ABI7500实时荧光定量PCR系统(美国ABI公司);电泳仪(美国Bio-Rad公司)。1.2 方法
1.2.1
细胞复苏、培养及鉴定 将液氮中冻存的HLE-B3细胞取出,37 ℃水浴解冻,离心半径8 cm,1 000 r/min离心5 min,弃上清,重悬细胞,加入含有体积分数10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基,于体积分数5% CO培养箱中37 ℃培养,待细胞融合达80%~90%时进行传代,2~3 d传代1次,取对数生长期细胞用于后续实验。取传代后的细胞,提取总蛋白,BCA法蛋白定量,蛋白变性后上样进行SDS-PAGE凝胶电泳、转膜、封闭、孵育αA晶状体蛋白一抗(1∶ 1 000)、二抗(1∶ 5 000),增强化学发光法(enhanced chemiluminescence,ECL)显影,检测αA晶状体蛋白表达以鉴定LECs。1.2.2
MTT法检测细胞存活率 取对数生长期HLE-B3细胞,调整细胞密度为1×10个/ml,接种于96孔板,培养24 h后,分别加入不同浓度(50、100、200、400、800 μmol/L)的HO,培养24 h,每孔加入20 μl MTT(5%)溶液,继续培养4 h,加入DMSO 150 μl/孔,充分振荡10 min,使用酶标仪在490 nm处检测各孔吸光度(A
)值,另设不含HO的空白组,计算细胞存活率,细胞存活率=不同浓度HO组A
值/空白组A
值×100%。根据细胞存活率筛选出最适HO浓度。每组设置5个复孔。1.2.3
细胞转染及分组 取对数生长期细胞,调整浓度为1×10个/ml,接种于6孔板,将细胞分为6个组,其中空白对照组细胞不作处理,模型对照组细胞于100 μmol/L HO条件下培养,miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组、miR-155抑制剂对照组细胞分别进行相应转染后于100 μmol/L HO条件下培养。转染步骤为:分别将1 μg miR-155拟似物、miR-155拟似物对照、miR-155抑制剂或miR-155抑制剂对照与50 μl Opti-MEM混合;将2.5 μl Lipofectamine2000与50 μl Opti-MEM混合;再将2种混合物充分混合,室温孵育20 min,加至6孔板中,转染24 h后,荧光显微镜下观察细胞转染效果。倒置显微镜下观察细胞形态学变化并拍照。1.2.4
实时荧光定量PCR法检测细胞中miR-155和SIRT1 mRNA相对表达量 收集各组细胞,Trizol法提取细胞总RNA,紫外分光光度计测定RNA浓度和纯度,将RNA逆转录为cDNA,进行实时荧光定量PCR。PCR反应体系:cDNA 2.0 μl,正向、反向引物各0.5 μl,SYBR Select Master Mix 10 μl,加ddHO至总体积20.0 μl。反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火20 s,70 ℃延伸5 s,进行40个循环。miR-155正向引物序列为5'-AGCTAGCTAGCG ATCGCAG-3',反向为5'-CGTAGCATCGATCGATATG-3';U6正向引物序列为5'-ACGATCGATGCGATATGCATC G-3',反向为5'-AAGCTAGCGCTACGACGTAGCG-3';SIRT1正向引物序列为5'-ATCTATCGAGCTCGGATCG AC-3',反向为5'-AGGCAGCAGCTGCAGATCGAT-3';β-actin正向引物序列为5'-AAGCTAGCGATTATAG CTAGA-3',反向为5'-ATCGATGCTAGGCAAGATTA-3'。引物序列由上海生工生物工程有限公司合成。miR-155以U6为内参,SIRT1以β-actin为内参,采用2法计算miR-155和SIRT1 mRNA相对表达量。1.2.5
流式细胞术检测细胞凋亡率 取各组细胞,以1×10个/ml密度接种至6孔板,培养24 h,每孔加入500 μl质量分数0.25%胰蛋白酶消化3 min,离心半径8 cm,1 500 r/min离心10 min,弃上清,加入500 μl结合缓冲液重悬细胞,加入5 μl Annexin和PI染色液,避光4 ℃染色15 min,流式细胞仪检测细胞凋亡情况,计算凋亡率。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。每组设5个复孔。1.2.6
DCFH-DA荧光探针法检测细胞ROS含量 各组细胞于6孔板培养24 h,每孔加入200 μl DCFH-DA,培养箱中静置30 min,使探针和细胞充分混匀,磷酸盐缓冲液洗涤,收集各组细胞,酶标仪检测A
值(激发波长为488 nm、发射波长为525 nm);倒置荧光显微镜下观察二氯荧光素(dichlorofluorescein,DCF)荧光强度并拍照,荧光越强代表ROS含量越高。每组设5个复孔。1.2.7
ELISA法检测细胞培养上清液SOD活性和MDA浓度 各组细胞于6孔板培养24 h,离心半径8 cm,1 000 r/min离心5 min,收集上清,参照试剂盒说明书步骤,加入SOD、MDA抗体及酶标抗体,洗涤后加入底物显色液避光染色10 min,终止反应后,使用酶标仪于450 nm处测量A
值,根据标准曲线计算样品中SOD活性和MDA浓度。每组设5个复孔。1.2.8
双荧光素酶报告基因系统检测miR-155靶基因表达 采用PicTar以及TargetScan生物信息软件预测分析miR-155与SIRT1序列之间结合位点,以SIRT1的3'非翻译区(untranslated region,UTR)插入双荧光素酶报告基因psiCHECK2中,构建野生型(wild type,WT)psiCHECK2-SIRT1 WT和突变型(mutant type,MUT)psiCHECK2-SIRT1 MUT重组质粒,分别将miR-155拟似物、miR-155拟似物对照、miR-155抑制剂及miR-155抑制剂对照与psiCHECK2-SIRT1 WT、psiCHECK2-SIRT1 MUT共转染至HLE-B3细胞,检测相对荧光素酶活性,以萤火虫荧光素酶活性与内参海肾荧光素酶活性的比值表示。实验重复3次。1.2.9
Western blot法检测细胞SIRT1、bcl-2、bax、cleaved-Caspase-3蛋白相对表达量 取各组细胞,加入RIPA裂解液裂解细胞,提取总蛋白,BCA法对蛋白进行定量,100 ℃水浴变性,蛋白上样进行SDS-PAGE凝胶电泳,电泳完毕后,将蛋白转印至PVDF膜,质量分数5%脱脂奶粉室温条件下封闭2 h,加入SIRT1、bcl-2、bax、cleaved-Caspase-3及β-actin一抗(均1∶ 800稀释),4 ℃孵育过夜,TBST溶液洗膜,加入HRP标记的相应二抗(1∶ 2 000稀释),室温孵育2 h,TBST溶液洗膜,加入ECL溶液,显影、定影,采用ImageJ软件分析蛋白条带灰度值,以目的蛋白与内参β-actin灰度比值表示目的蛋白相对表达量。每组设5个复孔。1.3 统计学方法
采用SPSS 24.0统计学软件进行统计分析。本研究中计量资料经Shapiro-Wilk检验证实符合正态分布,以表示,采用Levene进行组间方差齐性检验。采用均衡分组单因素干预多水平研究设计,空白对照组、模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组、miR-155抑制剂对照组组间各测量值差异比较采用单因素方差分析,多重比较采用LSD-t
检验。miR-155拟似物对照组与miR-155拟似物组、miR-155抑制剂对照组与miR-155抑制剂组相对荧光素酶活性比较均采用独立样本t
检验。P
<0.05为差异有统计学意义。2 结果
2.1 LECs的鉴定
培养的HLE-B3细胞高表达αA晶状体蛋白(图1)。
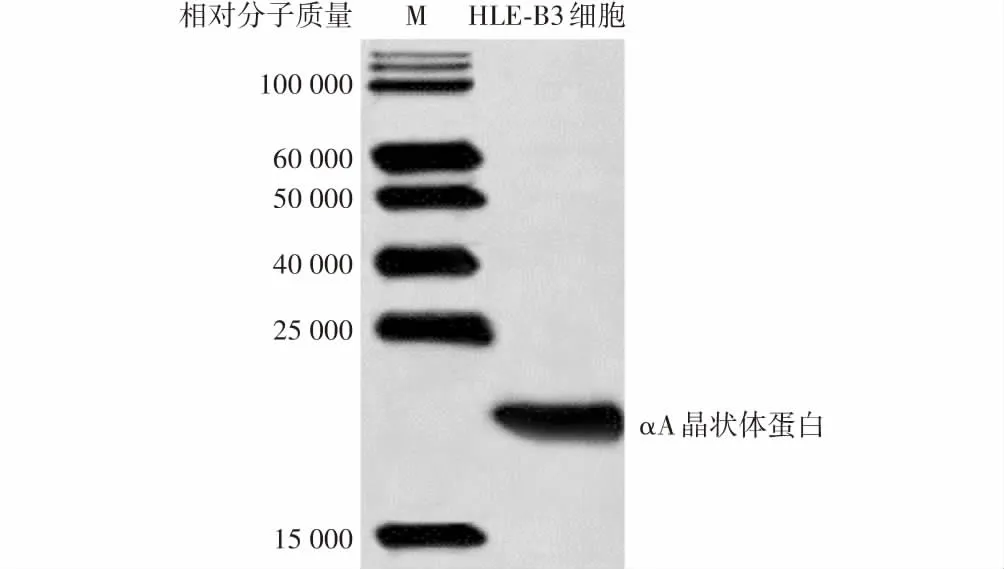
图1 HLE-B3细胞中αA晶状体蛋白表达 可见细胞中αA晶状体蛋白高表达 M:蛋白分子标记Figure 1 Expression of αA-crystallin in HLE-B3 cells αA-crystallin was highly expressed in cells M:protein marker
2.2 不同浓度H2O2干预后细胞存活率比较
MTT检测结果显示,不同浓度HO处理细胞存活率总体比较,差异有统计学意义(F
=289.475,P
<0.05)。随着HO浓度增加,细胞存活率逐渐降低,各不同浓度间细胞存活率比较差异均有统计学意义(均P
<0.05)(表1),其中100 μmol/L的HO处理细胞存活率接近50%,故后续实验选取HO的浓度为100 μmol/L。2.3 各组细胞形态学变化比较
倒置显微镜下观察结果显示,空白对照组细胞呈长梭形或不规则椭圆形,贴壁生长良好;模型对照组细胞数量减少,死亡细胞悬浮于培养基中,呈圆形,存活细胞部分形态发生改变,细胞边界模糊不清;miR-155拟似物组细胞数量少于模型对照组,细胞固有形态发生改变;miR-155抑制剂组细胞数量多于模型对照组,细胞生长状态良好,但仍可见少量死亡细胞;miR-155拟似物对照组和miR-155抑制剂对照组细胞形态与模型对照组相似(图2)。
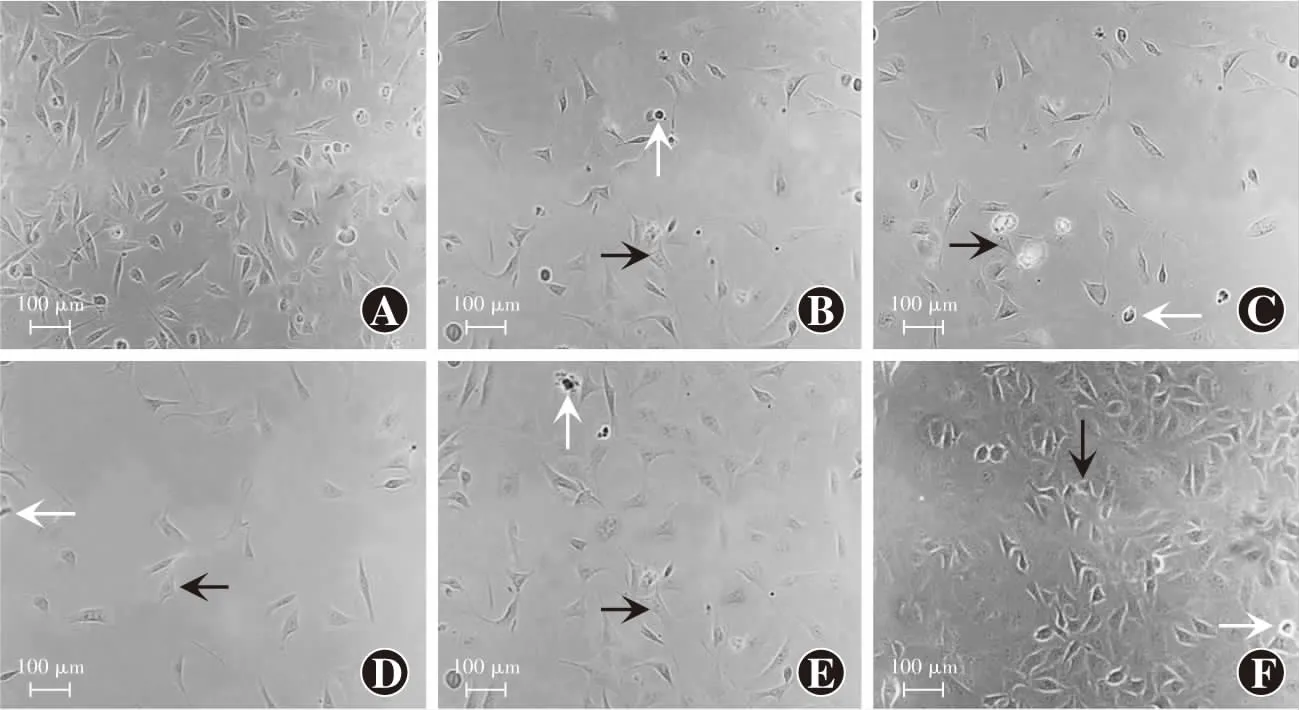
图2 各组细胞形态变化(×200,标尺=100 μm) 空白对照组可见细胞呈长梭形或不规则椭圆形,贴壁生长良好;模型对照组可见细胞数量减少,部分存活细胞形态发生改变,边界模糊不清;miR-155拟似物组可见细胞数量较模型对照组少,细胞形态发生改变;miR-155抑制剂组可见中等数量细胞及少量死亡细胞;miR-155拟似物对照组和miR-155抑制剂对照组可见细胞形态与模型对照组相似 白箭头示死亡细胞,黑箭头示变形细胞 A:空白对照组 B:模型对照组 C:miR-155拟似物对照组 D:miR-155拟似物组 E:miR-155抑制剂对照组 F:miR-155抑制剂组 miR:微小RNAFigure 2 Cell morphology changes in various groups(×200,bar=100 μm) In blank control group,the cells showed long fusiform or irregular elliptical shape,and they grew well adherently.In model control group,the number of cells was reduced,and some surviving cells were deformed with unclear boundary.Fewer cells were seen in miR-155 mimics group compared with model control group and they were deformed.Medium number of cells and a few dead cells were seen in miR-155 inhibitor group.Cell morphology in miR-155 mimics negative control group and miR-155 inhibitor negative control group was similar to model control group White arrows indicated dead cells,and black arrows showed deformed cells A:blank control group B:model control group C:miR-155 mimics negative control group D:miR-155 mimics group E:miR-155 inhibitor negative control group F:miR-155 inhibitor group miR:microRNA
表1 不同浓度H2O2细胞存活率比较(x±s,%)Table 1 Comparison of cell survival rate at different concentrations of H2O2 (x±s,%)H2O2浓度样本量细胞存活率0 μmol/L5100.00±1.0050 μmol/L566.15±3.56a100 μmol/L555.38±3.15ab200 μmol/L541.54±2.95abc400 μmol/L527.69±2.58abcd800 μmol/L520.00±2.37abcdeF值289.475P值<0.001 注:与0 μmol/L H2O2比较,aP<0.05;与50 μmol/L H2O2比较,bP<0.05;与100 μmol/L H2O2比较,cP<0.05;与200 μmol/L H2O2比较,dP<0.05;与400 μmol/L H2O2比较,eP<0.05(单因素方差分析,LSD-t检验) H2O2:过氧化氢 Note:Compared with 0 μmol/L H2O2,aP<0.05;compared with 50 μmol/L H2O2,bP<0.05;compared with 100 μmol/L H2O2,cP<0.05;compared with 200 μmol/L H2O2,dP<0.05;compared with 400 μmol/L H2O2,eP<0.05 (One-way ANOVA,LSD-t test) H2O2:hy-drogen peroxide
2.4 各组细胞miR-155和SIRT1 mRNA相对表达量比较
空白对照组、模型对照组、miR-155拟似物组、miR-155抑制剂组、miR-155拟似物对照组和miR-155抑制剂对照组细胞miR-155和SIRT1 mRNA相对表达量总体比较,差异均有统计学意义(F
=386.952、356.158,均P
<0.001),其中与空白对照组相比,模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂对照组细胞miR-155 mRNA相对表达量升高,SIRT1 mRNA相对表达量表达降低,miR-155抑制剂组细胞miR-155和SIRT1 mRNA相对表达量明显降低,差异均有统计学意义(均P
<0.05);与模型对照组和miR-155拟似物对照组比较,miR-155拟似物组细胞miR-155 mRNA相对表达量明显升高,SIRT1 mRNA相对表达量明显降低,差异均有统计学意义(均P
<0.05);与模型对照组、miR-155抑制剂对照组和miR-155拟似物组比较,miR-155抑制剂组细胞miR-155 mRNA相对表达量明显降低,SIRT1 mRNA相对表达量明显升高,差异均有统计学意义(均P
<0.05);模型对照组、miR-155拟似物对照组和miR-155抑制剂对照组间细胞miR-155和SIRT1 mRNA相对表达量比较,差异均无统计学意义(均P
>0.05)(表2)。2.5 各组细胞凋亡率比较
空白对照组、模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组和miR-155抑制剂对照组细胞凋亡率总体比较,差异有统计学意义(F
=263.158,P
<0.001),其中与空白对照组比较,模型对照组、miR-155拟似物对照组、miR-155拟似物组、miR-155抑制剂对照组、miR-155抑制剂组细胞凋亡率均升高,差异均有统计学意义(均P
<0.05);与模型对照组和miR-155拟似物对照组比较,miR-155拟似物组细胞凋亡率升高(P
<0.05);与模型对照组、miR-155抑制剂对照组和miR-155拟似物组比较,miR-155抑制剂组细胞凋亡率降低,差异均有统计学意义(均P
<0.05)。模型对照组、miR-155拟似物对照组及miR-155抑制剂对照组间细胞凋亡率比较,差异均无统计学意义(均P
>0.05)(图3,表3)。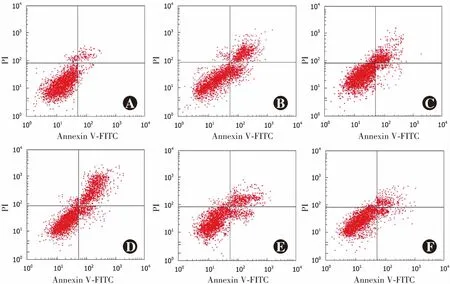
图3 各组流式细胞分析图 A:空白对照组 B:模型对照组 C:miR-155拟似物对照组 D:miR-155拟似物组 E:miR-155抑制剂对照组 F:miR-155抑制剂组 PI:碘化丙啶;FITC:异硫氰酸荧光素Figure 3 Flow cytometry analysis of cells in various groups A:blank control group B:model control group C:miR-155 mimics negative control group D:miR-155 mimics group E:miR-155 inhibitor negative control group F:miR-155 inhibitor group PI:propidium iodide;FITC:fluorescein isothiocyanate
表3 各组细胞凋亡率比较(x±s,%)Table 3 Comparison of cell apoptosis rate among various groups (x±s,%)组别样本量凋亡率空白对照组53.16±1.01模型对照组521.57±1.47amiR-155拟似物对照组523.35±1.65amiR-155拟似物组534.57±2.02abcmiR-155抑制剂对照组521.96±1.58amiR-155抑制剂组511.84±1.24abdeF值263.158P值<0.001 注:与空白对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与miR-155拟似物对照组比较,cP<0.05;与miR-155拟似物组比较,dP<0.05;与miR-155抑制剂对照组比较,eP<0.05(单因素方差分析,LSD-t检验) miR:微小RNA Note:Compared with blank control group,aP<0.05;compared with model control group,bP<0.05;compared with miR-155 mimics nega-tive control group,cP<0.05;compared with miR-155 mimics group,dP<0.05;compared with miR-155 inhibitor negative control group,eP<0.05 (One-way ANOVA,LSD-t test) miR:microRNA
表2 各组细胞miR-155、SIRT1 mRNA相对表达量比较(x±s)Table 2 Comparison of the relative expression levels of miR-155 and SIRT1 mRNA among various groups (x±s)组别样本量miR-155SIRT1 mRNA空白对照组51.00±0.111.00±0.10模型对照组51.66±0.13a0.65±0.07amiR-155拟似物对照组51.63±0.12a0.61±0.08amiR-155拟似物组52.75±0.15abc0.43±0.06abcmiR-155抑制剂对照组51.65±0.14a0.66±0.07amiR-155抑制剂组50.61±0.07abde0.84±0.08abdeF值386.952356.158P值<0.001<0.001 注:与空白对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与miR-155拟似物对照组比较,cP<0.05;与miR-155拟似物组比较,dP<0.05;与miR-155抑制剂对照组比较,eP<0.05(单因素方差分析,LSD-t检验) miR:微小RNA;SIRT1:沉默信息调节因子相关酶1 Note:Compared with blank control group,aP<0.05;compared with model control group,bP<0.05;compared with miR-155 mimics nega-tive control group,cP<0.05;compared with miR-155 mimics group,dP<0.05;compared with miR-155 inhibitor negative control group,eP<0.05 (One-way ANOVA,LSD-t test) miR:microRNA;SIRT1:silent information regulator factor related enzymes 1
2.6 各组细胞ROS含量比较
倒置显微镜下观察结果显示,空白对照组DCF荧光较弱;模型对照组可见强DCF荧光;miR-155拟似物组DCF荧光较模型对照组明显增强;miR-155抑制剂组DCF荧光较模型对照组和miR-155拟似物组明显减弱;miR-155拟似物对照组和miR-155抑制剂对照组ROS含量与模型对照组相似(图4)。空白对照组、模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组和miR-155抑制剂对照组细胞ROS含量总体比较,差异有统计学意义(F
=163.236,P
<0.001)。与空白对照组比较,模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组和miR-155抑制剂对照组细胞ROS含量均升高,差异均有统计学意义(均P
<0.05);与模型对照组和miR-155拟似物对照组比较,miR-155拟似物组细胞ROS含量升高,差异均有统计学意义(均P
<0.05);与模型对照组、miR-155抑制剂对照组和miR-155拟似物组比较,miR-155抑制剂组细胞ROS含量降低,差异均有统计学意义(均P
<0.05)。模型对照组、miR-155拟似物对照组及miR-155抑制剂对照组间细胞ROS含量比较,差异均无统计学意义(均P
>0.05)(表4)。2.7 各组细胞SOD活性和MDA浓度比较
空白对照组、模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组、miR-155抑制剂对照组细胞SOD活性和MDA浓度总体比较,差异均有统计学意义(F
=62.361、73.325,均P
<0.001),其中与空白对照组比较,模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组、miR-155抑制剂对照组细胞SOD活性均降低,MDA浓度均升高,差异均有统计学意义(均P
<0.05);与模型对照组和miR-155拟似物对照组比较,miR-155拟似物组细胞SOD活性降低,MDA浓度升高,差异均有统计学意义(均P
<0.05);与模型对照组、miR-155抑制剂对照组和miR-155拟似物组比较,miR-155抑制剂组细胞SOD活性升高,MDA浓度降低,差异均有统计学意义(均P
<0.05)。模型对照组、miR-155拟似物对照组及miR-155抑制剂对照组间细胞SOD活性和MDA浓度比较,差异均无统计学意义(均P
>0.05)(表5)。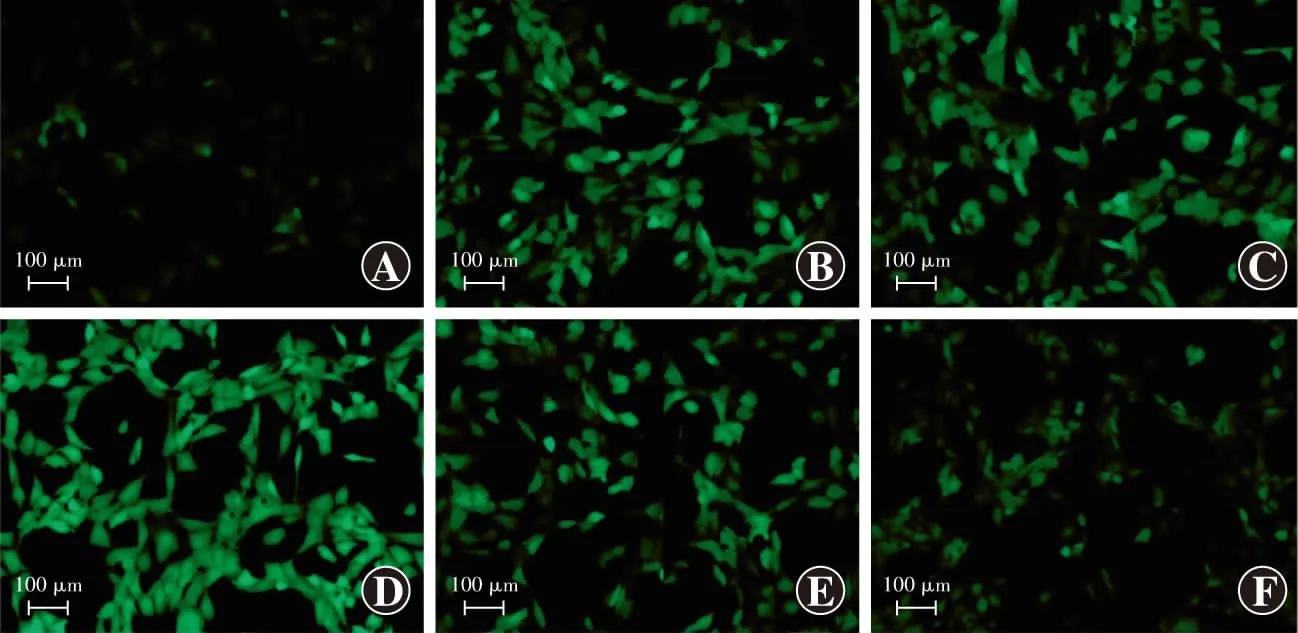
图4 各组细胞ROS荧光图(×200,标尺=100 μm) 空白对照组细胞荧光强度较弱,模型对照组细胞荧光增强,miR-155拟似物对照组和miR-155抑制剂对照组荧光强度与模型对照组相似,miR-155拟似物组荧光强度较模型对照组增强,miR-155抑制剂组荧光强度较模型对照组和miR-155拟似物组减弱 A:空白对照组 B:模型对照组 C:miR-155拟似物对照组 D:miR-155拟似物组 E:miR-155抑制剂对照组 F:miR-155抑制剂组Figure 4 ROS fluorescence image of cells in various groups (×200,bar=100 μm) Fluorescence intensity of cells in blank control group was weak;fluorescence intensity of cells in model control group was increased;fluorescence intensity of cells in miR-155 mimics negative control group and miR-155 inhibitor negative control group was similar to model control group;fluorescence intensity of cells in miR-155 mimics group was enhanced compared with model control group;fluorescence intensity of cells in miR-155 inhibitor group was attenuated in comparison with model control group and miR-155 mimics group A:blank control group B:model control group C:miR-155 mimics negative control group D:miR-155 mimics group E:miR-155 inhibitor negative control group F:miR-155 inhibitor group
表4 各组细胞ROS含量比较(x±s)Table 4 Comparison of ROS content among various groups (x±s)组别样本量ROS荧光A值空白对照组520.68±3.21模型对照组563.52±5.47amiR-155拟似物对照组562.59±5.18amiR-155拟似物组584.57±6.39abcmiR-155抑制剂对照组561.96±5.26amiR-155抑制剂组541.84±4.97abdeF值163.236P值<0.001 注:与空白对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与miR-155拟似物对照组比较,cP<0.05;与miR-155拟似物组比较,dP<0.05;与miR-155抑制剂对照组比较,eP<0.05(单因素方差分析,LSD-t检验) ROS:活性氧簇 miR:微小RNA Note:Compared with blank control group,aP<0.05;compared with model control group,bP<0.05;compared with miR-155 mimics nega-tive control group,cP<0.05;compared with miR-155 mimics group,dP<0.05;compared with miR-155 inhibitor negative control group,eP<0.05 (One-way ANOVA,LSD-t test) ROS:reactive oxy-gen species miR:microRNA
2.8 双荧光素酶报告结果
生物信息软件预测显示,SIRT1的3'UTR区存在miR-155连续结合位点,靶向序列为5'-AGCAUUA-3'。转染miR-155拟似物细胞野生型SIRT1相对荧光素酶活性为0.41±0.07,明显弱于转染miR-155拟似物对照细胞的1.00±0.11,差异有统计学意义(t
=7.838,P
<0.05);转染miR-155抑制剂细胞野生型SIRT1相对荧光素酶活性为1.98±0.17,明显强于转染miR-155抑制剂对照细胞的1.00±0.12,差异有统计学意义(t
=8.157,P
<0.05)。转染miR-155拟似物与转染miR-155拟似物对照及转染miR-155抑制剂与转染miR-155抑制剂对照细胞突变型SIRT1相对荧光素酶活性比较,差异均无统计学意义(t
=0.776、0.350,均P
>0.05)(图5)。表5 各组细胞SOD活性和MDA浓度比较(x±s)Table 5 Comparison of SOD activity and MDA concentration in cells among various groups (x±s)组别样本量SOD[mmol/(min·L) ]MDA (μmol/L)空白对照组552.26±5.231.86±0.39模型对照组523.15±3.45a5.89±0.57amiR-155拟似物对照组522.85±3.62a5.93±0.52amiR-155拟似物组511.75±3.18abc7.12±0.61abcmiR-155抑制剂对照组524.43±3.71a5.85±0.48amiR-155抑制剂组541.09±4.57abde2.94±0.46abdeF值62.36173.325P值<0.001<0.001 注:与空白对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与miR-155拟似物对照组比较,cP<0.05;与miR-155拟似物组比较,dP<0.05;与miR-155抑制剂对照组比较,eP<0.05(单因素方差分析,LSD-t检验) SOD:超氧化物歧化酶;MDA:丙二醛;miR:微小RNA Note:Compared with blank control group,aP<0.05;compared with model control group,bP<0.05;compared with miR-155 mimics nega-tive control group,cP<0.05;compared with miR-155 mimics group,dP<0.05;compared with miR-155 inhibitor negative control group,eP<0.05 (One-way ANOVA,LSD-t test) SOD:superoxide dismutase;MDA:malondialdehyde;miR:microRNA
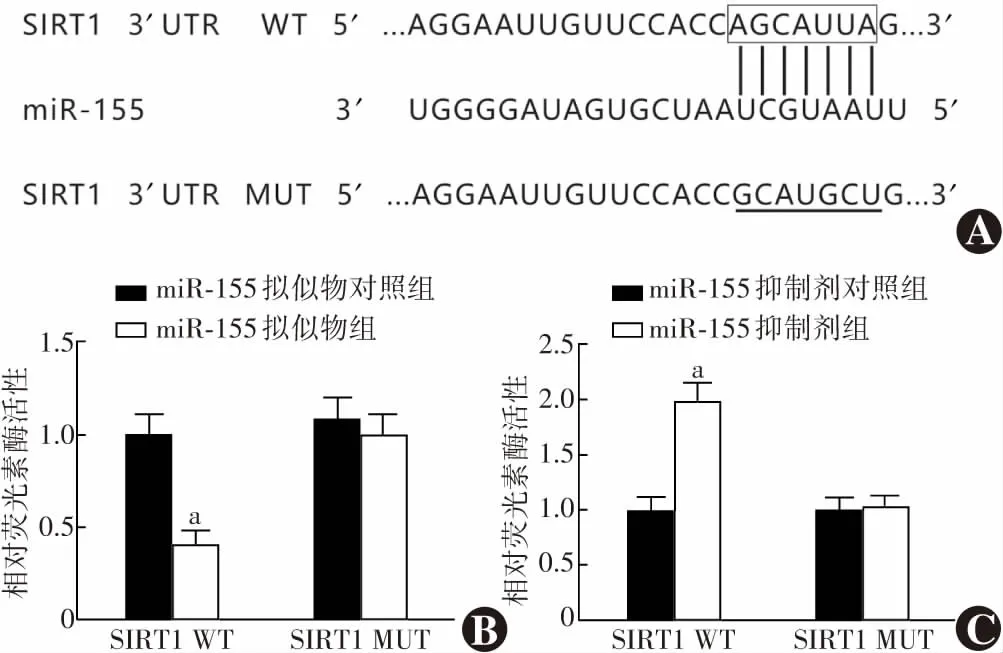
图5 miR-155靶向调控SIRT1 A:miR-155与SIRT1存在连续结合位点 B:miR-155拟似物和miR-155拟似物对照转染细胞SIRT1相对荧光素酶活性比较 与miR-155拟似物对照组比较,a P<0.05(独立样本t检验,n=3) C:miR-155抑制剂和miR-155抑制剂对照转染细胞SIRT1相对荧光素酶活性比较 与miR-155抑制剂对照组比较,a P<0.05(独立样本t检验,n=3) SIRT1:沉默信息调节因子相关酶1;UTR:非翻译区;WT:野生型;miR:微小RNA;MUT:突变型Figure 5 Targeted regulation of SIRT1 by miR-155 A:There were continuous binding sites between miR-155 and SIRT1 B:Comparison of the relative luciferase activity of SIRT1 between cells transfected with miR-155 mimics and miR-155 mimics negative control Compared with miR-155 mimics negative control group,a P<0.05 (Independent samples t test,n=3) C:Comparison of the relative luciferase activity of SIRT1 between cells transfected with miR-155 inhibitor and miR-155 inhibitor negative control Compared with miR-155 inhibitor negative control group,a P<0.05 (Independent samples t test,n=3) SIRT1:silent information regulator factor related enzymes 1;UTR:untranslated area;WT:wild type;miR:microRNA;MUT:mutant type
2.9 各组细胞SIRT1、bcl-2、bax、cleaved-Caspase-3蛋白相对表达量及bcl-2/bax比较
空白对照组、模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组、miR-155抑制剂对照组细胞SIRT1、bcl-2、bax、cleaved-Caspase-3蛋白相对表达量及bcl-2/bax总体比较,差异均有统计学意义(F
=48.596、55.489、15.632、63.281、113.259,均P
<0.001)。与空白对照组比较,模型对照组、miR-155拟似物组、miR-155拟似物对照组、miR-155抑制剂组、miR-155抑制剂对照组细胞SIRT1、bcl-2蛋白相对表达量及bcl-2/bax降低,bax和cleaved-Caspase-3蛋白相对表达量升高,差异均有统计学意义(均P
<0.05);与模型对照组和miR-155拟似物对照组比较,miR-155拟似物组细胞SIRT1、bcl-2蛋白相对表达量及bcl-2/bax降低,bax和cleaved-Caspase-3蛋白相对表达量升高,差异均有统计学意义(均P
<0.05);与模型对照组、miR-155抑制剂对照组和miR-155拟似物比较,miR-155抑制剂组细胞SIRT1、bcl-2蛋白相对表达量及bcl-2/bax升高,bax、cleaved-Caspase-3蛋白相对表达量降低,差异均有统计学意义(均P
<0.05)。模型对照组、miR-155拟似物对照组及miR-155抑制剂对照组间细胞SIRT1、bcl-2、bax、cleaved-Caspase-3蛋白相对表达量及bcl-2/bax比较,差异均无统计学意义(均P
>0.05)(图6,表6)。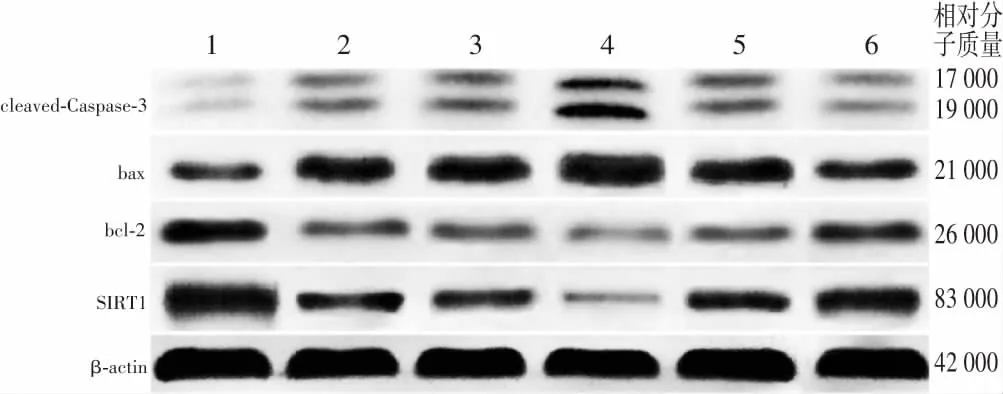
图6 各组细胞蛋白表达电泳图 与空白对照组相比,模型对照组、miR-155拟似物对照组、miR-155抑制剂对照组SIRT1、bcl-2蛋白条带灰度减弱,bax、cleaved-Caspase-3蛋白条带灰度增强;miR-155拟似物组SIRT1、bcl-2蛋白条带灰度较模型对照组和miR-155拟似物对照组弱,bax、cleaved-Caspase-3蛋白条带灰度较模型对照组和miR-155拟似物对照组强;miR-155抑制剂组SIRT1、bcl-2蛋白条带灰度较模型对照组和miR-155抑制剂对照组强,bax、cleaved-Caspase-3蛋白条带灰度较模型对照组和miR-155抑制剂对照组弱 1:空白对照组;2:模型对照组;3:miR-155拟似物对照组;4:miR-155拟似物组;5:miR-155抑制剂对照组;6:miR-155抑制剂组 cleaved-Caspase-3:活化的半胱氨酸天冬氨酸酶3;bax:bcl-2相关X蛋白;bcl-2:B细胞淋巴瘤/白血病-2基因;SIRT1:沉默信息调节因子相关酶1Figure 6 Electrophoretogram of proteins in various groups Compared with blank control group,the band intensity of SIRT1 and bcl-2 proteins was weaker,and the band intensity of bax and cleaved-Caspase-3 proteins was stronger in model control group,miR-155 mimics negative control group and miR-155 inhibitor negative control group.The band intensity of SIRT1 and bcl-2 proteins was weaker and the band intensity of bax and cleaved-Caspase-3 proteins was stronger in miR-155 mimics group than model control group and miR-155 mimics negative control group.The band intensity of SIRT1 and bcl-2 proteins was stronger and the band intensity of bax and cleaved-Caspase-3 proteins was weaker in miR-155 inhibitor group than model control group and miR-155 inhibitor negative control group 1:blank control group;2:model control group;3:miR-155 mimics negative control group;4:miR-155 mimics group;5:miR-155 inhibitor negative control group;6:miR-155 inhibitor group cleaved-Caspase-3:cleaved-cysteine aspartase 3;bax:bcl-2 associated X protein;bcl-2:B-cell lymphoma/leukemia-2 gene;SIRT1:silent information regulator factor related enzymes 1
表6 各组细胞SIRT1、bcl-2、bax、cleaved-Caspase-3蛋白相对表达量及bcl-2/bax比较(x±s)Table 6 Comparison of relative expression levels of SIRT1,bcl-2,bax,cleaved-Caspase-3 proteins and bcl-2/bax among various groups (x±s)组别SIRT1bcl-2baxbcl-2/baxcleaved-Caspase-3空白对照组1.06±0.110.87±0.090.71±0.061.14±0.100.36±0.05模型对照组0.65±0.07a0.45±0.07a0.96±0.10a0.46±0.06a0.89±0.09amiR-155拟似物对照组0.63±0.10a0.43±0.06a0.94±0.09a0.44±0.07a0.85±0.08amiR-155拟似物组0.35±0.07abc0.26±0.05abc1.13±0.11abc0.23±0.05abc1.03±0.10abcmiR-155抑制剂对照组0.62±0.09a0.42±0.06a0.93±0.09a0.45±0.06a0.82±0.09amiR-155抑制剂组0.82±0.09abde0.63±0.08abde0.81±0.07abde0.78±0.09abde0.63±0.07abdeF值48.59655.48915.632113.25963.281P值<0.001<0.001<0.001<0.001<0.001 注:与空白对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与miR-155拟似物对照组比较,cP<0.05;与miR-155拟似物组比较,dP<0.05;与miR-155抑制剂对照组比较,eP<0.05(单因素方差分析,LSD-t检验) SIRT1:沉默信息调节因子相关酶1;bcl-2:B细胞淋巴瘤/白血病-2基因;bax:bcl-2相关X蛋白;cleaved-Caspase-3:活化的半胱氨酸天冬氨酸酶3;miR:微小RNA Note:Compared with blank control group,aP<0.05;compared with model control group,bP<0.05;com-pared with miR-155 mimics negative control group,cP<0.05;compared with miR-155 mimics group,dP<0.05;compared with miR-155 inhibitor negative control group,eP<0.05 (One-way ANOVA,LSD-t test) SIRT1:silent information regulator factor related enzymes 1;bcl-2:B-cell lymphoma/leukemia-2 gene;bax:bcl-2 associated X protein;cleaved-Caspase-3:cleaved-cysteine aspartase 3;miR:microRNA
3 讨论
ROS过度堆积对LECs的损伤是引起白内障的主要因素,可损伤细胞蛋白质、核酸及脂质等成分,诱导细胞凋亡,引起组织损伤,降低细胞中ROS水平可有效防止晶状体混浊。HO是晶状体内主要ROS之一,SOD等抗氧化剂可有效清除堆积的ROS,正常情况下,晶状体中氧化与抗氧化系统处于平衡状态,随着年龄增长,房水及晶状体HO增加,氧化应激损伤超过抗氧化系统,引起晶状体氧化损伤。MDA浓度与细胞受ROS攻击程度有关,白内障患者晶状体中MDA浓度明显升高。HO处理的LECs可产生明显氧化应激损伤,同时实验性白内障大鼠晶状体中SOD活性明显低于正常大鼠。以上研究均提示氧化应激损伤参与白内障发生和发展过程。本研究结果显示,模型对照组细胞ROS荧光A
值、MDA浓度及凋亡率均较空白对照组明显升高,而SOD活性较空白对照组明显降低,证实HO可诱导HLE-B3细胞氧化应激损伤,促进细胞凋亡。研究证实,miRNA在白内障发生和发展过程中发挥重要作用,有望作为诊断标志物或新的治疗靶点。miR-155在眼部组织生长发育以及功能调节方面具有重要作用,Bian等研究显示,miR-155参与视网膜损伤,与光感受器变性有关。Woeller等报道,miR-155在甲状腺相关眼病患者眼眶成纤维细胞中的表达高于健康人群。以上研究均表明miR-155与眼部疾病密切相关。本研究结果也显示,miR-155在HO诱导的HLE-B3细胞氧化应激损伤模型中异常高表达,miR-155抑制剂组细胞生长状态良好,且凋亡率较模型对照组和miR-155拟似物组明显降低,提示沉默miR-155对细胞具有保护作用,有利于细胞正常生长发育。Qiu等研究表明,miR-155可通过结合环氧合酶2促进蟑螂过敏原诱导的哮喘小鼠模型中的氧化应激反应。在脓毒症小鼠模型中,沉默miR-155表达可抑制氧化应激,减轻肝损伤。本研究结果显示,miR-155抑制剂组细胞ROS含量、MDA浓度较模型对照组和miR-155拟似物组明显降低,SOD活性明显增强,提示沉默miR-155可减轻HLE-B3细胞氧化应激损伤。
SIRT1具有调控细胞周期、抗氧化、抗凋亡等作用。Caspase-3可裂解多种功能蛋白,是细胞凋亡的执行者,在HO诱导的氧化应激细胞模型中表达升高。bcl-2可抵抗细胞凋亡,bax可促进细胞凋亡,二者表达水平与细胞凋亡密切相关。SIRT1在眼部角膜、视网膜、晶状体等组织中表达,与氧化损伤引起的细胞凋亡有关,参与葡萄膜炎、视网膜退行性疾病等眼部疾病的发生和发展过程。临床研究表明,SIRT1在年龄相关性白内障患者LECs中低表达,促使细胞凋亡,加速疾病发展。动物实验显示,糖尿病白内障小鼠LECs中SIRT1表达明显低于正常小鼠,可抑制细胞增生,并促进细胞凋亡。促进SIRT1表达或使用SIRT1激动剂可减少氧化应激导致的LECs损伤,预防白内障发生。本研究结果表明,HO诱导氧化应激损伤细胞中SIRT1、bcl-2蛋白表达水平及bcl-2/bax降低,bax、cleaved-Caspase-3蛋白升高,均提示SIRT1参与细胞氧化应激损伤及凋亡过程,与刘金泉等研究SIRT1参与帕金森模型细胞凋亡和氧化应激损伤的结果一致。同时本研究经双荧光素酶实验验证miR-155与SIRT1存在靶向性,与李世勋等研究miR-155靶向SIRT1调控缺血性心肌细胞的结果相似,提示miR-155可靶向调控SIRT1表达,且沉默miR-155可减轻细胞氧化损伤,减少凋亡。
综上所述,本研究结果表明miR-155在HO诱导的HLE-B3细胞氧化应激损伤模型中高表达,沉默miR-155可减少细胞凋亡,减轻氧化应激损伤,其可能是通过靶向调控SIRT1表达水平发挥细胞保护作用,为临床治疗白内障提供新的靶点和实验依据。但本研究仅针对细胞氧化损伤模型进行探讨,未建立动物模型,未来需进一步探讨miR-155在体内对晶状体混浊的作用及可能机制。
利益冲突
所有作者均声明不存在任何利益冲突作者贡献声明
牛艳桃:实验设计和实施、文章撰写;张丽:实验设计、文章修改及定稿;谢文芳:实验实施、数据采集及分析
