宫颈微偏腺癌35 例临床病理特征分析
徐建勤 袁军
宫颈微偏腺癌(minimal deviation adenocarcinoma,MDA)是一种宫颈少见的非人乳头瘤病毒(human papilloma virus,HPV)相关的腺癌,具有胃型分化的形态学和免疫组织化学特征,活检病理诊断较困难,目前国内临床病例报道逐渐增多,对其认识正逐渐加深。2014 版世界卫生组织将其归类为宫颈黏液腺癌(胃型)。本次研究共收集35 例MDA患者,对其临床资料、组织学形态、免疫标记特点进行回顾性研究分析,并结合国内外最新的研究进展,以期为病理学工作者概括出更精确的诊断依据。
1 资料与方法
1.1 一般资料 收集2006 年1 月至2021 年12 月期间嘉兴市妇幼保健院病理科确诊的MDA 患者35 例,年龄35~71 岁,中位年龄58.00 岁。所有患者均表现为水样黏液性白带增多,其中有15 例患者有宫颈桶状肥厚特征,8 例患者有接触性出血。液基细胞学检测筛查9 例患者有宫颈异常细胞学特征,5 例患者高危型HPV 阳性。肿瘤大多数呈弥漫性分布,肿块并不明显,在超声检查时并无明显特异性改变,宫颈呈弥漫性增厚。初次诊断取标本中活检标本10 例、锥切标本20 例、全子宫切除标本5 例。
1.2 方法 所有标本均经4%中性甲醛固定,石蜡包埋,常规4 mm切片,分别作苏木精-伊红染色(hematoxylin-eosin staining,HE)及免疫组织化学染色。HE 染色前先进行试染3 张切片,观察其细胞浆及细胞核着色情况是否达到常规实验室要求。免疫组化采用SP 法,HIK1083 抗体(鼠源,IgM 型)购自Kanto Chemical 公司,MUC6 单抗购自北京中杉金桥生物技术有限公司,AQP1、p16、p53、Ki-67、CK7、CK20 及二抗、DAB 显色剂购自福州迈新生物技术有限公司。所有实验均设阴、阳性对照。
1.3 结果判读 MDA 的病理诊断标准参照《第五版世界卫生组织女性生殖系统肿瘤分类》,由两名以上高级职称病理医生确认并取得一致意见。免疫组化结果判读及方法:HIK1083、MUC6、AQP1、CK7 及CK20 均定位于细胞质;p16 定位于细胞核/质,p53、Ki-67 定位于细胞核。p16 根据细胞的染色强度和阳性细胞数分为+、++、+++三个级别。Ki-67 根据阳性细胞数占全部肿瘤细胞数进行百分比评分。p53 根据染色强度、阳性染色细胞数综合评分,余抗体定位正确,有阳性表达即判读为阳性。
2 结果
2.1 宫颈MDA组织形态学见图2
由图2 镜下可见,高分化的黏液性腺上皮呈腺样、浸润性生长,正常的宫颈腺上皮小叶状结构消失,腺腔大小不一,小的腺腔呈巢状、片状排列,腔缘大部分光滑,但有明显的挤压现象,部分有类似于乳腺小管癌的泪滴状腺管结构,小腺腔部分有小尖角形成,甚至有多角形成。
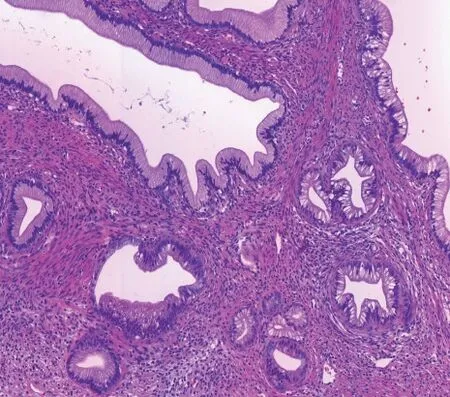
图2 MDA患者病理图(HE染色,×100倍)
2.2 免疫组织化学结果见图3和表1
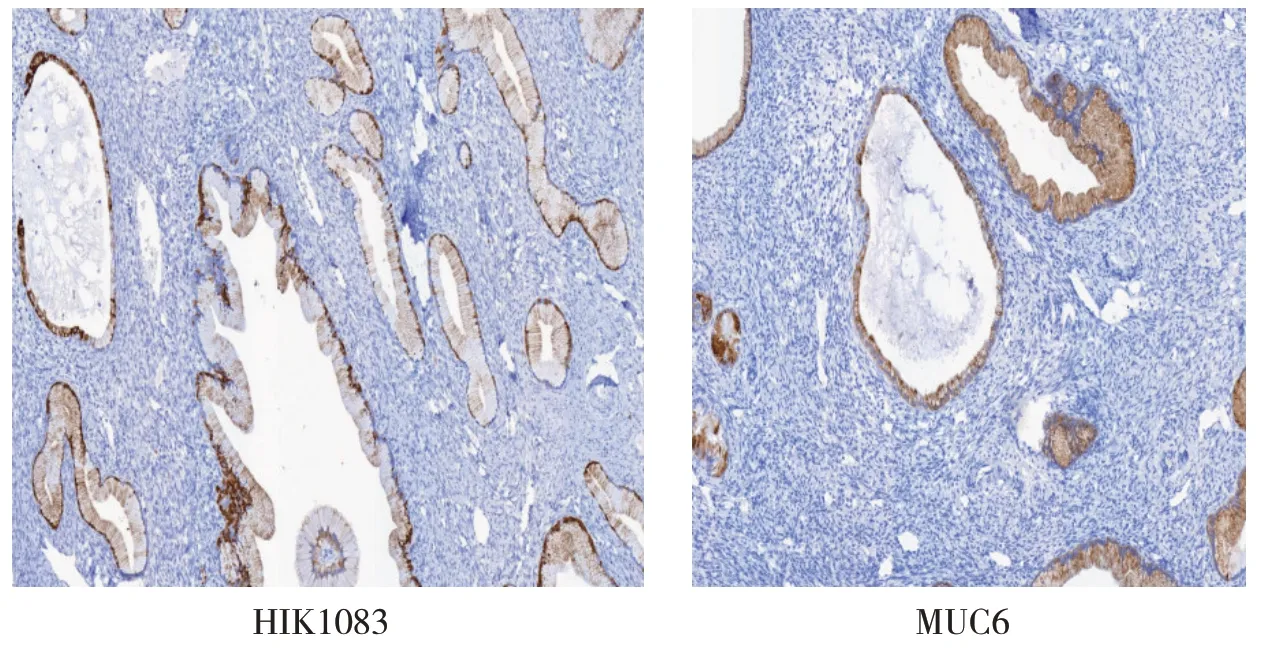
图3 MDA患者免疫组织化学病理图(SP染色,×100倍)
由图3 可见,HIK1083 和MUC6 在宫颈微偏腺癌中呈现出胞浆的阳性表达。高分化癌区域的HIK1083、MUC6 阳性更强,中低分化癌区域阳性较弱,甚至阴性。
由表1 可见,HIK1083、MUC6、AQP1、CK7 以及p53 均具有较高的表达率,均超过了60%,部分甚至达到90%以上,CK20、p16 的表达率偏低,均低于10%。Ki-67表达情况总体来说都是偏低的,阳性均低于15%,只有16 例超过10%,5 例是低于5%的,绝大多数阳性比例位于5%~10%之间。
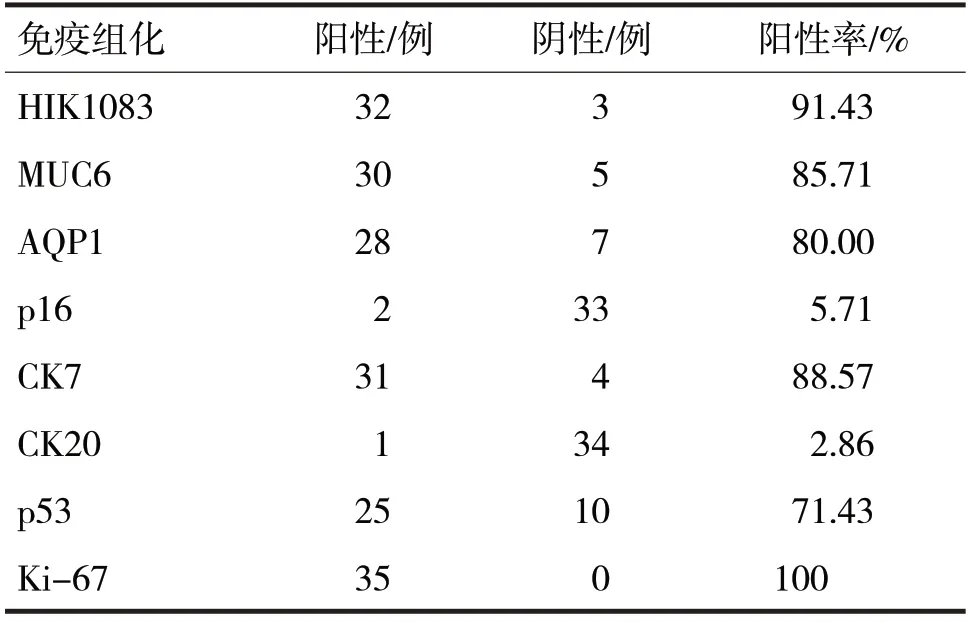
表1 35 例MDA患者免疫组化表达情况
3 讨论
宫颈MDA,又称恶性腺瘤,是发生于子宫颈的一种分化良好的黏液性腺癌,与HPV 感染无关[1],在日常工作中,虽然偶尔有些腺体的细胞核有中度异型,但大多数腺体分化很好,诊断的线索主要有腺体呈角形、间质有硬化表现和血管及神经周围浸润,最可靠的诊断标准是杂乱排列的腺体,浸润深度超过正常宫颈腺体的深度,因为腺体的浸润深度是诊断的关键,大多数宫颈活检不能诊断,属于妇产科病理学中最棘手、也是最迫切需要解决的难题之一。MDA 的液基细胞学及HPV 筛查阳性率非常低,故误诊率和漏诊率高,若能早期确诊,对改善患者的预后有非常重要的价值[2]。MDA 的确诊依靠组织形态学,目前国内关于MDA 辅助诊断使用的免疫标记研究报道多集中于p16、p53、Ki-67、癌胚抗原等等,长期的临床使用观察发现,这些免疫标记具有可重复性差、特异性不高、判断标准不统一等缺陷。本次研究通过对本院确诊的35 例MDA 患者的病理回顾性分析,结合目前国内外最新研究进展,寻求相对特异的免疫学标记以用于辅助临床病理诊断。
本次研究查阅并总结了最新的研究发现,MDA 这类肿瘤具有胃型分化[3],具体体现在以下几点:①该类肿瘤显示了无HPV 相关性,免疫组化p16染色阴性[4];②该类肿瘤显示出了p53基因突变,HPV 感染的相应肿瘤多无p53 基因突变;③该类肿瘤表达胃幽门腺黏液标记:MUC6、HIK1083[5,6];CK7阳性,而CK20 阴性[7];④一半以上的该类肿瘤具有染色体19 p 的肿瘤抑制基因STK11 突变,显示了与Peutz-Jeghers 综合征有关[8],提示该类肿瘤可能是一种全身性、系统性疾病。新的世界卫生组织将MDA 归类为胃型腺癌,说明其具有胃黏膜的黏液分化从而与胃黏膜具有相似的免疫表型,表达胃黏液腺的标记物MUC6、HIK1083,而正常的宫颈黏膜一般不表达这两个标记物。本次研究发现35 例MDA患者HIK1083、MUC6 表达的阳性率分别为91.43%、85.71%,这与Lee等[6]研究结果相符。
回顾整理这35 例MDA 患者的临床资料发现,患者多因临床症状而就诊。液基细胞学检测筛查:9 例患者有宫颈异常细胞学特征;高危型HPV 筛查:5 例患者阳性。由此可见,液基细胞学检测和HPV 筛查对MDA 的发现率较低。临床症状及阴道镜检查对疾病的提示意义相对较大,35 例患者无一例外均有水样黏液性白带增多现象,临床行阴道镜检查,近一半患者有桶状宫颈肥厚的特征。通过观察35 例宫颈MDA 患者的组织形态学发现,肿瘤细胞为具有极高分化的高柱状腺上皮,细胞核浆比低,细胞核位于基底部,核分裂罕见,甚至不见,在大多数细胞学检查中无异常发现,故液基细胞学检测检查很难发现。9 例患者发现存在细胞学异常,是因为其存在有向中、低分化胃型腺癌转化的现象,在转化的过程中,出现了细胞学的异常。仅5 例患者具有高危型HPV 感染,可能和其同时存在鳞状上皮内病变(湿疣样改变,不典型的挖空细胞)有关。所有的患者都有一个共同的组织学特征,即肿瘤性腺上皮浸润性、内生性生长,超出了正常宫颈腺上皮的生理性深度,达到宫颈的纤维肌层,在一个低倍镜视野无法看到腺体往内生长的边缘,而且锥切标本完全看不到腺上皮的边界。因此采用类似于子宫腺肌病的诊断标准(一个低倍镜视野,大约6 mm)来作为衡量标准,具有一定的可行性。肿瘤性腺体往往大小不一,大腺腔的形态比较多样,涵括了囊性扩张、内翻乳头、鹿角样、鸡爪样、分支等各种形态,小腺腔的形态相对单一,偶尔有出角、泪滴样。即使再小的腺腔,依然保持腺上皮高柱状,核位于基底,核浆比很低,核分裂几乎找不到;大的腺腔形态就比较多样化,鸡爪样、鹿角样,出现分支,甚至腺腔内乳头形成,腺腔内搭桥现象甚至形成筛孔。小部分的腺腔只是囊性扩张,但是腺上皮依旧高柱状,非扁平。细胞学特征与小腺腔的无异。在本次研究观察的35 例患者中出现腺上皮异型增生的不足1/5。肿瘤的间质有一定促结缔组织反应,纤维母细胞及肌纤维母细胞增生,这种间质不同于宫颈本身的间质,黏液样基质改变,腺体规则的排列结构被打乱,出现挤压现象,这与腺体多样的形态学形成密不可分。
MDA 在临床诊断时应与以下疾病进行鉴别诊断:①分状宫颈腺体增生:最近的研究发现,这些腺体良好,但是含有幽门腺样黏液(HIK1083、MUC6阳性),其生长通常局限于宫颈间质的内侧一半,被认为是MDA 的癌前病变,特别是细胞出现不典型性的分状宫颈腺体增生[9],其与MDA 的区别主要在于腺体结构的异型和生长方式的不同。液基细胞学上出现五颜六色的含有黏液的细胞团对诊断分状宫颈腺体增生很有帮助[10]。②宫颈高分化腺癌:除了腺体结构的异型外,腺体细胞学也有一定的异型性,常常具有HPV 阳性的特征,并且容易见到核分裂像,通常癌胚抗原阳性表达。③宫颈微腺增生及隧道样腺丛:均为良性病变,临床症状轻微或者无症状,为局限性病变,常常是偶然发现,腺体的结构良好。
MDA的预后比HPV阳性的宫颈腺癌预后差,最终确诊患者均采用广泛全子宫切除术+盆腔淋巴结清扫术处理,其中9 例患者甚至进行了阑尾切除术,术后均结合化疗。随访至2021 年12 月底,其中4 例患者死亡,7 例患者有复发、转移,余患者无复发及转移。

