MRI影像组学模型预测脑胶质瘤IDH-1基因突变和Ki-67表达水平的价值
龙治豪 连海伟 邢变枝 刘仁忠
胶质瘤是最常见的颅内原发性恶性肿瘤。根据病理学特征,WHO将胶质瘤分为Ⅰ~Ⅳ级,描述肿瘤恶性程度,其中异柠檬酸脱氢酶1(isocitric dehydrogenase 1,IDH-1)基因突变和Ki-67表达水平为重要的诊断依据[1]。IDH-1 基因突变是评估胶质瘤病人预后的重要指标,IDH-1 野生型提示预后不良[2,3]。Ki-67 表达水平反应肿瘤增殖情况,对胶质瘤的诊断、治疗和预后评估有指导意义[4]。术前对胶质瘤IDH-1 基因突变和Ki-67 表达水平进行评估,可为胶质瘤病人提供无创的诊断[5]。近年来,研究表明,影像组学可通过大量病人影像学资料的机器深度学习,构建疾病诊断、预后预测模型,为优化疾病的诊断、预后预测提供有价值的信息[6]。本文探讨基于T2WI 序列影像组学模型预测胶质瘤IDH-1 基因突变和Ki-67表达水平的价值。
1 资料与方法
1.1 研究对象 纳入标准:①行肿瘤切除术或活检术;②术后病理诊断为脑胶质瘤,且包含完整的IDH-1或Ki-67检测结果;③具有完整清晰可用于分析的术前MRI影像资料。排除标准:①IDH-1或Ki-67检测结果不明确;②MRI序列不完整,所需序列不清晰或有明显伪影,或者未满足诊断标准;③二次或多次手术。
收集2017年1月至2021年6月经手术切除且病理诊断为脑胶质瘤的临床、病理和术前影像学资料。根据纳入排除标准最终筛选出77例,其中男41例,女36 例;年龄11~73 岁,平均(48.64±13.64)岁。72 例IDH-1 基因检测结果完整(IDH-1 组),75 例Ki-67检测结果完整(Ki-67组),两者检测结果均完整共70 例。IDH-1 组男40 例,女32 例;野生型47例,突变型25例。Ki-67组男40例,女35例;低表达48例,高表达27例。
1.2 影像学资料 选取颅脑轴位T2WI序列,均于武汉大学人民医院放射科采集。仪器设备:3.0 T超导型磁共振扫描仪。扫描参数:TR/TE为3 000 ms/15ms,Flip角为90°,视野为230×230,重建矩阵为128×128,采样矩阵为96×96,层距为2.0 mm,层厚为5.0 mm,激励次数为1次等。
1.3 影像组学分析
1.3.1 感兴趣区域(region of interest,ROI)的选择 使用T2WI轴位像选择ROI(图1A、2A)。将MRI资料上传至ITK-SNAP(Version3.8.0)软件[7],先手动沿肿瘤边缘逐层选择ROI,再由神经外科、影像科高年资医师各一名进行审核,有争议时,由影像学科医师确定。肿瘤区域选择时,参考T1WI和T1WI+C 序列,涵盖囊变或坏死区。
1.3.2 影像组学特征的提取和筛选 首先,进行图像预处理,包括图像归一化、偏置场矫正和重采样。然后,应用Python3.0 和Pyradiomics(https://pyradiomics.readthedocs.io/)处理影像数据和ROI数据,提取特征包括一阶特征、形态特征和纹理特征,其中纹理特征包括灰度共生矩阵参数、灰度行程矩阵参数、灰度尺寸区域矩阵、邻域灰度差矩阵参数、灰度相关矩阵参数、小波滤波特征和高斯-拉普拉斯滤波特征,共提取影像特征1 037个。
应用Python 3.0,将IDH-1野生型病例添加标签“0”,突变病例添加标签“1”。根据Beesley[8]报道方法将Ki-67 表达水平阳性率分为4 级:0~4%为0 级,5%~24%为1 级,25%~49%为2 级,50%以上为3 级。本文将Ki-67 表达水平分为低表达组(0~1 级)和高表达组(2~3级),并分别添加标签“0”和“1”。然后,将影像组学特征值进行标准化、混序,先用两独立样本t检验进行筛选,排除组间无统计学差异的特征值,再用LASSO回归进一步筛选。
1.3.3 影像组学模型的建立及验证 使用Python 3.0和scikit-learn机器学习算法进行影像组学模型建立和验证。将数据按7:3的比例分为训练集和测试集,分别用于影像组学模型的建立和验证。使用随机森林和参数优化后的支持向量机两种分类器建立影像组学模型。最后,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,并计算曲线下面积(area under curve,AUC)判断模型预测IDH-1基因突变和Ki-67表达水平的灵敏度、特异度。
2 结果
2.1 影像组学特征筛选结果IDH-1 组t检验筛选出47 个特征,再通过LASSO 回归筛选出11 个特征(图1B~D;表1)。Ki-67组t检验筛选出17个特征,再通过LASSO回归筛选出10个特征(图2B~D;表2)。

表1 IDH-1组特征值及其权重

表2 Ki-67组特征值及其权重
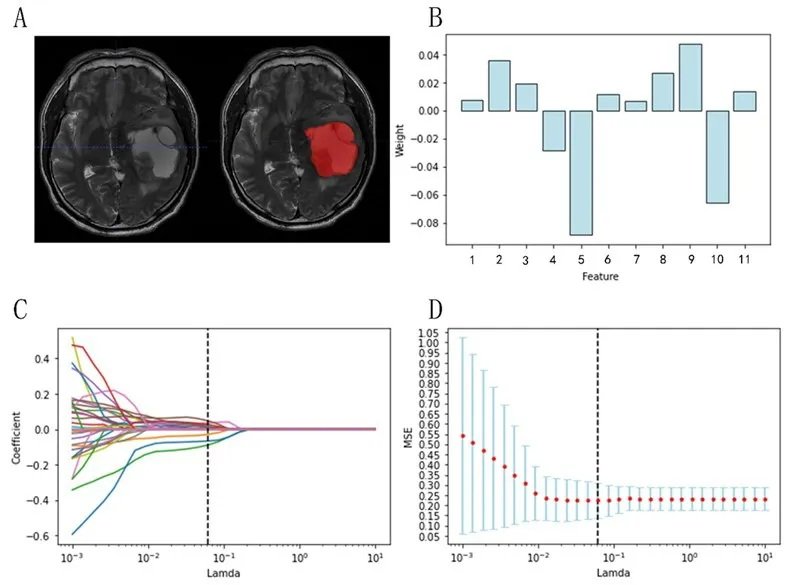
图1 基于MRI T2WI影像组学模型预测胶质瘤IDH-1突变特征筛选结果
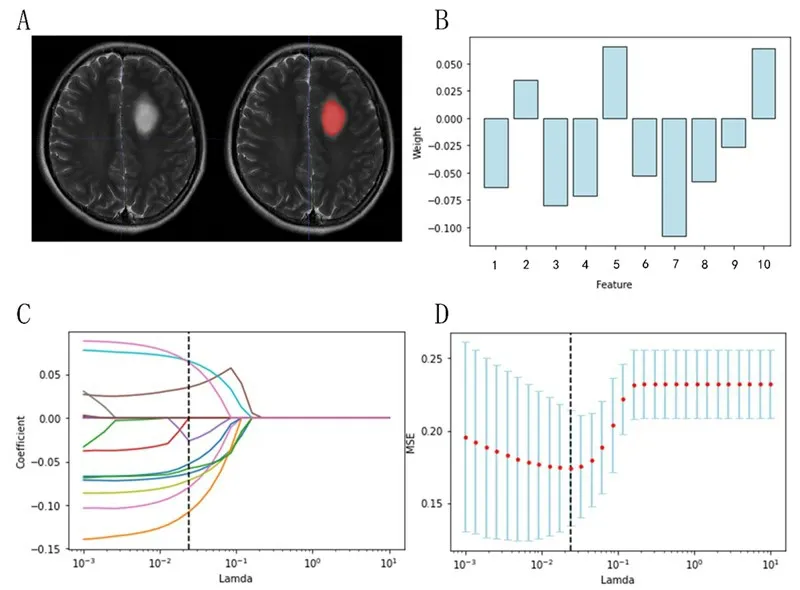
图2 基于MRI T2WI影像组学模型预测胶质瘤Ki-67表达水平特征筛选结果
2.2 影像组学模型的预测效能 支持向量机和随机森林两种影像组学模型的敏感度、特异度与AUC 见表3,其ROC曲线见图3。两种模型的对IDH-1基因突变和Ki-67表达水平均有较好的预测效能(AUC>0.850),两种模型的预测准确率均大于0.880,其中随机森林比支持向量机的效果更好。

图3 不同机器学习分类器的ROC曲线

表3 机器学习ROC曲线结果
3 讨论
IDH-1 基因突变和Ki-67 表达水平对胶质瘤病人的预后评估具有重要意义。IDH-1突变型胶质瘤病人预后优于野生型病人[9],IDH-1 突变型胶质瘤DNA 甲基化增加、生物学侵袭行为减少、总生存期延长[10]。胶质瘤Ki-67 表达水平明显高于正常脑组织[11],Ki-67表达水平越高,肿瘤恶性程度越高、预后越差[12]。IDH-1 基因突变和Ki-67 表达水平的检测依赖肿瘤组织病理检查,是一种具有侵袭性的检查,而且还存在取样误差、有时临床难以获得满意的数据等局限性。
影像组学作为一个新兴的技术,近年来被广泛应用于肿瘤的诊断、治疗及预后的评价和预测,基于T2WI、T1WI+C、ADC、PET-CT/MR 的影像组学分析、深度学习神经网络等均表现出对胶质瘤基因型和肿瘤分级的良好预测能力,其中多序列和多临床参数的影像组学联合模型进一步提高了对肿瘤IDH等基因突变的预测能力[13]。MRI T2WI序列影像学特征表现为胶质瘤诊断的依据之一[14]。本文提取MRI T2WI序列影像组学特征,构建支持向量机和随机森林两种机器学习分类器,预测胶质瘤IDH-1 基因突变和Ki-67 表达水平,预测准确率超过88.0%。这提示MRI T2WI 序列影像组学特征对胶质瘤病理结果具有较高的预测准确率,可为临床确定肿瘤手术方案、评估胶质瘤预后等提供依据。
值得注意的是,灰度相关矩阵参数中的大依赖高灰度增强特征表示具有较高灰度值的高相关性体素的联合分布情况,此特征在鉴别IDH-1 基因突变中有特殊意义。此外,IDH-1 组特征值权重绝对值最大的特征为一阶特征平均值,这说明肿瘤组织T2WI 序列平均灰度在鉴别IDH-1 基因突变中可能具有较高的价值。这提示对T2WI 序列信号分布均匀的胶质瘤,可以通过T2WI序列灰度预测IDH-1基因突变情况。但是对有钙化或者囊变的胶质瘤瘤,这种评估就相对比较困难。
Ki-67 组特征值权重绝对值最大的特征为偏度特征,表明体素灰度平均值分布的不对称性;其次是逆差归一化特征,表示图像局部均匀程度。这两个特征分别从整体和局部描述灰度的不均匀程度。这提示T2WI灰度分布不均匀程度反映Ki-67表达水平的差异。
本文的局限性:①样本相对较少;②回顾性研究,存在选择性偏倚;③未根据胶质瘤级别进行亚组分析;④为单序列影像组学分析;⑤由于分类器原理,无法分析各特征值与基因型的具体关系;⑥未对预测结果进行交叉验证。
总之,本文基于MRI T2WI序列建立支持向量机和随机森林机器学习分类器预测胶质瘤IDH-1基因突变和Ki-67 表达水平,准确率均超过88.0%,具有良好的应用价值,为胶质瘤术前预测提供了新思路。

