拟康定乌头和林地乌头中二萜生物碱类化学成分研究
韩 萌 ,王腾飞,单连海,陈 琳 ,黄 帅 ,周先礼 *
1.西南交通大学生命科学与工程学院,四川 成都 610031
2.西南交通大学宜宾研究院,四川 宜宾 644004
毛茛科(Ranunculaceae)乌头属AconitumL.植物在全世界共有300余种,我国是该属植物资源最丰富的国家,大约有200种,主要分布于我国四川、云南、西藏及东北等地[1]。乌头属植物在我国药用历史上早有记载,常用于治疗风寒湿痹、关节疼痛、内分泌失调等疾病[2]。研究表明,二萜生物碱(diterpenoid alkaloids,DAs)是乌头属植物的特征性成分[3],具有多种药理活性。其中,高乌甲素(lappaconitine)、草乌甲素(bulleyaconitine A)和3-乙酰乌头碱(3-acetylaconitine)已广泛应用于临床治疗各种疼痛[4]。因此,乌头属植物有巨大的研究研究价值。拟康定乌头A.rockiiFletcher et Lauener为毛茛科乌头属植物,主产于我国云南中甸,生于海拔3900~4100 m山地矮杜鹃灌丛中或灌丛边[5],目前已经从该种植物中分离得到36个单体化合物,包括31个乌头碱型C19-二萜生物碱、2个7,17断裂型C19-二萜生物碱、1个海替生型C20-二萜生物碱、1个瓦那文型C20-二萜生物碱和1个双二萜型二萜生物碱,其中 ludaconitine、indaconitine、transconitine B和14-benzoylneoline表现出较好的拒食活性[6-8]。林地乌头A.nemorumPopov是毛茛科乌头属乌头亚属植物,分布于中国新疆地区以及哈萨克斯坦等地,生于海拔2060~3000 m山地草坡或云杉下[5],其块根有剧毒,炮制后具有祛风散寒、止痛等功效[9-10],目前已从该种植物中分离得到7个化合物,包括5个乌头碱型C19-二萜生物碱和2个呐哌啉型C20-二萜生物碱[11-12]。拟康定乌头和林地乌头为乌头属植物,均含有结构复杂、活性多样的特征性二萜生物碱,但目前对该2种植物化学成分研究都不够彻底,为了丰富乌头属植物的化学成分结构类型,为后续开展相关生物活性研究提供物质基础,因此本实验对这2种植物的化学成分进行了进一步研究,从拟康定乌头中分离鉴定了6个二萜生物碱,其中包括1个新的乌头碱型C19-二萜生物碱,命名为拟康定乌碱甲(rockiitine A,1),以及5个已知的二萜生物碱,分别为工布乌碱(kongboendine,2)、大渡乌碱(franchetine,3)、膝乌宁碱甲(genicunine A,4)、滇乌碱(yunaconitine,5)和黄乌生(vilmorisine,6),化合物2~6为首次从拟康定乌头中分离得到;从林地乌头中分离得到10个化合物,分别鉴定为塔拉萨敏(talatisamine,7)、14-乙酰塔拉萨敏(14-acetyltalatisamine,8)、卡马考宁(cammaconine,9)、16-epipyroaconine(10)、乌头碱(aconitine,11)、3-脱氧乌头碱(3-deoxyaconitine,12)、牛扁碱(lycoctonine,13)、甲基牛扁碱(methyllycaconitine,14)、德尔色明甲(delsemine A,15)、德尔色明乙(delsemine B,16)。其中,化合物9~16为首次从该植物中分离得到。
1 仪器与试药
FTIR-650傅里叶变换红外光谱仪(天津港东科技股份有限公司;Bruker AV 400,Bruker AV 600核磁共振仪(德国Bruker公司);Acquity UPLC/Xevo G2-S TOF mass-超高效液-质联用仪(Waters);岛津LCMS-8040;RE-2000A-旋转蒸发仪(上海亚荣生化仪器厂);Perkin-Elmer 341-旋光光度计(Perkin-Elmer公司)、优普UPT-I-20L落地式纯水机(四川优普超纯科技有限公司)、ZF-20 C型紫外光谱仪、电子分析天平(托利多上海仪器有限公司)。薄层色谱硅胶GF254(青岛海洋化工厂)、硅胶H(青岛海洋化工厂)、碱性氧化铝(100~200目,天津致远化学试剂公司)和ODS-18反相硅胶(40~60µm,Merck公司)。
拟康定乌头于2018年8月采自云南丽江中甸县,经云南中医学院李国栋教授鉴定为拟康定乌头A.rockiiFletcher et Lauener,标本(2018HS0802)留存于西南交通大学生命科学与工程学院;林地乌头于2015年8月采自新疆乌鲁木齐后峡及伊犁阿合牙孜沟,由中国科学院植物华南园杨亲二研究员鉴定为林地乌头A.nemorumPopov,标本(C.Ren & L.Wang 825)保存于中国科学院华南植物园。
2 提取与分离
将拟康定乌头根块(10.9 kg)粉碎后,用95%乙醇冷浸5次,每次7 d,滤液减压浓缩得总浸膏1.0 kg,用温水溶解后加入稀盐酸调pH至2~3,用石油醚进行4次萃取,每次3.0 L,减压浓缩后得到石油醚部分。水溶液用氨水调pH至9~10,二氯甲烷萃取至无生物碱,减压浓缩萃取液,得到总生物碱150.0 g。采用正相硅胶柱色谱(石油醚-醋酸乙酯100∶1~0∶1梯度洗脱)将总生物碱分为6个部分A~F。对F部分进行硅胶柱色谱(二氯甲烷-甲醇90∶1~0∶1),进行梯度洗脱得6个部分F1~F6。F2部分通过硅胶柱色谱(石油醚-丙酮80∶1~1∶1+1%二乙胺),得到2个部分F2-1和F2-2;F2-2部分通过硅胶柱色谱(石油醚-丙酮50∶1~2∶1+1%二乙胺)得到化合物2(16.0 mg)和3(15.0 mg);F3部分通过硅胶柱色谱(石油醚-丙酮60∶1~1∶1+1%二乙胺)得到化合物5(11.0 mg);F4部分通过硅胶柱色谱(石油醚-丙酮50∶1~1∶1+1%二乙胺)得到3个部分F4-1~F4-3,F4-1经硅胶柱色谱(石油醚-醋酸乙酯50∶1~1∶1+1%二乙胺)得化合物6(20.3 mg)。F5部分通过硅胶柱色谱(石油醚-丙酮30∶1~1∶1+1%二乙胺)得到2个部分F5-1~F5-2,F5-1经反相柱色谱(甲醇-水5∶1)得到化合物1(9.0 mg),F6部分用硅胶柱色谱(二氯甲烷-甲醇70∶1~0∶1)得到3个部分F6-1~F6-3,F6-2部分用碱性氧化铝柱色谱(氯仿-甲醇18∶1),得到化合物4(13.0 mg)。
林地乌头(5.0 kg)提取方法同上,得到总生物碱6.6 g。生物总碱经硅胶柱色谱(二氯甲烷-甲醇1∶0~0∶1)得到3个部分I~III。I部分经反复硅胶柱色谱(石油醚-丙酮-二乙胺40∶1∶0.1~15∶1∶0.1)得到化合物10(5.0 mg)、11(10.0 mg)和12(6.0 mg)。II部分通过反复硅胶柱色谱(石油醚-丙酮-二乙胺10∶1∶0.1~5∶1∶0.1)得到8(220.0 mg)、7(160.0 mg),再经氧化铝柱色谱(氯仿-甲醇120∶1)得到化合物13(13.0 mg)。III部分通过反相硅胶柱色谱(甲醇-水25∶75~50∶50)得到化合物9(15.0 mg)、14(7.0 mg)、15和16(11.0 mg)。
3 结构鉴定
化合物1:白色无定形粉末,[α]20D+21.6°(c0.20,CHCl3),通过HR-ESI-MS推测其分子式为C33H47NO7(m/z570.351 8 [M+H]+,计算值570.353 7,C33H48NO7)。红外光谱表明该化合物结构中具有芳环(1603、1491、1451 cm−1)和酯羰基(1721 cm−1)。1H-和13C-NMR图谱显示该化合物结构中具有1个氮乙基 [δH1.08 (3H, t,J= 7.2 Hz), 2.46 (1H, m),2.50 (1H, m);δC13.6 q, 49.1 t],1个苯甲酰氧基 [δH7.52 (1H, t,J= 7.8 Hz), 7.42 (2H, t,J= 7.2 Hz), 8.07(2H, d,J= 7.2 Hz);δC131.0 s, 132.6 d, 129.9 d×2,128.3 d×2, 166.7 s],5个甲氧基 [δH3.13, 3.26, 3.30(各3H, s), 3.31 (6H, s);δC48.5 q, 56.4×2 q, 58.7 q,59.3 q]。该化合物共有33个碳原子,除上述取代基团外,13C-NMR结合DEPT谱图可知剩余的19个碳信号中包含6个亚甲基(δC26.6, 35.0, 29.7, 35.5,80.4, 54.1)、10个次甲基(δC38.2, 45.2, 45.7, 48.6×2,61.3, 76.3, 83.2, 85.5, 83.4)和3个季碳(δC39.1, 50.8,78.5)(表1)。以上结构信息表明,化合物1是具有1个氮乙基、5个甲氧基和1个苯甲酰氧基取代的乌头碱型C19-二萜生物碱[13]。仔细分析HMBC图谱可知(图1),δH3.26, 3.31, 3.13 (各3H, s)分别与δC85.5 (d),δC83.3 (d),δC78.5(s) 存在远程相关,δH3.31 (6H, s) 与δC83.2 (d)、δC80.4 (t) 相关,证明5个甲氧基分别位于C-1、C-6、C-8、C-16和C-18位。进一步分析HMBC图谱,δH5.01 (1H, t,J= 4.8 Hz) 与酯羰基(δC166.7 s)、C-16(δC83.4 d)、C-8(δC78.5 s)有远程相关,证明苯甲酰氧基连接在C-14位。

图1 化合物1的结构及关键1H-1H COSY、HMBC (a) 和NOESY (b) 相关Fig.1 Key 1H-1H COSY, HMBC (a), NOESY (b) correlations of compound 1
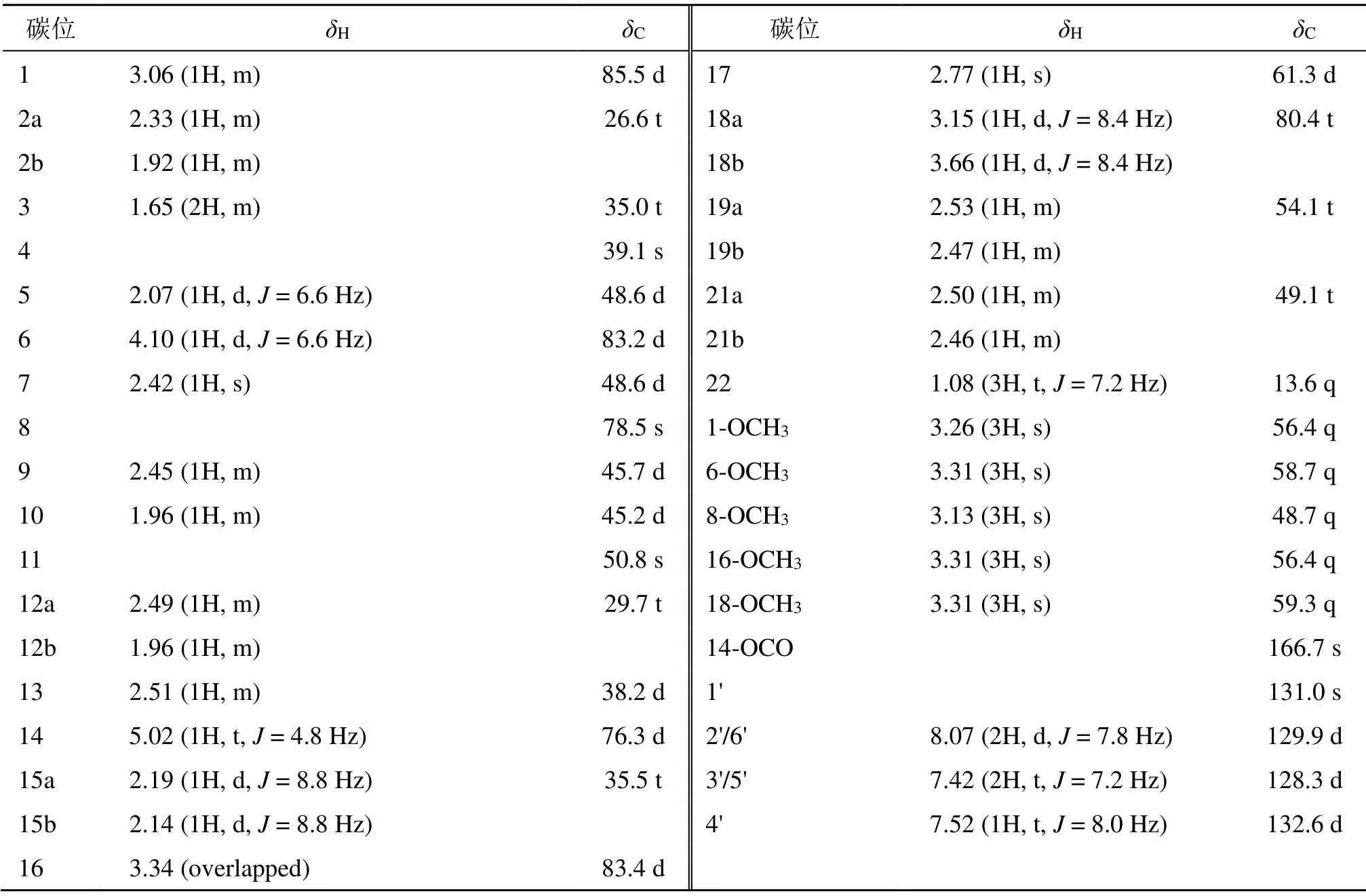
表1 化合物1的核磁数据 (600/150 MHz, CDCl3)Table 1 NMR data of compound 1 (600/150 MHz, CDCl3)
化合物1的立体构型通过NOESY确定(图1)。Hβ-10与H-14、H-1,Hβ-9与H-6,Hα-17与H-16有远程相关,说明1-OCH3、6-OCH3与14-OBz为α型,16-OCH3为β型。因此,确定了化合物1的结构(图1),命名为拟康定乌碱甲(rockiitine A)。
化合物2:无色固体,分子式为C32H43NO7。HR-ESI-MSm/z: 554.371 3 [M+H]+。1H-NMR (400 MHz, CDCl3)δ: 8.01 (2H, d,J= 8.8 Hz, H-2′, 6′),6.91 (2H, d,J= 8.8 Hz, H-3′, 5′), 5.76 (1H, d,J= 5.6 Hz, H-7), 5.11 (1H, d,J= 4.8 Hz, H-14β), 3.25, 3.28,3.36, 3.85 (各3H, s, 4×OCH3), 1.01 (3H, t,J= 7.2 Hz,N-CH2CH3);13C-NMR数据见表2。以上数据与文献报道一致[14],故鉴定化合物2为kongboendine。
化合物3:无色固体,分子式为C31H41NO6。HR-ESI-MSm/z: 524.305 2 [M+H]+。1H-NMR (400 MHz, CDCl3)δ: 8.05 (2H, d,J= 8.2 Hz, H-2′, 6′),7.54 (1H, dd,J= 10.6, 4.4 Hz, H-4′), 7.43 (2H, t,J=7.8 Hz, H-3′, 5′), 5.77 (1H, d,J= 5.2 Hz, H-7), 5.14(1H, d,J= 4.8 Hz, H-14β), 4.40 (1H, d,J= 6.2 Hz,H-6), 3.24, 3.36, 3.28 (各3H, s, 3×OCH3), 1.01 (3H,t,J= 7.2 Hz,N-CH2CH3);13C-NMR数据见表2。以上数据与文献报道基本一致[15],故鉴定化合物3为franchetine。
化合物4:白色粉末, 分子式为C22H35NO4。HR-ESI-MSm/z: 378.463 7 [M+H]+。1H-NMR (400 MHz, CDCl3)δ: 1.07 (3H, t,J= 7.2 Hz,N-CH2CH3),3.28 (3H, s, OCH3), 3.85 (1H, d,J= 8.0 Hz, H-16α),4.25 (1H, t,J= 5.2 Hz, H-14β);13C-NMR的数据见表2。以上数据与文献报道基本一致[16],故鉴定化合物4为genicunine A。
化合物5:白色粉末,分子式为C35H49NO11。HR-ESI-MSm/z: 660.265 4 [M+H]+。1H-NMR (400 MHz, CDCl3)δ: 1.09 (3H, t,J= 7.2 Hz,N-CH2CH3),1.32 (3H, s, 8-OCOCH3), 3.14, 3.24, 3.28, 3.53, 3.85(各3H, s, 5×OMe), 4.86 (1H, d,J= 5.0 Hz, H-14β),6.92 (2H, d,J= 7.4 Hz, H-2′, 6′), 8.01 (2H, d,J= 7.4 Hz, H-3′, 5′);13C-NMR数据见表2。上述数据与文献报道基本一致[17],故鉴定化合物 5为yunaconitine。
化合物6:白色粉末,分子式为C26H39NO6。HR-ESI-MSm/z: 462.285 6 [M+H]+。1H-NMR (400 MHz, CDCl3)δ: 1.05 (3H, t,J= 7.2 Hz,N-CH2CH3),5.67 (1H, d,J= 6.0 Hz, H-7), 4.89 (1H, brs, H-14),3.26, 3.18和3.22 (3H, s, 3×OCH3);13C-NMR数据见表2。上述数据与文献报道基本一致[15],故鉴定化合物6为vilmorisine。
化合物7:白色粉末,分子式C24H39NO5。ESI-MSm/z: 422.29 [M+H]+。1H-NMR (600 MHz,CDCl3)δ: 1.06 (3H, t,J= 7.2 Hz,N-CH2CH3), 3.36,3.32, 3.28 (各 3H, s, 3×OMe), 2.07 (3H, s,14-OCOCH3);13C-NMR的数据见表2。以上数据与文献报道基本一致[18],故鉴定化合物 7为talatisamine。
化合物8:白色粉末,分子式C26H41NO6。ESI-MSm/z: 464.30 [M+H]+。1H-NMR (600 MHz,CDCl3)δ: 1.09 (3H, t,J= 7.2 Hz,N-CH2CH3), 3.31,3.30, 3.28 (各3H, s, 3×OCH3);13C-NMR的数据见表2。以上数据与文献基本一致[19],故鉴定化合物8为14-acetyltalatisamine。

表2 化合物2~8的13C-NMR数据 (100 MHz, CDCl3)Table 2 13C-NMR data of compounds 2—8 (100 MHz, CDCl3)
化合物9:白色粉末,分子式C23H37NO5。ESI-MSm/z: 408.27 [M+H]+。1H-NMR (600 MHz,CDCl3)δ: 1.09 (3H, t,J= 7.2 Hz,N-CH2CH3), 3.36,3.28 (各3H, s, 2×OMe);13C-NMR的数据见表3。以上数据与文献报道一致[20],故鉴定化合物9为cammaconine。
化合物10:白色粉末,分子式C25H39NO8。ESI-MSm/z: 482.27 [M+H]+。1H-NMR (600 MHz,CDCl3)δ: 1.06 (3H, t,J= 7.2 Hz,N-CH2CH3), 3.74,3.30, 3.28, 3.22 (各3H, s, 4×OMe);13C-NMR的数据见表3。上述数据与文献报道基本一致[21],故鉴定化合物10为16-epipyroaconine。
化合物11:白色粉末,分子式C34H47NO11。ESI-MSm/z: 646.32 [M+H]+。1H-NMR (600 MHz,CDCl3)δ: 1.10 (3H, t,J= 7.2 Hz,N-CH2CH3), 3.30,3.27, 3.17 (各3H, s, 3×OMe), 7.46 (2H, t,J= 7.2 Hz,H-3′, 5′), 7.57 (H, t,J= 7.2 Hz, H-4′), 8.03 (2H, d,J=7.2 Hz, H-2′, 6′);13C-NMR的数据见表3。以上数据与文献报道一致[22],故鉴定化合物11为aconitine。

表3 化合物9~16的13C-NMR数据 (150 MHz, CDCl3)Table 3 13C-NMR data of compounds 9—16 (150 MHz, CDCl3)
化合物12:白色粉末,分子式C34H47NO10。ESI-MSm/z: 630.32 [M+H]+。1H-NMR (600 MHz,CDCl3)δ: 1.07 (3H, t,J= 7.2 Hz,N-CH2CH3), 3.26,3.15 (各3H, s, 2×OMe), 7.45 (2H, t,J= 7.2 Hz, H-3′,5′), 7.56 (1H, t,J= 7.2 Hz, H-4′), 8.02 (2H, d,J= 7.2 Hz, H-2′, 6′);13C-NMR的数据见表3。以上数据与文献报道一致[23],故鉴定化合物 12为3-deoxyaconitine。
化合物13:白色粉末,分子式C25H41NO7。ESI-MSm/z: 468.29 [M+H]+。1H-NMR (600 MHz,CDCl3)δ: 1.09 (3H, t,J= 7.2 Hz,N-CH2CH3), 3.54,3.37, 3.26, 3.08 (各3H, s, 4×OMe);13C-NMR的数据见表3。以上数据与文献报道基本一致[24],故鉴定化合物13为lycoctonine。
化合物14:白色粉末,分子式C37H50N2O10。ESI-MSm/z: 683.35 [M+H]+。1H-NMR (600 MHz,CDCl3)δ: 1.10 (3H, t,J= 7.2 Hz,N-CH2CH3), 3.45,3.40, 3.36, 3.26 (各3H, s, 4×OMe);13C-NMR的数据见表3。以上数据与文献报道基本一致[24],故鉴定化合物14为methyllycaconitine。
化合物15和16:白色粉末,分子式C37H53N3O10。ESI-MSm/z: 700.38 [M+H]+;1H-NMR(600 MHz, CDCl3)δ: 1.08 (3H, t,J= 7.2 Hz, H-22),11.09/11.13 (1H, brs, NH), 8.65 (1H, m, H-3′), 7.95(1H, m, H-6′), 7.75 (1H, m, H-4′), 7.08 (1H, m, H-5′);13C-NMR的数据见表3。以上数据与文献报道[25]相符,故鉴定化合物15和16为一对区域异构二萜生物碱的混合物,即delsemine A和B。
4 讨论
本研究从拟康定乌头和林地乌头中共分离鉴定16个化合物,包括1个新的乌头碱型C19-二萜生物碱和15个已知化合物(化合物2~16),包括3个7,17断裂型C19-二萜生物碱、9个乌头碱型C19-二萜生物碱和3个牛扁碱型C19-二萜生物碱,符合肖培根教授提出的显柱乌头系和准噶尔乌头系生物碱成分特征[26]。该研究进一步丰富了2种药用草乌的化学成分研究,为其植物化学分类提供了参考依据,也为后续开展相关生物活性研究提供了一定的物质基础。研究表明,C19-二萜生物碱通常具有抗肿瘤、抗炎和杀虫等生物活性[27-29],因此后期拟对分离所得化合物进行相关活性测定,为天然产物的开发利用提供参考。
利益冲突所有作者均声明不存在利益冲突